和厚朴酚对糖尿病心肌病作用的实验研究
2020-10-29柯培雄张许岑怡张贵平张根水
柯培雄,张许,岑怡,张贵平,张根水
(广州医科大学药理学系,广东 广州 511436)
糖尿病是一种以糖代谢紊乱为主要特征的内分泌代谢综合疾病,是胰岛素相对或绝对不足,或利用缺陷而引起的,表现为高血糖和糖尿,多伴有眼、肾、神经、皮肤、血管和心脏等组织、器官的慢性并发症[1]。糖尿病心肌病(diabetic cardiomyopathy,DCM)是一种区别于高血压、冠状动脉疾病和其他心血管疾病的特殊心肌病,其病理组织表现为心肌细胞的肥大凋亡及心肌间质纤维化[2],心功能改变主要表现为舒张功能不全而收缩功能受损不明显,心室壁弹性减弱[3]。
和厚朴酚(Honokiol,HKL)是从中药厚朴中提取的主要活性成分之一,是厚朴酚的同分异构体[4],具有抗菌、抗氧化、抗炎、抗肿瘤、中枢性肌肉松弛和神经抑制作用、抗病原微生物、降低胆固醇等药理作用[5]。和厚朴酚具有降低2型糖尿病小鼠血糖值并改善血脂紊乱导致的胰岛素抵抗作用[6]。心血管药理研究提示和厚朴酚具有明显改善自发性高血压大鼠心血管功能[7],并在成年大鼠心肌细胞实验上证实其具有抑制心肌细胞收缩及降低心肌细胞内钙离子浓度作用[8]。目前和厚朴酚对DCM的作用及其机制鲜有报道,本实验采用SD大鼠离体心肌成纤维细胞培养技术与糖尿病HFpEF小鼠模型研究和厚朴酚对心肌纤维化与心功能作用的影响,为DCM的预防治疗提供新的理论依据。
1 材料
1.1 药物及试剂
和厚朴酚(HPLC>98%,Aladdin,H111272);低糖及高糖DMEM培养基、胎牛血清、胰蛋白酶、II型胶原酶、DMSO(Gibco公司);PMSF细胞蛋白酶抑制剂(凯基生物);链脲佐菌素(Sigma公司);4%多聚甲醛(捷威斯生物科技有限公司);PBS缓冲液(赛维尔生物科技有限公司);20×ECL发光液(Cell signal公司);RIPA裂解液(碧云天生物技术有限公司);苏木素伊红(HE)染色试剂盒、Masson三色染色试剂盒(索莱宝生物科技有限公司);兔抗大鼠FN抗体(Boster公司);兔抗大鼠Collagen I抗体、兔抗大鼠Collagen Ⅲ 抗体(Bioworld公司);兔抗大鼠CTGF抗体(Affinity公司);兔抗大鼠TGF-β抗体、兔抗大鼠GSK-3β抗体、兔抗大鼠β-catenin抗体(Abcam公司);山羊抗兔IgG/HRP标记抗体(Cell signal公司);其他化学试剂(广州化学试剂厂)。
1.2 主要仪器
CO2培养箱HF90(Heal Force);5810R低温高速离心机(Hettich);H1010420电热恒温水浴锅(上海精宏); WIX-EP300垂直电泳转膜系统(BioRad);Epoch酶标仪(BeckMan);OPTIMAX自动洗片机(Kodak);ChemiDox XRS+凝胶成像分析系统(UVP);Eclipse Ni-U正置显微镜(Nikon);Vevo-2100彩色超声成像系统(Visual Sonics)。
1.3 实验动物
SD大鼠,6周龄,体质量(200±5)g,SPF级,雄性,由广东省医学动物实验中心提供,生产许可证号SCXK(粤)2013-0002。C57BL/6小鼠,6周龄,体质量(20±2)g,SPF级,雄性,由广州中医药大学实验动物中心提供,生产许可证号SCXK(粤)2013-0034。
2 方法
2.1 细胞培养、分组与给药
将成年SD大鼠断颈处死,沿剑突正中线左侧进行开胸操作,无菌条件下取出心脏,放入装有4 ℃、0.01 mmol/L预冷PBS的培养皿中,剪掉心房及结缔组织等,PBS反复冲洗,心脏剪成1 mm3大小组织块。将组织碎块置入无菌离心管中,加入0.2%Ⅱ型胶原酶,反复吹打混匀,均置于37 ℃、200 r/min摇床上消化60 min。消化结束后加入等体积10% FBS/DMEM进行终止,1 000 r/min离心5 min,弃上清。重复3次,加入10% FBS/DMEM反复吹打混匀移入培养皿中,放入37 ℃、5%(φ) CO2培养箱中,差速贴壁60~90 min,贴壁的细胞为心肌成纤维细胞,将未贴壁的心肌细胞等弃掉,重新加入10% FBS/DMEM,每隔1天换液1次。
2.1.1 HKL对高糖诱导心肌纤维化的影响 将细胞实验分为6组,即正常对照组:10% FBS的低糖DMEM;高糖模型组:10% FBS的高糖DMEM;低剂量HKL组,加入0.1 μmol/L的HKL溶液;中剂量HKL组,加入0.3 μmol/L的HKL溶液;高剂量HKL组,加入1 μmol/L的HKL溶液;溶剂对照组:加入DMSO(<0.1%)。
2.1.2 HKL对GSK-3β诱导心肌纤维化的影响 将细胞实验分为4组,即高糖模型组:10% FBS的高糖DMEM;GSK-3β组:加入100 nmol/L GSK-3β;HKL加GSK-3β组,先加入100 nmol/L GSK-3β孵育1 h,再加入1 μmol/L的HKL溶液;溶剂对照组:加入DMSO(<0.1%)。
2.1.3 HKL对GSK-3β表达的影响 将细胞实验分为3组,即高糖模型组:10% FBS的高糖DMEM;HKL组:加入1 μmol/L的HKL溶液;溶剂对照组:加入DMSO(<0.1%)。
细胞给药后培养12 h后,采用Western blot法检测CollagenⅠ、Collagen Ⅲ、TGF-β、CTGF、FN、GSK-3β和β-catenin的表达水平。
2.2 1型糖尿病模型制备与分组
根据前期的研究[9],将C57小鼠连续6 d腹腔注射小剂量链脲佐菌素(STZ)60 mg/(kg·d),正常对照组给予等量柠檬酸缓冲液。STZ注射结束之后第4天测小鼠随机血糖,连续测量3 d,小鼠血糖>16.7 mmol/L认为是糖尿病小鼠,每隔1周测量小鼠随机血糖。
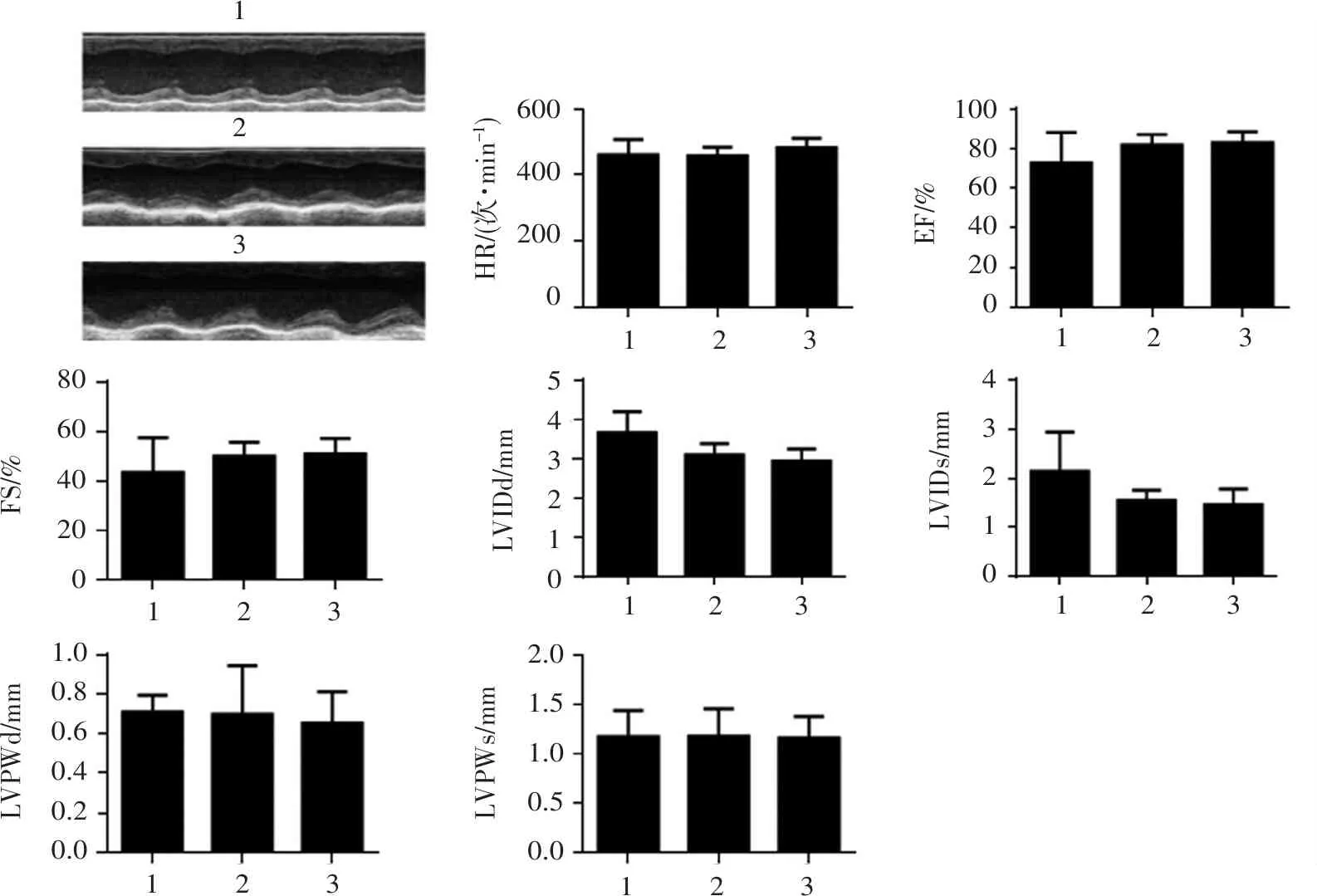
根据实验设计将C57小鼠分为3组,每组5只,分别为:正常对照组、糖尿病模型组、HKL组。小鼠成模后第8周开始给药25 mg/(kg·d),给药组连续腹腔注射给药4周,正常对照组和糖尿病模型组给予等剂量生理盐水。采用M 型超声心动图测量左室收缩与舒张功能:心律(HR)、左室舒张末内径(LVIDd)、左室收缩末期内径(LVIDs)、左室后壁舒张末期厚度(LVPWd)、左室后壁收缩末期厚度(LVPWs)、左室射血分数(EF)、左室收缩百分率(FS)、左室舒张早期E峰最大流速(E)、左室舒张晚期A峰最大流速(A)、舒张早期E峰下降时长(MVDT)、等容舒张时长(IVRT),计算E/A比值。所有数值均通过连续5个心动周期计算获得。
2.3 心肌组织病理学检测
心脏组织经4%(φ)多聚甲醛固定后制作石蜡切片后进行HE染色(烤片-二甲苯脱蜡水化-苏木素染色-酸性乙醇溶液分化-乙醇脱水透明-中性树胶封片)和Masson三色染色(烤片-二甲苯脱蜡水化-苏木素染色-酸性乙醇溶液分化-丽春红品红染液染色-磷钼酸水溶液分化-苯胺蓝染色-乙醇脱水透明-中性树胶封片),最后在正置显微镜下观察心肌组织变化及纤维化程度。
2.4 数据处理与统计学方法
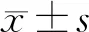
3 结果
3.1 不同浓度HKL对心肌纤维化的影响
Western blot结果表明(图1),与正常对照组相比,高糖培养能明显促进心肌纤维化相关蛋白CollagenⅠ、Collagen Ⅲ、TGF-β、CTGF和FN的表达(P<0.05);0.1、0.3、1 μmol/L的HKL组可以明显抑制高糖诱导的心肌纤维化相关蛋白表达(P<0.05);高剂量HKL组较低剂量HKL组降低心肌纤维化相关蛋白表达的效果更为明显;DMSO对心肌纤维化相关蛋白的表达无明显影响(P>0.05)。
CollagenⅠCollagenⅢTGF-βGTGFFNβ-actinCollagenⅠ/β-actin2.01.51.00.50.00.80.60.40.20.0###*123456123456123456CollagenⅢ/β-actin###*###*###*###*0.60.40.20.0TGF-β1/β-actin2.01.51.00.50.0CTGF/β-actin2.52.01.51.00.50.0FN/β-actin123456123456123456
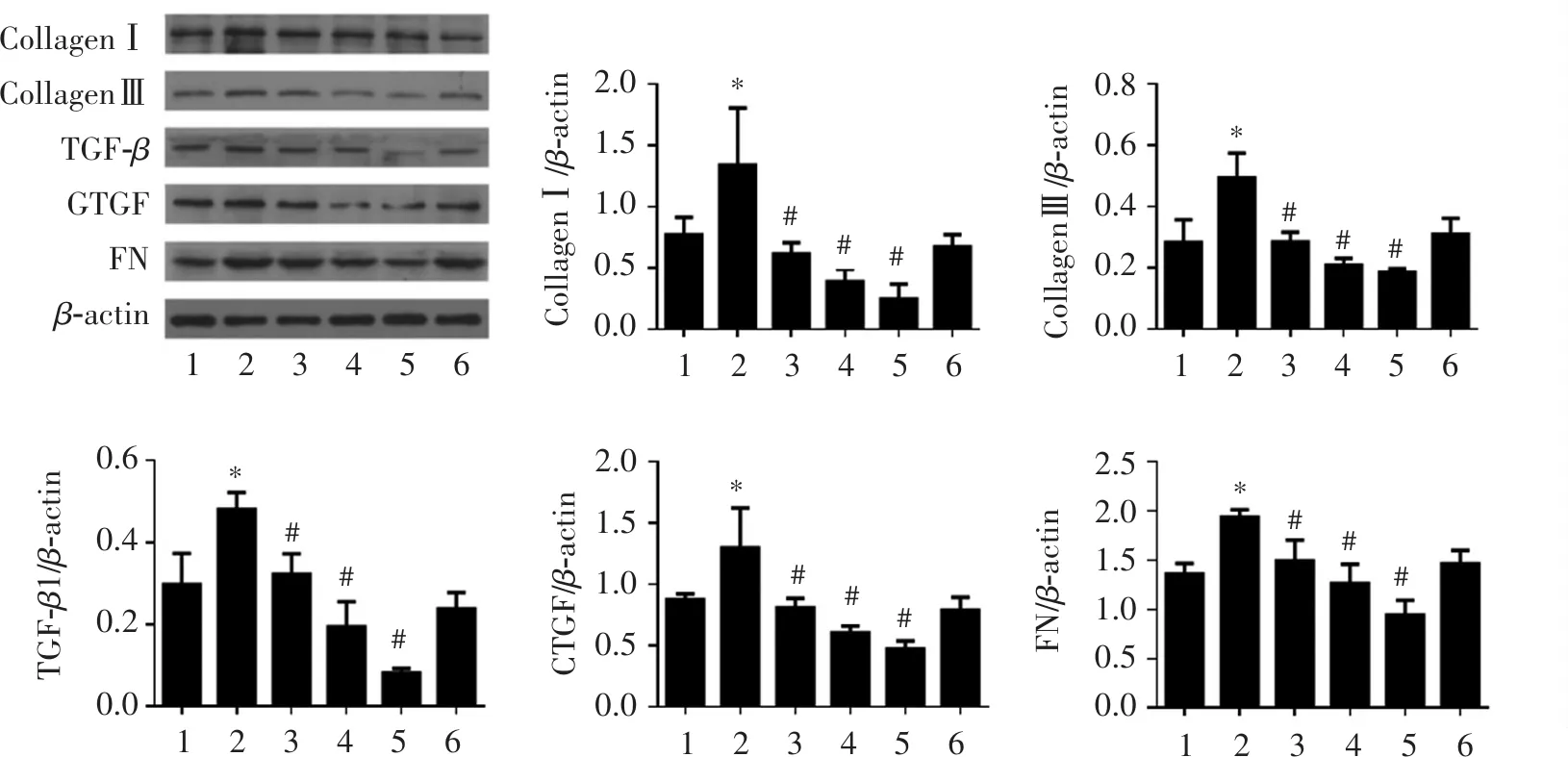
3.2 HKL对GSK-3β 诱导心肌纤维化的影响
Western blot结果表明(图2),与高糖模型组相比,GSK-3β能明显促进心肌纤维化相关蛋白CollagenⅠ、Collagen Ⅲ、TGF-β、CTGF和FN的表达(P<0.05),并且促进β-catenin的表达(P<0.05);HKL加GSK-3β组可以明显抑制GSK-3β诱导的心肌纤维化相关蛋白表达(P<0.05),并且抑制β-catenin的表达(P<0.05);DMSO对心肌纤维化相关蛋白和β-catenin的表达无明显影响(P>0.05)。
CollagenⅠCollagenⅢTGF-βCTGFFNβ-actinCollagenⅠ/βactin1.51.00.50.0#*#*#*#*#*#*2.01.51.00.50.0CollagenⅢ/β-actin123412341234123412342.01.51.00.50.02.52.01.51.00.50.0TGF-β1/β-actinCTGF-/β-actinFN/β-actin3210β-cateninβ-actin3210β-catenin/β-actin1.HG;2.100nmol/LGSK-3β;3.100nmol/LGSK-3β+1μmol/LHKL;4.DMSO。与高糖模型组相比:*P<0.05;与100nmol/LGSK-3β组相比:#P<0.05。图2HKL对GSK-3β诱导心肌纤维化的影响(n=5)Figure2EffectofHKLontheexpressionofmyocardialfibrosis-relatedproteinsinducedbyGSK-3β(n=5)1234
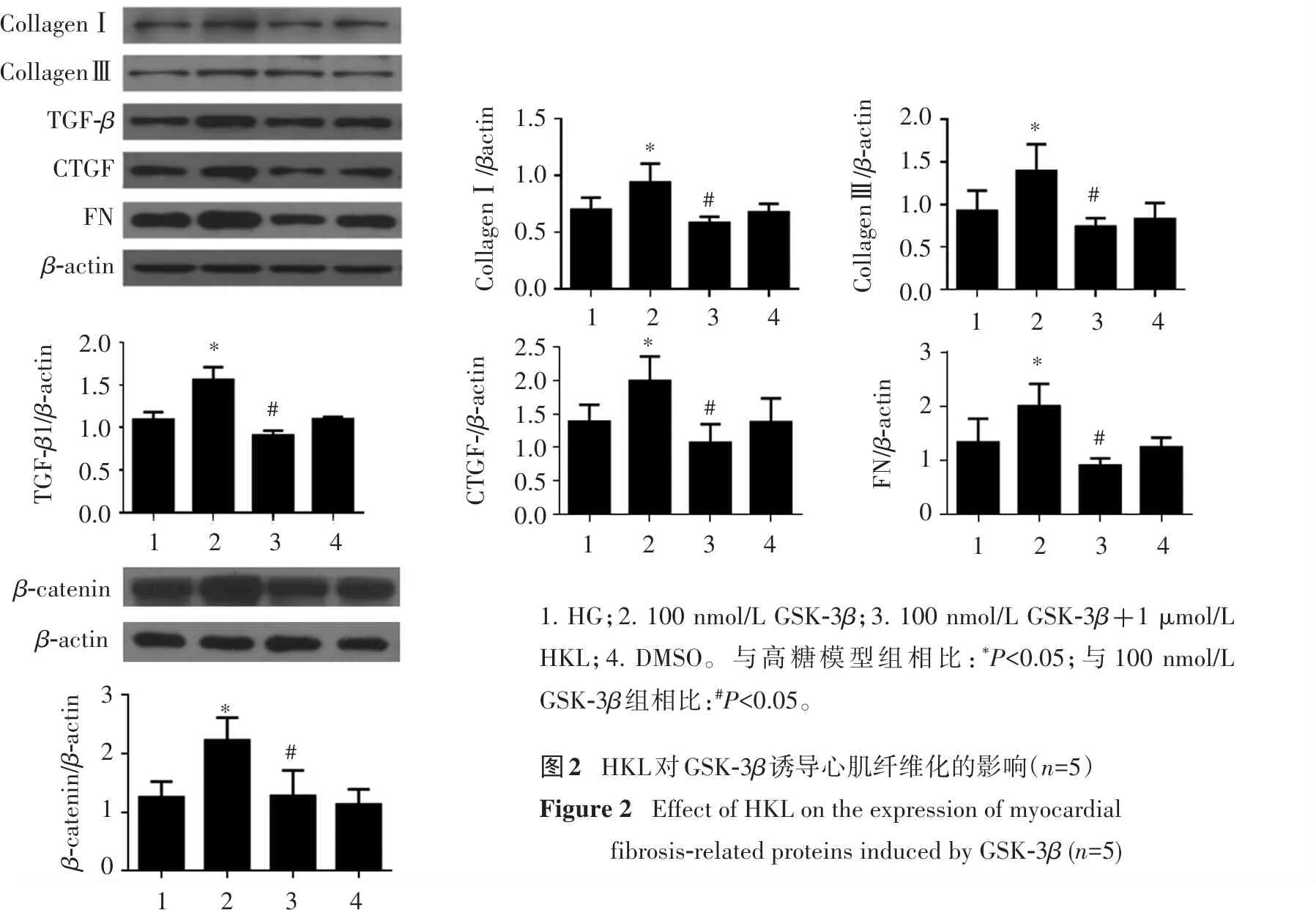
3.3 HKL对GSK-3β表达的影响
Western blot结果表明(图3),与高糖模型组相比,HKL能明显降低β-catenin的表达(P<0.05),DMSO对β-catenin的表达无明显影响(P>0.05)。
3.4 HKL对糖尿病HFpEF小鼠心功能的影响
超声结果表明(图4、图5),与高糖模型组相比,HKL对收缩功能指标HR、LVIDd、LVIDs、LVPWd、LVPWs、EF、FS无显著性影响(P>0.05);明显改善模型小鼠出现舒张功能障碍的典型特征,即E/A比值下降,MVDT和IVRT延长(P<0.05)。
3.5 HKL对糖尿病小鼠心肌结构和心肌间质胶原沉积的影响
染色结果表明(图6),与正常对照组相比,高糖模型组HE染色显示明显的心肌结构异常,心肌纤维断裂,细胞结构紊乱,细胞间隙增大,Masson染色观察到心肌间质胶原沉积增加。与高糖模型组相比,HKL组HE染色显示心肌结构明显改善,心肌纤维断裂减少,细胞结构正常,细胞间隙减小,Masson染色观察到心肌间质胶原沉积减少。
GSK-3ββ-actinGSK-3β/β-actin1.51.00.50.0123*
1. Control; 2. DM; 3. HKL。
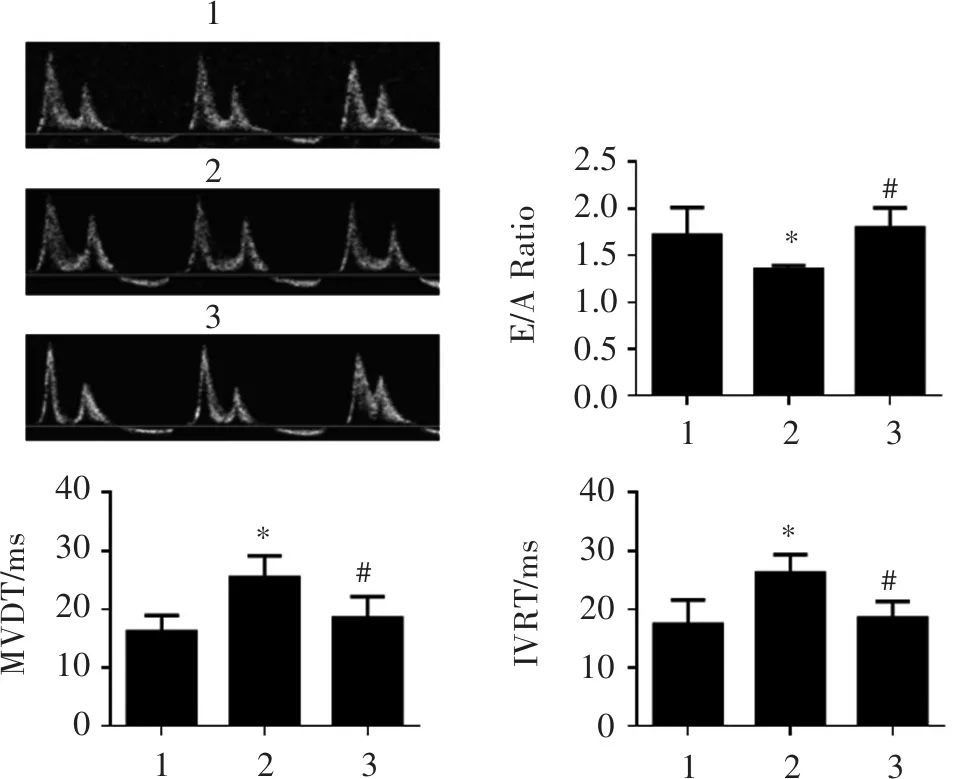
123#*#*#*2.52.01.51.00.50.0IVRT/msMVDT/ms123123123403020100403020100E/ARatio
4 讨论
心肌纤维化的病理特征为心肌间质成纤维细胞异常增殖,细胞外基质沉积异常增加,心室壁顺应性下降,最终导致心脏收缩与舒张功能异常。引起心肌纤维化的因素有很多,而GSK-3β是其重要因素之一。Wang等[10]通过构建心脏敲除GSK-3β小鼠模型证明GSK-3β的失活能抑制糖尿病心肌纤维化,同时给野生糖尿病小鼠使用GSK-3β特异性抑制剂后发现心脏纤维化被完全抑制。β-catenin是Wnt信号转导通路的下游元件,激活Wnt信号使细胞内游离β-catenin的水平上升。Wnt信号传导使GSK-3β被抑制,β-catenin不能被正常水解而积累,过量的β-catenin进入细胞核与目的基因结合,促进细胞增殖[11]。Hahn等[12]研究表明,β-catenin过表达可刺激新生大鼠心肌成纤维细胞的增殖、分化,诱导心肌细胞肥大。心脏Wnt/β-catenin信号通路增强是糖尿病心肌病HFpEF重要特征。β-catenin与GSK-3β之间存在着密切联系,两者之间相互作用可能受到HKL的调控。实验结果表明HKL能显著降低GSK-3β诱导的纤维化相关蛋白CollagenⅠ、Collagen Ⅲ、TGF-β、CTGF和FN的表达水平并显著降低GSK-3β和β-catenin的表达水平,说明HKL通过下调GSK-3β和β-catenin抑制纤维化。
实验利用腹腔注射STZ建立糖尿病HFpEF模型。有研究表明,1型糖尿病患者心脏舒张功能障碍比收缩功能障碍更为常见[13],存在舒张早期充盈减少,心房充盈增加,等容舒张时间及减速时间延长[14]。
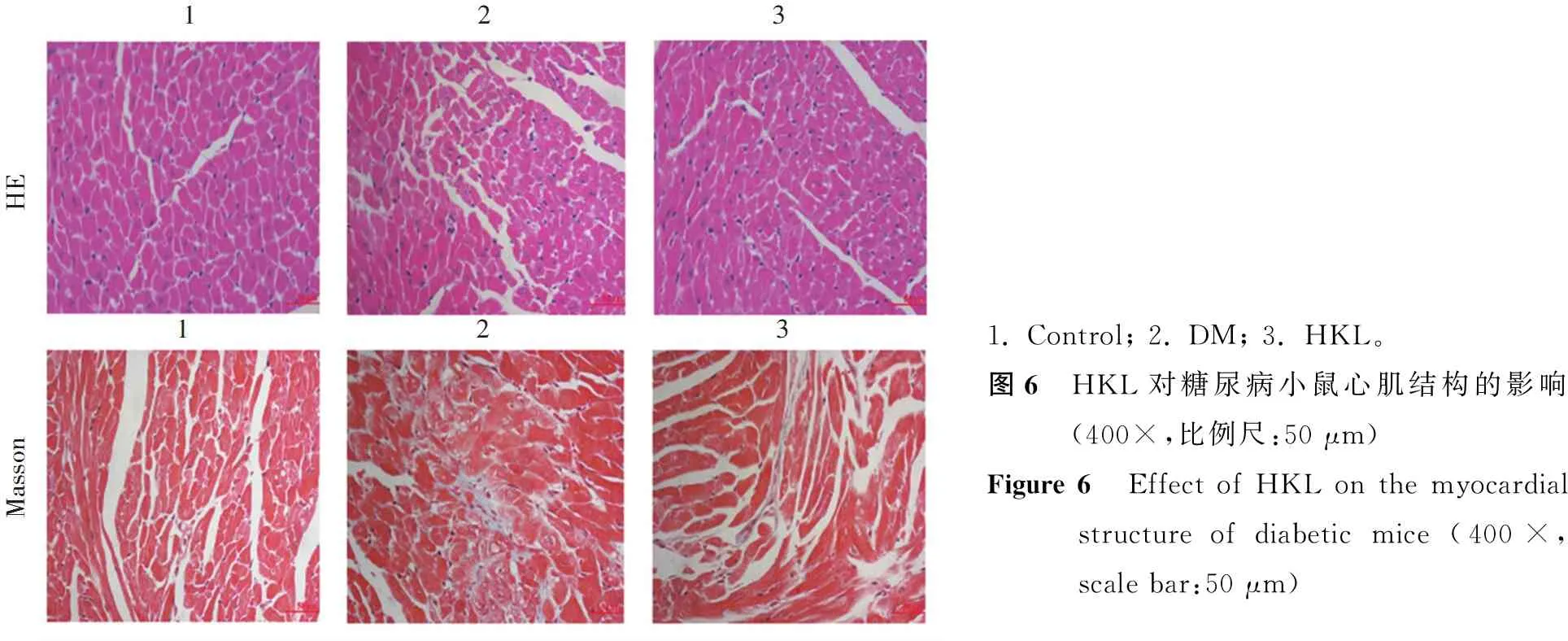
1. Control; 2. DM; 3. HKL。图6 HKL对糖尿病小鼠心肌结构的影响(400×,比例尺:50 μm)Figure 6 Effect of HKL on the myocardial structure of diabetic mice (400×,scale bar:50 μm)
本实验结果表明HKL对糖尿病小鼠左室收缩功能无显著性影响,但是对舒张功能影响显著,即E/A比值下降,MVDT与IVRT明显延长。此外,HKL可明显改善糖尿病心肌结构损伤和胶原沉积,对心肌细胞有一定的保护作用。
本研究结果表明,HKL 可通过下调GSK-3β和β-catenin抑制纤维化,从而改善糖尿病心肌结构与舒张功能,防止糖尿病心力衰竭的发生与发展。已知GSK-3β介导纤维化作用还与TGF-β1/Smad-3信号通路有关。本实验结果发现,高糖培养可以促进心肌成纤维细胞TGF-β的表达。利用GSK-3β作为纤维化诱导剂,也可以促进高糖模型中心肌成纤维细胞TGF-β的表达,说明TGF-β信号通路参与了GSK-3β诱导心肌纤维化的作用。在糖尿病诱导的心肌纤维化中,β-catenin、GSK-3β、TGF-β之间存在着密切联系,涉及GSK-3β、β-catenin、TGF-β1/Smad-3的信号网络已成为心肌纤维化的一个强有力的调节因子。然而,该信号网络的具体机制尚不清楚,需要进一步研究。
