西洞庭湖沉水植物分布格局对环境因子及水文情势差异的响应*
2020-10-29郭凯迪张晓波刘培中雷光春曾喜凡曾伟坤
郭凯迪,张晓波,刘培中,雷光春**,吕 偲**,曾喜凡,曾伟坤
(1:北京林业大学东亚-澳大利西亚候鸟迁徙研究中心,北京 100083) (2:北京林业大学生态与自然保护学院,北京 100083) (3:西洞庭湖国家级自然保护区管理局,汉寿 415900)
沉水植物对维持湖泊生态系统结构和功能具有至关重要的作用. 沉水植物作为重要的初级生产者,是水生动物和水鸟的食物资源,为鱼类、底栖动物、浮游动物、迁徙候鸟等提供栖息地、避难所和繁殖地[1-2],维持湿地生物多样性. 沉水植物能够吸收水体和底质中的营养盐、重金属,有效净化水质,增加水体透明度,抑制藻类暴发[3-5]. 除此之外还能有效加固底泥,保护湖底,加快湖水中悬浮物的沉降,抑制风浪和湖流. 因此,保护和恢复沉水植物群落是维持湿地生态系统健康的重要基础.
受人为干扰与气候变化等因素影响,长江流域的生态系统格局正在发生剧烈改变,三峡水库及上游规模巨大的梯级水库群改变了中下游水沙特征,水文情势与水文节律发生了变化[6-7],中下游湖泊湿地植物也随之发生改变[8-9],水生生物多样性持续下降[10-11]. 湖泊湿地沉水植物呈现衰退趋势,成为“长江大保护”要面临的首要问题之一. 洞庭湖是长江中游的大型通江湖泊,具有丰富的生物多样性与重要的生态系统服务,是“长江经济带”所依托的重要生态安全屏障,但其面临着众多威胁. 长江中下游水文节律的改变,对洞庭湖的水资源、水环境和湿地生态系统产生许多不利影响[12-15]. 主要表现为湿地面积萎缩、植被格局改变、极端事件频发等,其中由于枯水期提前导致湖区低水位洲滩提前出露,苔草、芦苇群落向湖心倾移,挤占沉水植物的生存空间,导致沉水植物衰减严重,打破了现有植被格局的正向演替[16]. 李娜等[17]研究结果表明,长江中下游一些湖泊的水生植物多样性总体呈现下降趋势,沉水植物、漂浮植物多样性下降明显,而挺水植物呈现增长态势. 洞庭湖沉水植物的衰减对其他生物也产生了影响,例如以苦草属(Vallisneria)冬芽为食的白鹤种群数量在洞庭湖显著下降[18].
恢复湖泊沉水植物需要充分掌握环境因子的影响. 沉水植物生长和分布因环境因子不同而存在很大差异,大量研究表明水深[19-21]、流速[22-23]、光照强度[24-25]、底质[26-27]、水体营养盐[28]等多种环境因子都在不同程度上影响沉水植物的物种组成、生物量和分布. 植物生长需要充足的光照,水深、透明度都会影响沉水植物可接收的光照强度,进而影响光合作用. 通常情况下,水体越深透明度越低,光照强度越弱,当光照强度低于植物所需的光补偿点时会抑制其生长[29]. 此外,营养盐浓度也会影响植物生长和生存,研究表明,水体营养盐浓度对植物生物量有显著影响,在一定营养盐浓度范围内,营养盐升高有助于沉水植物生长,当水体营养盐浓度过高时,会造成水藻暴发从而降低水体透明度,抑制沉水植物生长[30]. 另外,底泥营养含量也对植物分布影响显著,尤其是植物体内的磷元素主要依靠根从底泥中吸收,其生长与底泥有极大关系,当底泥过于肥沃时会对沉水植物造成胁迫,影响其生长和分布[31-32]. 水文节律的变化会直接影响湖泊的水深、光照强度等环境因子,进而影响沉水植物的生长. 水位波动会改变湿地生境间的水文连通性,形成不同的生境梯度[33-34],并对透明度、营养盐等环境因子产生季节性影响[35].
当前长江中游沉水植物相关研究多见于阻隔湖泊[36-39],而鄱阳湖与洞庭湖两大型通江湖泊较阻隔湖泊具有更大的水文波动,因此需要加强沉水植物对水体环境因子与水文情势响应的研究. 鄱阳湖相关研究表明,水文情势对湿地植物的物种组成及沉水植物生长具有明显影响[39-40]. 受江湖关系改变、水文情势变化、洲滩杨树种植等因素影响,近年来洞庭湖水生生态系统也发生了变化,沉水植物的分布格局及其对环境因子与水文情势的响应尚待进一步掌握,成为湖泊湿地恢复与保护的阻碍,因此需要开展相关研究. 考虑到西洞庭湖位于沅澧二水交汇处,具有河、滩、湾、自由连通及退渔还湿后半阻隔的不同子湖等,生境异质性高,且此前该区域沉水植物分布调查资料较少,故本研究选取西洞庭为研究区域,分别在2018年和2019年夏季丰水期开展了野外调查,拟探明该区域沉水植物分布格局,并分析沉水植物对环境因子及年际不同水文情势的响应,研究影响沉水植物分布与生长的关键因子,为洞庭湖地区沉水植物的恢复和保护提供科学依据.
1 研究方法
1.1 研究区概况
西洞庭湖(28°47′~29°07′N,111°57′~112°17′E)位于湖南省常德市汉寿县境内,位于洞庭湖西部,是洞庭湖地势最高的区域. 根据西洞庭湖不同典型水文连通特征以及湿地恢复工程所在位置,本研究选取了12处生境在2018年和2019年丰水期(8月6-15日)开展调查,并依据水文连通状况进行了分类,具体信息见表1及图1(部分区域仅调查一年是由于调查时遇到当地渔民布设的渔网阻拦,导致无法乘船进入样点).

表1 采样地分类
在上述调查样地,遵循区域覆盖和随机取样兼顾的原则,调查了98个采样点,各采样点位置如图1所示.
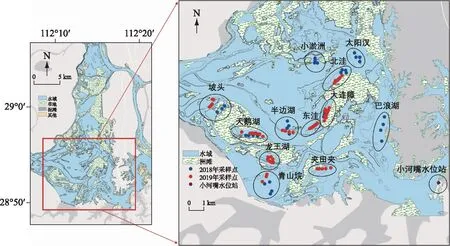
图1 研究区调查样点示意Fig.1 Location of sampling sites in study area
1.2 样品采集及数据获取
沉水植物的采集采用多次重复小样方的取样方法,每个点位用自制铁耙式采草器(长30 cm、宽10 cm)在约100 m2的范围内随机采集沉水植物10次,每次采集面积为0.3 m2,采样水深范围为0~4 m,手持式GPS(Garmin GPSMAP 63csx)记录样点的经纬度. 采样后将采集到的植物冲洗干净,确定物种类别并记录,将植物带回实验室在烘箱内80℃烘72小时后测量干重.
现场使用美国speedtech SM-5A手持式声呐测深仪测定水深(WD)、赛氏盘测定水体透明度(SD)、FP311直读式流速仪测定流速(V),并使用采水器采集水样500 mL,彼得森采泥器采集底泥约200 g, 每个样点3次重复. 水样带回实验室进行pH、总氮(TN)、总磷(TP)、叶绿素a(Chl.a)浓度测定,其中TP浓度采用钼酸铵分光光度法测定,TN浓度采用碱性过硫酸钾消解紫外分光光度法测定,Chl.a浓度采用乙醇分光光度法测定. 底泥风干后分别采用重铬酸钾容量法、凯氏定氮法、氢氧化钠熔融-钼锑抗比色法测定土壤有机质(S-OM)、总氮(S-TN)、总磷(S-TP)含量.
因西洞庭湖为通江湖泊,沉水植物的生长与分布现状是调查时间之前水文情势与环境因子影响的结果,调查区域距离小河嘴国家水位站(图1)较近,故本研究使用小河嘴水位站的水位数据来指示西洞庭湖水位变化情况,水位数据来自全国水雨情信息网(http://xxfb.mwr.cn/ssIndex.html?type=2). 每年3月洞庭湖进入涨水期,4月沉水植物进入生长期,本研究调查时间为2018年和2019年丰水期(8月6-15日),沉水植物的分布与生物量现状受8月之前的水位波动影响. 因此选取4月1日至8月5日的水位数据进行比较分析. 调查样点的海拔高程(Alt)根据采样点的经纬度坐标利用数字高程模型(DEM)提取,淹没频率(Ff)根据小河嘴水位站的水位监测数据结合西洞庭湖遥感影像图提取[41-42],均在ArcGIS 10.2软件中完成.
1.3 数据分析
本研究共98个采样点,其中有沉水植物分布的样点60个,无沉水植物分布的样点38个. 群落优势种依据各采样点每种沉水植物的生物量干重确定. 为获取沉水植物出现与否(有或者无)的环境因子差异,本研究用IBM SPSS statistics 22软件进行独立样本T检验,分别比较了有植物分布和无植物分布样点各环境因子的差异.
为分析不同沉水植物的物种与具体环境因子之间的关系,本研究运用R 3.6.1软件进行除趋势对应分析(DCA),第一轴的长度为3.5301,介于3~4之间,之后采用RDA线性模型排序(冗余分析)分析不同沉水植物物种生物量与环境因子的相关性,无沉水植物分布样点在本分析中去除. 随后用蒙特卡罗置换测试(Monte Carlo permutation test)来检验影响沉水植物分布的主要环境因子[43].
2 结果
2.1 西洞庭湖沉水植物分布
本研究调查共记录到沉水植物5种,分别是刺苦草(Vallisneriaspinulosa)、金鱼藻(Ceratophyllumdemersum)、马来眼子菜(Potamogetonmalaianus)、穗状狐尾藻(Myriophyllumspicatum)和轮叶黑藻(Hydrillaverticillata).
2018年共调查8个样地,其中6个样地发现有沉水植物分布,小淤洲、巴浪湖、青山垸的所有采样点均未调查到沉水植物分布. 36个采样点中有17个采样点发现沉水植物,刺苦草出现的总频数最高(13)(表2),并且5个区域都有分布,属于优势种. 马来眼子菜总频数最低(4). 在全部有沉水植物的样点中,刺苦草和轮叶黑藻的平均生物量最高,均为2.98 g/m2,其次是金鱼藻、穗状狐尾藻,马来眼子菜的平均生物量最低,为0.99 g/m2(表2).
2019年共调查9个样地,其中7个样地发现有沉水植物分布,龙王湖和青山垸未调查到沉水植物分布. 62个采样点中有43个采样点有沉水植物分布. 刺苦草出现频数为26,并且在7个样地都有分布,分布较为广泛、均匀,是西洞庭湖沉水植物的优势物种. 金鱼藻总频数为19,马来眼子菜总频数为9,轮叶黑藻的总频数为7,穗状狐尾藻出现频数最低(6). 穗状狐尾藻的平均生物量最高,为2.66 g/m2,其次是马来眼子菜、金鱼藻和刺苦草,轮叶黑藻的平均生物量最少,为0.26 g/m2(表3).

表2 2018年西洞庭湖各地区沉水植物生物量(g/m2)*
*N代表采样点的数量,F代表发现沉水植物的样点数量.
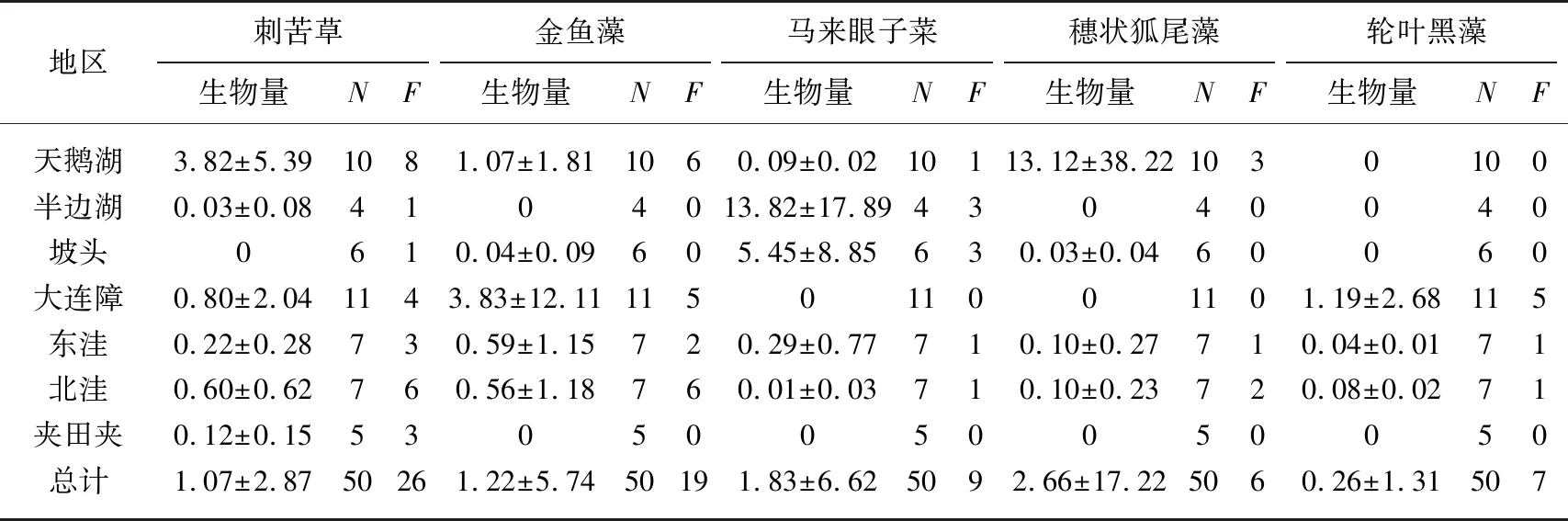
表3 2019年西洞庭湖各地区沉水植物生物量(g/m2)*
*N代表采样点的数量,F代表发现沉水植物的样点数量.
2.2 沉水植物物种与生物量年际变化
在11个样地中,天鹅湖、半边湖、坡头、大连障、北洼5个样地在2018年和2019年均调查到有沉水植物分布. 对比2年沉水植物的生物量,结果表明坡头、大连障、北洼2018年生物量显著高于2019年(图2). 坡头2018年调查到的5种沉水植物均有分布,2019年仅有马来眼子菜、极少量的金鱼藻和穗状狐尾藻,且生物量明显低于2018年;大连障两年调查结果中沉水植物的物种分布较为稳定,为刺苦草、金鱼藻和轮叶黑藻,2019年的生物量略低于2018年;北洼连续2年的调查中,沉水植物的种类组成较为稳定,刺苦草、金鱼藻、马来眼子菜、穗状狐尾藻和轮叶黑藻均有分布,但是2年的生物量差距较大,2018年总生物量为54.31 g/m2,2019年总生物量仅为1.87 g/m2. 天鹅湖2018年只有刺苦草分布,2019年沉水植物还发现穗状狐尾藻、金鱼藻和马来眼子菜;半边湖物种单一,2018年仅调查到刺苦草,2019年仅有马来眼子菜和极少量刺苦草.
2.3 沉水植物分布样点环境因子差异
对60个有沉水植物分布样点和38个无沉水植物分布样点的11个环境因子进行对比(表4),结果发现WD、SD、pH、Chl.a、S-TP存在显著差异,水体TN和TP、S-OM和TN以及Ff和Alt在有、无沉水植物分布的样点中均无显著性差异. 流速在有沉水植物分布的样点中其值均为0 m/s.
相比无沉水植物分布样点的WD(范围1.5~5.2 m),有沉水植物分布样点的WD(范围0.15~2.8 m)显著较浅(P<0.01);有沉水植物分布样点的SD(0.68 m)显著高于无沉水植物分布样点(0.45 m)(P<0.01);有沉水植物分布样点的水体pH、Chl.a浓度较无沉水植物分布的样点显著较低(P<0.01);有沉水植物分布样点的S-TP含量(P<0.01)显著低于无沉水植物分布样点,而均无显著性差异.

图2 2018和2019年沉水植物生物量对比Fig.2 Comparison of biomass of submerged plants in 2018 and 2019
2.4 沉水植物分布与环境因子的关系
西洞庭湖沉水植物分布与环境因子之间的RDA分析统计见表5. 结果显示,所有环境因子对样本变化的解释量为0.3469,第1、2轴的特征值分别是0.1247和0.0466,前2轴物种与环境因子累积解释量达到76.16%,说明前两轴能够较好地反映沉水植物分布与环境因子之间的关系.

表4 有、无沉水植物分布地区环境状况

表5 RDA分析统计信息
图3显示,第一排序轴与pH、S-TN、WD的相关性较高,第二排序轴与水体TP、TN、SD的相关性较高. 刺苦草的生物量与水体TP、pH呈正相关趋势,但与水体TN呈负相关趋势;穗状狐尾藻的生物量与水体TP呈正相关趋势,与WD、SD呈负相关趋势;金鱼藻生物量与WD、S-OM、水体SD、水体TN呈正相关趋势;马来眼子菜的生物量与WD、S-TN和S-TP呈负相关趋势;轮叶黑藻的生物量与水体TP和pH呈正相关,与水体TN呈负相关趋势.

图3 RDA分析结果(红色箭头指示沉水植物的状况,蓝色箭头指示各环境因子的状况)Fig.3 Results of redundancy analysis(Red arrows show the submerged plants, blue arrows show the environmental factors)
在RDA分析中,环境因子被限定为轴的线性组合,在某个轴上的重要性需要由环境因子与轴的相关系数(F)来衡量,Monte Carlo检验测得的显著值表明,在西洞庭湖的各采样点中,与沉水植物生物量相关的主要环境因子依次是pH、水体TP和WD(F=3.9401、3.1429和2.5187,均P<0.05). 其他环境因子与沉水植物生物量的关系并不显著,说明其他环境变量不能独立解释西洞庭湖沉水植物生物量的差异.
3 讨论
3.1 西洞庭湖沉水植物分布与样地水文特征关系
本研究结果显示,沉水植物的分布与生境的水文特征存在相关关系,包括水深、透明度以及地形与水文连通性影响的流速等. 水深是影响湿地植物群落组成的重要环境因子,反映湿地植物的空间分布[44],本研究调查到沉水植物主要分布在水深较浅、透明度较高的地区,与前人研究结果一致[45-46]. 综合两次调查结果发现,天鹅湖、大连障、东洼、北洼的沉水植物多样性高于半边湖、太阳汊、夹田夹地区,前者都是湖湾或是半阻隔子湖、湖泊,生长环境较为稳定,水体流速缓慢,更加适合沉水植物生长[47],后者更靠近河道及敞水区,水体及环境扰动影响较大. 此次调查中有沉水植物分布样点的流速均为0 m/s,有沉水植物分布的区域流速较低. 自然连通的流水区域水位波动较大,在水位波动时期流速变化较大,不利于沉水植物生长;半阻隔子湖因在水位高于圩堤及洲滩后才与大湖连通,涨水前为静水期,连通期流速低于自然连通区域,故适宜沉水植物生长. 已有研究表明,长江中下游湖泊湖湾区的水生植物多样性和物种数明显高于敞水区[48],主要是由于湖湾风浪小,水面较稳定,光的散射和散射辐射损失率低,光照充足,湖泊的生境类型显著影响水生植物的多样性[17].
此外,本研究发现不同沉水植物的分布对水深具有不同的响应,验证了不同物种对相同环境因子具有不同的生长响应和代谢策略[49]. 本研究冗余分析结果中金鱼藻的分布与水深、透明度呈正相关,说明其主要分布在水深较深、水体透明度较高的地区. 有研究表明[50]金鱼藻的生长速率会随着光照的增强而减弱,而穗状狐尾藻和马来眼子菜与水深呈负相关,主要是这2种沉水植物在低光照或低透明度下能够伸长茎或叶来适应胁迫环境,当水深小于株高时,植物漂浮在水面同时影响其他植物的光照,此时水深和透明度不再是限制其生长的因素,能适应浊度较高的浅水湖泊[36]. 刺苦草和轮叶黑藻与水深无显著相关性,可能原因是调查中有这2个物种分布的样点水深数据均小于3 m,水深尚未达到其分布抑制条件,以及刺苦草和轮叶黑藻具有冬芽和芽孢可以进行无性繁殖,故此次调查的水深对这2个物种的生物量影响较小[51].
3.2 沉水植物与水质的关系
本研究发现,沉水植物对水体pH、Chl.a和营养盐浓度等环境因子具有不同的响应. pH是植物生长发育中重要的环境因子,在合适pH范围内植物能够吸收足够养分并快速生长,同时pH能影响水体中营养物质的存在方式,如水中磷的形态转化[52]. 本研究有沉水植物分布地区pH范围是7.14~8.76,明显低于无沉水植物分布地区定的pH范围7.32~10.28,研究表明pH在7~9时对沉水植物的生长最为有利,pH过高或过低会导致植物光合速率下降,沉水植物在弱碱性水环境中状态最佳[53-54]. 水体Chl.a浓度反映水体浮游藻类的数量,是表征湖泊富营养化状态的核心指标[55],此次调查结果中有沉水植物分布区域的Chl.a浓度显著低于无沉水植物分布区域,说明有沉水植物分布的区域水质条件更好. 营养盐也是影响沉水植物生长分布的关键环境因子之一,本次调查中有沉水植物分布样点的底泥与水体总氮、总磷浓度均低于无沉水植物分布样点,说明沉水植物更适宜营养浓度较低的生境. 在营养盐中,沉水植物分布与水体和底泥总磷关系显著,与总氮不显著. 本研究Monte Carlo检验结果表明水体与底质总磷是影响沉水植物生物量的显著环境因子,与袁龙义[32]、苏豪杰等[56]的研究结果一致. 本研究在西洞庭湖青山垸未调查到沉水植物分布,原因可能是青山垸长期人工水产养殖导致水体营养浓度过高,沉水植物无法生长[57]. 近年来长江中下游地区湖泊水质富营养化污染较为严重,前人对长江中下游27个湖泊研究调查发现大多数湖泊都处于富营养化水平[58],洞庭湖水质与历史数据相比还是存在较大水质污染问题[59-60],因此水质是沉水植物恢复应关注的重要因素.
与生境水文特征相似,不同种类的沉水植物对营养盐浓度具有不同的响应. 本研究冗余分析结果中金鱼藻、轮叶黑藻和刺苦草对水体和底质营养物质具有较高的耐受性,表明其耐污方面比其他沉水植物更强[61]. 而马来眼子菜生长在营养水平较低的水质中,与前人结果一致[62]. 轮叶黑藻的生物量与底质总氮、总磷均无显著相关性,李垒等的研究[63]也表明不同营养的底质对黑藻的生长无显著影响.
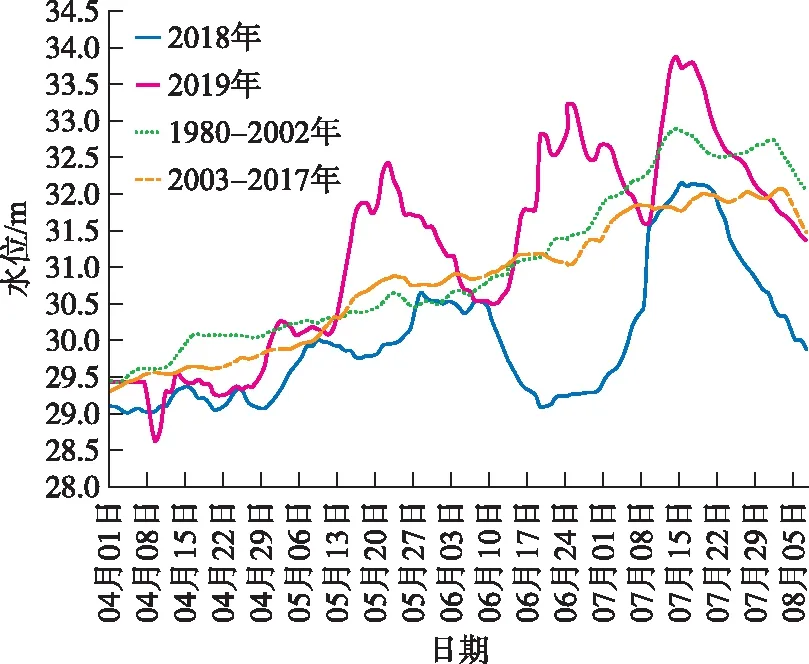
图4 2018年和2019年小河嘴水位站水位变化Fig.4 Change of water level in Xiaohezui Station in 2018 and 2019
3.3 沉水植物年际变化与水文情势的关系
年际水文情势变化是西洞庭湖沉水植物分布和生长年间差异形成的关键原因. 相比1980-2002年(三峡大坝建设前)和2003-2017年逐日平均水位(图4),2019年5-8月的水位明显高于历史多年平均水位与2018年同期,是水位相对较高的一年. 据实地调查观测,5月后是洞庭湖沉水植物生长的关键时期,2018年该时期出现1次低水位波动过程,2019年出现3次高水位波动过程. 5-8月2018年平均水位30.3 m,2019年平均水位31.8 m,6月17日-7月1日由水位波动造成的年际水位差最高达3.4 m,处于植物生长关键时期的这一高水位会对沉水植物生长形成抑制,从而造成两年沉水植物种类与分布的差异. 表现为2个季节性淹没自然连通湖泊样地坡头和北洼的物种数与生物量在2019年低于2018年(图2),半阻隔子湖大连障的物种无变化但生物量同样减少. 位于沅水洪道的半边湖2年均有少量刺苦草分布,但在2019年新调查到马来眼子菜分布,半阻隔子湖天鹅湖的刺苦草生物量在2019年减少但新调查到穗状狐尾藻与金鱼藻,其中2018年天鹅湖水体TP浓度为0.8 mg/L,在所有样点中最高,不确定其影响,因此这2处样地的变化原因有待继续调查研究.
3.4 沉水植物的恢复与保护
对比前人在2010年的调查,本研究调查到的沉水植物种类有所减少. 王朝晖等[64]在2008-2010年对西洞庭湖植物多样性调查共发现了10种沉水植物,而在本次调查中仅发现5种沉水植物,眼子菜(Potamogetondistinctus)、大茨藻(Najasmarina)、小茨藻(Najasminor)、狐尾藻(Myriophyllumverticillatum)等长江流域夏季常见沉水植物在本研究中并未调查到[65-66]. 并据西洞庭湖自然保护区反馈,近十年来以沉水植物为食的水鸟数量减少. 因此应采取措施对洞庭湖沉水植物进行恢复.
本研究表明,自然的水文节律、高湖泊生境异质性和水文连通性是恢复西洞庭沉水植物的重要因素. 2019年西洞庭湖水位整体高于2018年,2018年水位较低且波动较少,更加适合沉水植物的生长,而2019年水位波动大. 极端高水位抑制沉水植物生长,长时间高水位更会导致沉水植物死亡[67]. 本研究也发现,当水文节律与多年平均波动幅度接近时,季节性淹没的自然连通湖区的物种数与生物量均高于半阻隔或管控子湖,而在水文节律波动异常时,2种不同生境在不同水文情势下对维持沉水植物生物量具有不同的作用. 如高水位波动时自然连通湖区沉水植物生物量减少,而半阻隔子湖沉水植物的生物量可能会高于前者,半阻隔子湖在剧烈水位波动时可形成沉水植物的“避难所”. 因此,同时保持自然连通湖区、半阻隔子湖等不同生境并使其可以随水位波动而被季节性淹没,也即维持更高的生境异质性与水文连通性,避免单一生境与单一水文管理模式,对恢复并维持通江湖泊的沉水植物具有重要作用. 这与通江湖泊洲滩植物生长的研究一致,在水文情势变化时,东洞庭湖秋季洲滩植物在自然连通与人工管控生境对生长具有不同的生长过程,从而为越冬雁类提供了避难所[68],而鄱阳湖半阻隔碟形子湖的洲滩植物较自然连通湖区有更高的刚性(稳定性)[9,69]. 在2018年环保督察后,洞庭湖拆除了湖内大量历史遗留的子湖矮圩,导致湖内生境多样性与异质性的降低,本研究建议应对这一措施的影响进行深入研究与客观评估.
本研究也发现水深、营养盐和pH等环境因子对不同沉水植物的影响存在差异,因此应控制洞庭湖的入湖营养盐输入,并在不同生境选择不同的沉水植物物种进行恢复. 本研究表明,选择在水深3 m以内、流速及风浪小的湖湾区或半阻隔湖泊更易开展沉水植物恢复工作. 在水位波动较大、浊度较高的区域可以考虑种植马来眼子菜、穗状狐尾藻等能更适应水位变化且耐污的物种;在中等水深稳定水体的区域则考虑种植刺苦草更适合,水深过浅或过深都会抑制其生长;在营养盐浓度较高的区域建议选择金鱼藻、刺苦草和轮叶黑藻耐营养盐的物种.
4 结论
西洞庭湖沉水植物的分布格局与生物量对水深、透明度、pH、底泥总磷等环境因子变化以及年际水文情势差异具有不同的响应,且不同物种的响应也存在差异. 保持适宜水深、较低水文扰动与适宜的营养盐是维持湖泊沉水植物种类与生物量的重要因素,而在水文情势异常时,维持高生境异质性可减缓异常波动对沉水植物的影响. 在洞庭湖开展沉水植物恢复,可选择水深3 m以内、环境因子较为稳定的湖湾区和半阻隔湖泊,并降低流域与湖区的入湖营养盐. 恢复物种的选择应基于湖区营养盐浓度差异,在高浓度营养盐的区域优先恢复金鱼藻、黑藻与刺苦草等物种,如退渔还湿后的人工养殖子湖,在营养盐浓度较低的区域建议优先恢复马来眼子菜. 在制定恢复沉水植物恢复措施的同时,一方面应针对未来江湖关系改变引起的水文情势新变化对沉水植物的影响开展进一步研究,尤其是营养盐与水文特征对沉水植物生长的综合作用机理与量化研究;另一方面应在洞庭湖拆除矮圩的区域开展对比研究,客观评价生境异质性变化的作用与影响. 此外,本研究尚有不足,如调查时间主要集中在8月,未来可扩大调查时间与空间覆盖,继续研究沉水植物对环境响应的季节性差异和年际差异.
