改良贯穿式胰肠连续吻合在腹腔镜胰十二指肠切除术中的应用
2020-10-28钱道海王冠男沈正超方小三韩猛王小明
钱道海,王冠男,沈正超,方小三,韩猛,王小明
[皖南医学院第一附属医院(弋矶山医院) 肝胆外科,安徽 芜湖 241001]
腹腔镜胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)于1994年由Gagner等[1]首次报道,是普通外科公认的最为复杂手术之一。后因手术时间长、技术难度大、吻合口多、术后并发症发生率高等原因而一度被废止。近年来,随着微创器械和技术的快速发展,LPD技术得到了长足的进步和发展[2-4]。目前,国内很多单位均已常规开展此项术式,用于治疗胰头、壶腹周围良恶性肿瘤[5-8]。然而,LPD术后胰瘘(postoperative pancreatic fistula,POPF)一直是困扰外科医生的难题[9]。研究显示,LPD术后POPF的发生率约10%~40%[5-6,10-11],部分文献报道甚至高达60%[12]。而且,胰瘘相关病死率可以高达40%[13]。因此,如何避免LPD术后胰瘘的发生是当前亟待解决的医学难题。
研究发现,POPF的发生与胰腺质地、胰腺残端的血供、胰腺断面处理不当和胰肠吻合方式等多种因素相关[9],其中,胰肠吻合方式是POPF的独立危险因素,因而成为研究的焦点。很多学者在实施LPD时,发现开腹胰肠吻合方式并不适合腹腔镜手术,并结合自身的实践经验,对现有的胰肠吻合方式提出优化和改进,旨在降低腔镜下的缝合难度,减少术后胰瘘的发生,使得LPD手术更加安全、可靠,也为LPD技术的进一步推广夯下坚实基础[5-6,14-15]。笔者前期也报道了一种腔镜下胰肠吻合方式,即贯穿式胰肠连续吻合[7,16],不仅简化了以往繁杂的胰肠吻合操作流程,易于让初学者掌握,而且效果确切、可靠。但是,在实施贯穿式胰肠连续吻合过程中,也认识到一些不足之处,比如胰腺断面处理不够等。
基于此,笔者在前期研究基础之上,针对胰腺断面处理不足,对贯穿式胰肠连续吻合技术提出改良,即在贯穿式胰肠连续吻合实施之前,对胰腺断面进行2针U型缝合,加固胰腺断面,从理论上消灭胰腺断面发生胰瘘和出血的风险,增加LPD手术的安全性和可靠性。
1 资料与方法
1.1 病例入组
选取2017年6月—2019年12月在皖南医学院弋矶山医院肝胆外科二病区住院并接受LPD手术的患者。入组标准:(1) 术前诊断为十二指肠乳头、胆总管下端、壶腹周围、胰头部恶性肿瘤或者胰头部良性/交界性肿瘤,主胰管型且压迫胆总管,需要行LPD手术;(2)年龄45~75岁之间;(3) 心、肺功能基本健全,无明显器质性疾病,可以耐受LPD手术;(4) 依从性良好;(5) 无明显腹腔粘连者。最终有 25例患者符合入组标准,纳入本项研究。该项目也获得医院伦理委员会批准,并征得患者知情同意。
1.2 手术经过与分组
LPD手术简要经过如既往文献[7,16]所述。消化道重建遵循Child法,按照胰肠、胆肠、胃肠吻合顺序依次完成,共实施25例。根据胰肠吻合方式的不同,将患者随机分成贯穿式胰肠连续吻合组(对照组,15例)和改良贯穿式胰肠连续吻合组(观察组,10例)。简要手术经过如下:(1) 离断胰腺颈部,确定主胰管位置和粗细,选择合适的胰管支撑管;(2) 游离胰腺断端约1 cm,将屈氏韧带下方25 cm处空肠经横结肠系膜右侧孔(R孔)上提至胰腺断端处;(3) 实施胰肠吻合,其中,观察组与对照组的主要区别在于实施胰肠吻合之前,观察组先以胰管为界,于胰腺上、下断端予4-0可吸收线各U型缝合1针(图1A-B),再实施贯穿式胰肠连续吻合,详细步骤如下:从胰腺上缘开始予3/0倒刺线行贯穿缝合(图1C),从空肠浆肌层出针(图1D),至胰管处,暂不收紧;于空肠对系膜缘处戳孔,口径与胰管直径相当,4-0 可吸收线行胰管-空肠黏膜间断吻合,一般 4~6针,先从后壁开始缝合(图1E),一般1~2针, 打结后将线头绕过胰管支撑管后固定支撑管 (图1F),再缝合胰管-空肠黏膜吻合口的上壁(图1G)和下壁(图1H),一般1~2针;收紧倒刺线,将胰腺断端和肠壁靠紧,倒刺线于胰管-空肠黏膜吻合口前壁的胰腺侧进针和对应位置的空肠浆肌层出针(图1I),收紧缝线后,可见胰肠吻合口前壁对合整齐严密,再继续行贯穿式连续缝合2~3针,依次从胰腺断面入针(图J),从对应位置的空肠浆肌层出针(图1K),然后,倒刺线回缝1~2针后予以Hem-o-lok夹固定,最后,检查胰肠吻合口是否缝合严密,至此完成改良贯穿式胰肠连续吻合(图1L)。改良贯穿式胰肠连续吻合手术方法模式图见图2。
1.3 围手术期各项指标监测
术前:收集所有患者的基本信息,如性别、年龄、体质量指数(BMI)、基础疾病(包括糖尿病、高血压病)等,记录白细胞(WBC)、中性粒细胞百分比(N%)、白蛋白、总胆红素(TIBL)、直接胆红素(DIBL)水平、凝血酶原时间(PT)、胰管直径(在MRCP 图像上测量)、胰颈部质地(平均CT值)、术后病理等。术中:记录手术时间、术中出血量、胰肠吻合时间等。术后:记录术后第3天引流液淀粉酶水平、胰肠吻合口旁引流管拔除时间、术后住院天数、并发症(腹腔感染、腹腔出血等);统计生化漏、B级和C级胰瘘、并发症率、病死率等。术后胰瘘(postoperative pancreatic fistula,POPF)的定义:本研究采用2016年国际胰瘘研究小组(International Study Group Pancreatic Fistula,ISGPS)[17]的标准将术后胰瘘分为生化漏和B、C级胰瘘。术后3 d及以上引流液淀粉酶达到正常值上限3倍,即可判断为生化漏(biochemical leak,BL)。在此基础上出现以下任一情况被认为是B级胰瘘,如需要改变术后治疗策略、引流管留置时间>3周、需要通过内窥镜或经皮穿刺引流胰瘘、胰瘘相关出血需要血管介入止血或者胰瘘导致感染,但无器官功能衰竭。而C级胰瘘则明确是指那些需要重新手术、导致单一或多个器官衰竭(尤其是呼吸、肾脏、心脏等功能不全)和/或由此引发死亡的胰瘘。
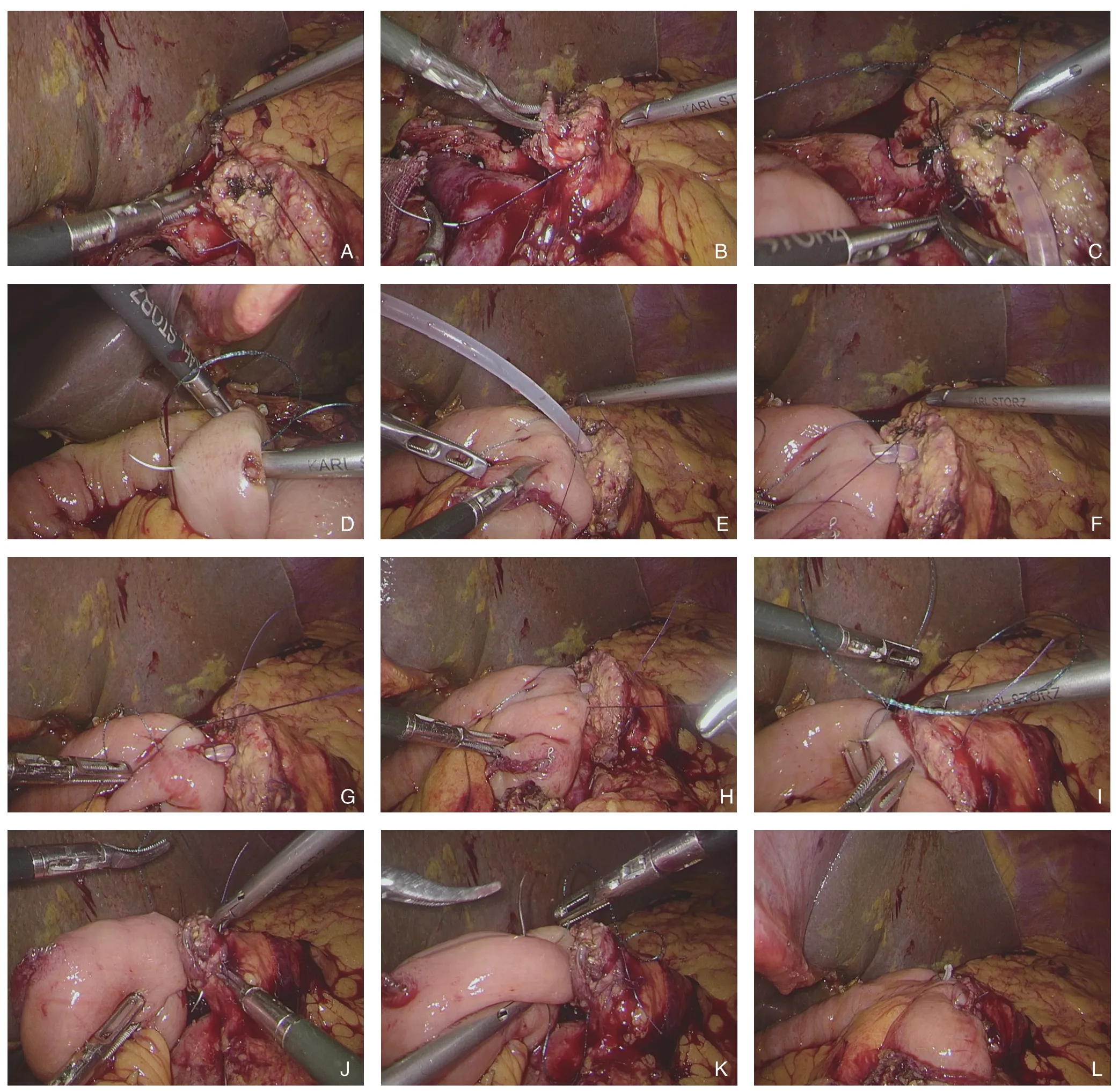
图1 术中照片 A:4-0 可吸收线于胰管上方胰腺断面行U 型缝合;B:4-0 可吸收线于胰管下方胰腺断面行U 型缝合;C:3-0倒刺线贯穿缝合胰管上方的胰腺;D:3-0 倒刺线缝合对应侧空肠浆肌层;E:4-0 可吸收线缝合胰腺导管-空肠黏膜吻合口的后壁并打结;F:胰管-空肠黏膜后壁缝线绕至胰管支撑管前方,固定胰管支撑管;G:4-0 可吸收线缝合胰腺导管-空肠黏膜吻合口的上壁;H:4-0 可吸收线缝合胰腺导管-空肠黏膜吻合口的下壁;I:3-0 倒刺线缝合胰腺导管-空肠黏膜吻合口的前壁;J:3-0 倒刺线贯穿缝合胰管下方的胰腺;K:3-0 倒刺线缝合对应侧空肠浆肌层;L:完成改良胰肠连续吻合Figure 1 Intraoperative views A: U-shaped suturing on the cut surface of the pancreas above the pancreatic duct with 4-0 absorbable suture; B: U-shaped suturing with 4-0 absorbable suture on the cut surface of the pancreas below the pancreatic duct; C: Suturing the pancreas above the pancreatic duct with 3-0 barb suture; D: Suturing the corresponding lateral jejunal plasma layer with 3-0 barb suture; E: Suturing the posterior wall of the pancreatic duct-jejunal mucosa anastomosis and knotting with 4-0 absorbable suture; F: Orbiting the suture of the posterior wall of the pancreatic duct-jejunal mucosa anastomosis to the front of the pancreatic duct supporting tube to fix the pancreatic duct supporting tube; G: Suturing the superior wall of the pancreatic duct-jejunal mucosal anastomosis with 4-0 absorbable suture; H: Suturing the inferior wall of the pancreatic duct-jejunal mucosal anastomosis with 4-0 absorbable suture; I: Suturing the anterior wall of the pancreatic duct-jejunal mucosal anastomosis with 3-0 barb suture; J: Suturing the pancreas below the pancreatic duct with 3-0 barb suture; K: Suturing the corresponding lateral jejunal plasma layer with 3-0 barb suture; L: Completion of the modified continuous penetrating-suture pancreaticojejunostomy

图2 改良贯穿式胰肠连续吻合模式图Figure 2 Diagrammatic drawing of the modified continuous penetrating-suture pancreaticojejunostomy
1.4 统计学处理
应用SPSS 19.0软件进行统计分析,计量资料以均数±标准差(±s)表示,方差齐性比较采用t检验,计数资料比较采用Fisher确切概率。P<0.05为差异有统计学意义。
2 结 果
2.1 两组患者术前各项指标比较
对照组与观察组在性别、年龄、BMI、基础疾病、WBC、N%、白蛋白、TIBL、DIBL、PT、胰管直径、胰颈部平均CT值上均无统计学差异(均P>0.05)(表1)。

表1 两组患者一般资料比较Table 1 Comparison of the general data between the two groups of patients
2.2 两组患者术中情况
所有患者均成功接受LPD 手术。观察组与对照组比较,在手术时间[(393.11±72.73)minvs.( 398 .01 ± 56 .09 )min] 、术中出血量[(205.01±95.60)mLvs.(296.67±203.05)mL]上均无统计学差异(均P>0.05),但在胰肠吻合时间上,观察组明显长于对照组[(23.50±2.51)minvs.(20.20±2.43)min,P=0.003](表2)。
表2 两组患者术中指标比较(±s)Table 2 Comparison of the intraoperative variables between the two groups of patients (±s)

表2 两组患者术中指标比较(±s)Table 2 Comparison of the intraoperative variables between the two groups of patients (±s)
指标 对照组(n=15) 观察组(n=10) t P手术时间(min) 398.01±56.09 393.11±72.73 -0.194 0.848胰肠吻合时间(min) 20.20±2.43 23.50±2.51 3.289 0.003术中出血量(mL) 296.67±203.05 205.01±95.60 -1.510 0.146
2.3 两组患者术后情况
两组患者均未出现C级胰瘘。对照组与观察组在生化漏发生率(20%vs.40%)、总胰瘘发生率(60%vs.40%)上均无统计学差异(P>0.05),但对照组B级胰瘘发生率明显高于观察组(40%vs.0%,P=0.028),且其胰肠吻合口引流管拔除时间明显更晚[(25.60±11.21)dvs.(11.00±5.77)d,P<0.001]、术后恢复更慢[(18.53±8.70)dvs.(12.20±4.34)d,P=0.045]。至于术后其他并发症(腹腔感染、腹腔出血),两组间虽无统计学差异,但从结果看,对照组要高于观察组(33.3%vs.0,P=0.057)(表3)。所有患者术后均顺利出院,其中21例术后病理证实为十二指肠乳头、胰头、胆总管下端、壶腹周围癌,1例证实为胆囊癌侵犯胆总管下段,2例证实为胰头交界性肿瘤,1例证实为浆液性囊腺瘤,主胰管型,压迫胆总管。

表3 两组患者术后指标比较Table 3 Comparison of the postoperative variables between the two groups of patients
3 讨 论
自1935年Whipple首次实施PD术治疗壶腹周围癌,至今已有80余年[18]。目前,国内、外治疗胰头及壶腹部周围肿瘤等多采用Whipple术和Child消化道重建法,而在Child吻合中,胰肠吻合法被认为是最难、最重要的一吻[19]。一旦吻合失败,术后即发生胰瘘,胆汁和胰液混合进入腹腔,诱发腹腔感染和出血,危及生命。因此,寻找一种安全而可靠的胰肠吻合方式显得尤为重要。当前,胰肠吻合方式主要有端端吻合和端侧吻合两种[19]。端端吻合包括套入式胰肠吻合和胰腺残端空肠黏膜吻合两种,而端侧吻合也包括胰管空肠黏膜吻合和胰腺断端空肠黏膜吻合两种[20]。至于哪种吻合方式更好,至今尚无定论,还有待进一步研究[21]。
近些年,随着腹腔镜技术的出现和兴起,LPD也应运而生,并在经历了探索期、发展期之后,正步入成熟期[3,22]。但是,LPD术后胰瘘一直是困扰外科医生的一个难题,而腹腔镜下胰肠吻合方式与开腹手术相比,有很多不同之处,主要体现在:(1) 腹腔镜下多选择胰管-空肠黏膜吻合,以减少腹腔污染;(2) 腹腔镜缺乏触感和存在术野盲区,所以要求吻合尽可能简单、可靠、确切;(3) 对术者要求更高,需要具备扎实的腔镜下打结和缝合技术。这些不同也给LPD手术增加了难度和挑战。很多术者在大量实践过程中不断创新,提出腔镜下的独特胰肠吻合方式,并取得了显著效果[5-6,14-15,23-26]。尹新民等[6]报道一种贯穿式胰腺纵向“U”形缝合法空肠内翻套入式胰肠吻合技术,安全有效,POPF发生率仅为11.2%,术后病死率1.7%。张智勇等[10]提出胰管-空肠吻合+胰腺断端贯穿-空肠浆肌层闭环缝合法,术后胰瘘的发生率仅为13.5%。柴伟等[25]发现,与胰管空肠黏膜吻合法相比,荷包套入式胰肠端侧吻合法可明显降低术后胰瘘的发生率(10.5%vs.30.4%)。洪德飞等[23]成功将“洪氏一针法”应用于LPD胰肠吻合中,无1例死亡,POPF发生率为23.5%。此外,已有研究[27-29]表明,腹腔镜下的胰肠吻合方式与开腹相比,并不增加术后胰瘘等并发症的发生率。笔者前期报道了一种胰肠吻合方式,即贯穿式胰肠连续吻合,可以在很短的时间内完成高质量的胰肠吻合[7,16]。这种方法,相较其他胰肠吻合法,主要优点是操作简便,尤其在胰腺组织较软时[30],不易出现胰腺组织撕裂和缝线滑脱,且缝合针数相对较少,胰腺残端血供破坏较少,适宜在腔镜下完成。然而,在实施过程中,笔者也发现一些不足之处,主要体现在:(1) 胰腺断面处理不够,无法避免断面发生胰瘘和出血的风险;(2) 缝合线一般选择3-0倒刺线,而这种线较粗,张力大,但易发生针眼瘘可能。因此,针对上述不足,对前期贯穿式胰肠连续吻合进行改良,即在实施吻合之前,先以胰管为中心,于胰腺上、下断面各行一针“U”型缝合,一方面缝扎断面的血管,降低术后出血的可能,另一方面结扎胰管分支,避免胰腺断面和倒刺线针眼处发生胰瘘的可能。此外,多项研究也表明“U”型缝合在LPD术中安全可靠,可以预防术后胰瘘的发生[6,31]。
本组25例接受LPD手术的患者,随机分成对照组和观察组,而两组患者在性别、年龄、BMI、基础疾病、胆红素水平、胰腺质地、术中出血量等方面没有显著差异;尽管观察组胰肠吻合时间较对照组显著延长了3 min左右,但是其术后B级胰瘘的发生率却显著降低;虽然两组患者在术后并发症(腹腔感染和出血)的发生率上没有统计学差异(推测与病例数少有关),但是从结果上看,观察组远远低于对照组(0vs.33.3%)。此外,观察组胰肠吻合口旁引流管拔除时间和术后住院天数均明显短于对照组。因此,基于本项研究结果,我们建议在贯穿式胰肠连续吻合之前,以胰管为中心,于胰腺上、下断面各进行一针U型缝合是非常必要的;这将有助于降低术后B级胰瘘的发生率,缩短住院时间,加速患者术后康复。
总之,改良贯穿式胰肠连续吻合法应用于LPD术中安全、可靠,且操作方便,适宜在腔镜下完成,值得临床推广。由于本次纳入研究的病例数相对较少,研究结论仍需进一步检测和验证。
