胰腺星状细胞活跃度在胰十二指肠切除术后胰瘘中的预测价值
2020-10-28曹昕彤朱帅罗庚求林嘉晏宁彩虹李嘉荣申鼎成王曦滔黄耿文
曹昕彤,朱帅,罗庚求,林嘉晏,宁彩虹,李嘉荣,申鼎成,王曦滔,黄耿文
(中南大学湘雅医院 1.普通外科 2.胰腺外科 3.病理科,湖南 长沙 410008)
随着外科技术的提高以及围术期管理的日趋完善,胰十二指肠切除术(pancreaticoduodenectomy,PD)的病死率已降至5%以下,但术后胰瘘(postoperative pancreatic fistula,POPF)的发生率仍高达20%~40%[1-4],严重影响患者的术后恢复,甚至影响远期生存率。研究[5]表明,质软胰腺是发生POPF的重要的危险因素之一。然而,胰腺质地的判断往往凭借医生的主观感受,缺乏客观的评价依据。胰腺星状细胞(pancreatic stellate cells,PSC)与胰腺的纤维化密切相关[6-7]。PSC的活跃度能否用来预测POPF,目前尚无研究报道。本研究前瞻性收集中南大学湘雅医院2017年 12月—2019年9月间101例PD术患者资料,通过分析胰腺切缘组织中PSC的活跃度,探讨PSC的活跃度在PD术后POPF中的预测价值。
1 资料与方法
1.1 一般资料
前瞻性收集2017年12月—2019年9月间中南大学湘雅医院连续收治的101例行PD术的患者,其中男55例(54.5%),女46例(45.5%);年 龄27 ~81岁,中位年龄56 岁;开腹手术96例(95.0%),腹腔镜手术5例(5.0%);经典PD 95例(94.0%),保留幽门的PD(pyloruspreserving PD,PPPD)6例(6.0%);病理类型包括十二指肠乳头癌36例(35.6%),胰腺癌 28例(27.6%),胆总管下段癌11例(10.8%),胰腺囊性肿瘤7例(7.0%),壶腹癌6例(6.0%),慢性胰腺炎6例(6.0%),十二指肠或胰腺间叶源性肿瘤5例(5.0%),胰腺神经内分泌肿瘤1例(1.0%),胆总管炎性狭窄1例(1.0%)。
1.2 染色方法及PSC 活跃度分级
取PD 手术中胰腺颈部切缘处胰腺组织行α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)免疫组化染色。取该处胰腺组织石蜡块予以切片、脱蜡后,将其置于柠檬酸钠缓冲溶液(0.01 mol/L,pH6.0)中高压环境(125 ℃, 131 kPa)约15 min以修复抗原。3%H2O2溶液消除内源性过氧化物酶的活性。一抗(鼠抗人单克隆平滑肌肌动蛋白抗体1A4,稀释浓度1∶50),湿盒持续4 ℃孵育过夜。二抗(羊抗鼠单克隆抗体)湿盒孵育,在4 ℃下放置约20~30 min,二氨基联苯胺和苏木精分别进行显色和复染,完成染色。
参考Tanaka等[8]的分级方法,由胰腺病理专家盲法阅片,将α-SMA 免疫组化染色强度分为阴性(-)、弱阳性(+)、中阳性(++)和强阳性(+++)4个等级,分别对应0级(S0)、1级(S1)、2级(S2)、3级(S3)对PSC活跃度进行量化,其具体评判细则如表1所示。

表1 PSC 活跃度的分级标准Table 1 The grading criteria for PSC activity
本研究中所有的临床数据、标本的收集均获得患者的知情同意,并签署书面同意书。本研究获得中南大学湘雅医院医学伦理委员会批准进行(项目编号:201707777)。
1.3 围术期管理
术后常规预防性使用抗生素以及营养支持等治疗。PD患者术后的腹腔引流管均采用延迟性拔管策略(留置时间≥7 d),并常规于术后第1、3、7天动态监测腹腔引流液淀粉酶(drainage fluid amylase,DFA)情况。对于术后7 d或以后的DFA处于正常范围,且引流管引流量<10 m L/d 的患者,考虑拔除腹腔引流管。所有患者均采取快速康复外科模式促进患者早期恢复[9]。
1.4 POPF 的定义及诊断标准
临床相关性胰瘘(clinically relevant POPF,C R-POPF)的诊断标准参照2016年版胰腺外科国际研究小组[10](International Study Group of Pancreatic Surgery,ISGPS)的定义:术后>3 d时,DFA大于血清淀粉酶正常值上限的3倍,且与临床治疗及预后相关。在此前提下,仅包括B级和C级CR-POPF,而生化漏(biochemical leakage)不包括在内。生化漏:仅术后第3天或以后腹腔引流液淀粉酶升高达正常值上限3倍,而对临床结局无任何影响。B级CR-POPF:(1) 腹腔引流管留置时间>3周;(2) POPF相关性临床治疗方案变更(加用生长抑素、抗生素升级、肠内外营养支持、输血等);(3) 需经皮或内镜下穿刺引流的POPF继发性胰周积液;(4) 需血管造影介入止血的POPF相关性出血;(5) POPF继发性感染,但无脏器功能衰竭。满足以上5种情况中的任意1种。C级CRPOPF:(1) 需再次开放手术处理的POPF相关并发症(如假性动脉瘤破裂出血、腹腔脓肿形成、吻合口破裂等);(2) POPF继发性器官功能衰竭;(3) POPF相关性死亡。满足以上3种情况中的任意 1种。
1.5 统计学处理
计数资料以例数(百分比)[n(%)]表示,其比较采用χ2检验;计量资料中符合正态分布的数据以均数±标准差(±s)表示,其比较采用t检验;符合偏态分布的数据以中位数(M)表示,其比较采用Mann-WhitneyU检验。多因素分析采用Logistic回归模型,并应用受试者操作特性曲线(receiver operating characteristic curve,ROC)进行分析。以上均通过SPSS 22.0统计软件分析,P<0.05为差异有统计学意义。
2 结 果
2.1 手术结果
全组101例患者中,41例术后出现CR-POPF,CR-POPF发生率为40.6%,包括B级36例,C 级 5例。无CR-POPF者共60例,包括19例生化漏和41例无胰瘘者。中位手术时长与术中出血量分别为340 min和400 mL。术后总的并发症率为46.5%(47/101),除C R-POPF 外,包括术后胆汁漏 7例(7.0%),延迟性胃排空障碍4例(4.0%),术后出血(包括消化道出血和腹腔内出血)16例(15.8%)和肺部并发症(包括胸腔积液、肺部感染、肺不张及呼吸功能衰竭等)46例(45.5%)。术后中位住院时长为15 d,再入院率为6.0%(6/101),术后90 d内病死率为4.0%(4/101)。
2.2 PSC 活跃度分级
本研究中,切缘处胰腺免疫组化染色的镜下表现及分级如图1 所示。依照评判规则,全组被分级为S0、S1、S2、S3的病例分别为9、49、24、19例,各活跃度等级中的CR-POPF率分别为88.9%(8/9)、57.1%(28/49)、16.7%(4/24)和5.3%(1/19) ,呈逐渐递减趋势,差异有统计学意义(P<0.001)。PSC等级与胰腺质地之间的关系如表2所示。在不同的胰腺质地之间,PSC等级的分布具有明显差异性(P<0.001)。其中,在柔软胰腺中占比最高的PSC等级为S1(60.6%),而在质硬胰腺中为S2(40.0%)。经Spearman相关性检验结果显示,PSC活跃度与胰腺质地的硬度之间存在明显正相关性(r=0.456,P<0.001),而与CR-POPF之间则存在明显负相关性(r=-0.539,P<0.001)。

图1 α-SMA 免疫组化染色所反映的PSC 的活跃度 A:S0;B:S1;C:S2;D:S3Figure 1 The PSC activity shown by immunohistochemical staining of α-SMA A: S0; B: S1; C: S2; D: S3
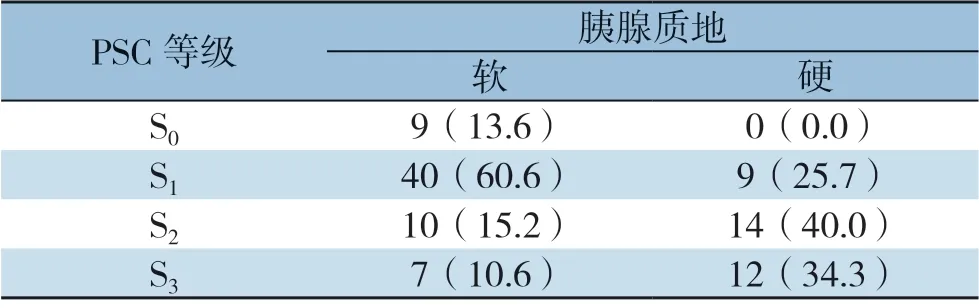
表2 PSC 等级与胰腺质地之间的关系[n(%)]Table 2 Relationship between the PSC activity grade and pancreatic texture [n (%)]
2.3 临床病理因素与CR-POPF 关系的单因素和多元回归分析
单因素分析显示,胰腺质地、肿块病理、PSC活跃度分级、体质量指数(BMI)、胰管直径、术前总胆红素、术后第1 天引流液中淀粉酶含量(DFA1)均与CR-POPF的发生有关(均P<0.05)(表3)。多元回归分析显示,仅PSC活跃度分级(OR=0.24,95%CI=0.10~0.56,P<0.001)和术前总胆红素水平(OR=1.01,95%CI=1.00~1.01,P=0.008)是预测CR-POPF的独立危险因素(表4)。
2.4 PSC 活跃度分级对CR-POPF 的预测价值
PSC活跃度分级预测CR-POPF的ROC曲线如图2 所示。当截断值取1.5 时,其曲线下面积(area under curve,AUC)为0.795(95%CI=0.708~0.881),相应的敏感度和特异度分别为63.3%和87.8%,提示其对CR-POPF具有良好的预测价值。

表3 临床病理因素与CR-POPF 关系的单因素分析Table 3 Univariate analysis of relationship between clinicopathologic factors and CR-POPF
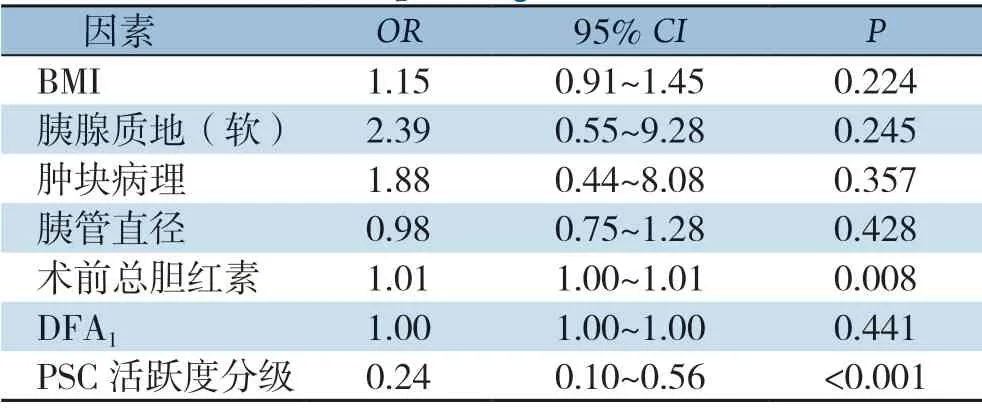
表4 临床病理因素与CR-POPF 关系多因素Logistic 回归分析Table 4 Multivariate Logistic regression analysis of relationship between clinicopathologic factors and CR-POPF
3 讨 论

图2 PSC 等级预测PD 术后CR-POPF 的ROC 曲线Figure 2 ROC curve of PSC activity for predicting CR-POPF following PD
POPF是PD术后的严重并发症之一,可继发引起术后出血、腹腔感染、延迟性胃排空障碍等一系列并发症,甚至导致患者死亡[11-15]。胰腺质地与POPF的发生密切相关[5,16]。然而,仅靠外科医生的触感判断胰腺质地较为主观。因此,国内外均有研究采用其它较为客观的方法来评判胰腺质地,如MRI、胰腺弹力仪等,取得一定效果,但实用性不高[17-21]。PSC作为胰腺实质中的基质细胞,活化后可分泌大量纤维组织,从而参与胰腺组织的纤维化,理论上可能与胰腺质地变硬密切相关[6-7,21-22]。本研究采用免疫组化检测胰腺切缘组织中的α-SMA蛋白反映PSC的活跃度,前瞻性研究101例PD患者的临床资料,发现PSC活跃度是预测CR-POPF的独立危险因素(OR=0.24,95%CI=0.10~0.56,P<0.001)。此外,ROC曲线分析显示PSC活跃度的预测效能良好(AUC=0.795),从而进一步证实 PSC活跃度是预测PD术后胰瘘的重要的客观指标。
PSC是一种外形类似星形的胰腺基质细胞,最初于1998年被发现并分离培养[23-24]。它存在于胰腺腺泡细胞、微血管及微胰管周围。在大多数情况下,PSC处于静止态,具有免疫调节、吞噬、储存脂质、维持胰腺组织基础内外分泌以及其基本结构等功能[25-26]。然而,在缺氧、酒精、吸烟等恶劣条件刺激下,PSC可转为活化态并获得成纤维细胞样表型[27-30],分泌大量细胞因子(如TNF-α,TGF-β、PDGF等)以及细胞外基质,促进胰腺组织的纤维化进程[7,31]。较为特殊的是,慢性胰腺炎的胰腺组织中有大量单核细胞浸润,后者通过产生TNF-α促进PSC活化[32];胰腺癌细胞与PSC存在纤维化/缺氧循环机制[33],通过正反馈放大作用致使组织持续性的缺氧、缺血、纤维化。以上可能是PSC介导胰腺纤维化的主要机制。然而,其更具体的分子信号通路仍有待于进一步探究。
从组织病理学角度来看,胰腺质地取决于组织中的纤维化程度,它与胰腺的外分泌功能呈负相关性[22,34]。然而究其根本,胰腺纤维组织的蓄积是PSC活跃的结果,故后者更能反映胰腺质地变化的本质。遗憾的是,目前的研究主要集中于探索胰腺纤维化与胰瘘的联系[35-37],而鲜有关于PSC活跃度和POPF关联性的研究。Erkan等[38]认为胰腺癌中的PSC是导致胰腺纤维化的主要原因,可影响外科医生对质地的判断。Tanaka等[8]通过将不同活跃程度的PSC进行分级并对CR-POPF进行预测,率先证实PSC等级在发生POPF与无POPF的患者之间存在统计学差异(P=0.035)。在此基础上,本研究发现随着PSC活跃度提高,CR-POPF率明显降低,这与前述的理论基本契合。而且,在本研究中,PSC活跃度被证实是发生CR-POPF的独立危险因素,而胰腺质地并不是独立的危险因素,从而证实了PSC活跃度在预测CR-POPF方面更具有客观性与优越性。因此,PSC活跃度可代替胰腺质地,作为评估CR-POPF风险的全新预测指标。
本研究存在一定的局限性。首先,本研究所涵盖的样本量不大,且为单中心研究;其次,PSC活跃时分泌或活化的蛋白种类繁多,其特征性蛋白除α-SMA外[39],还包括成纤维细胞活化蛋白-α,潜在转化生长因子结合蛋白等[40-41]。本研究中的标记蛋白较为单一,其客观度稍显不足,有待于在今后的实验中予以完善。
综上所述,PSC的活跃度对CR-POPF的预测具有重要意义,可作为临床指导预测CR-POPF发生的重要参考指标之一。
