胰腺导管腺癌术后早期复发的危险因素及新辅助化疗与术后辅助化疗的应用价值分析
2020-10-28朱磊李姗姗顾洪柱王旸
朱磊,李姗姗,顾洪柱,王旸
(盘锦辽油宝石花医院 1.普通外科 2.药学部,辽宁 盘锦 124010)
胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)临床特点是起病隐匿、侵袭性强、进展迅速、早期诊断困难,且预后极差[1-2],近30年来总体生存率并无明显改善,5年生存率仍低于10%[3-5]。预计到2030年,由PDAC造成的病死率将成为全球第二大死亡原因[6]。尽管手术切除是目前唯一可能治愈PDAC的方法,但大多数患者在诊断时都处于肿瘤晚期、不可切除的阶段[6-8],即便完成肿瘤根治性切除的PDAC患者仍需要面临着术后早期复发的风险[9-10],现有研究[11-12]认为超过60%的PDAC患者在根治性切除后的12个月内将出现局部或全身复发。因此,如何改善PDAC患者的近远期疗效,进而提高患者的生活质量并延长生存期,已成为PDAC临床治疗的热点和难点,随着对PDAC生物学特性的深入研究,其治疗理念也正从单纯外科学向肿瘤学多学科团队协作(multiple disciplinary team,MDT)转化,现有的医学证据表明,PDAC患者术前新辅助治疗(neoadjuvant chemotherapy,NAC)和术后辅助化疗(postoperative adjuvant chemotherapy,PAC)可有效的控制或缩小肿瘤和微转移病灶、提高R0切除率、减少术后肿瘤复发转移等而改善患者的预后[5]。本研究的目的是探索PDAC术后早期复发的预测因素以及NAC和PAC的临床价值。
1 资料与方法
1.1 一般资料
回顾性分析2011年1月—2016年12月在盘锦辽油宝石花医院普通外科收治的194例诊断为PDAC患者临床资料,将符合标准的141例PDAC患者纳入本研究,病理诊断均有至少2名病理科医生进行组织学检查。全部患者或家属签署由医院伦理委员会批准的患者知情同意书(项目编号:LYBSH20150021)。
纳入标准:(1) 经术后病理学检查确诊为PDAC者;(2) 术前无重大疾病,可耐受手术者; (3) 术前影像学检查明确无远处转移者;(4) 具有完整的临床病理资料。排除标准:(1) 术前合并其它脏器存在严重基础疾病,不能耐受手术者;(2) 临床病理资料缺失者;(3) 术前存在远处转移或术中发现存在腹膜转移者。
1.2 治疗方法
接受NAC 治疗的患者给予吉西他滨和S-1(GS)的剂量基于早前的研究结果[13]。吉西他滨在每个疗程的第1天和第8天分别给予1000 mg/m2的剂量;S-1口服,每日2次,体表面积≤1.5 m2, 40 mg/次;体表面积≥1.5 m2,60 mg/次,连续 14 d,停药7 d,每21天重复给药。接受NAC治疗患者完成2个疗程的GS治疗。除患者无法耐受化疗,术后常规应用6个疗程GS方案治疗。所有符合治疗条件的患者术后4周开始化疗。
1.3 资料收集
根据肿瘤位置,分别行胰十二指肠切除术 73例(51.8%),胰远端切除术68例(48.2%),所有手术均行区域淋巴结清扫。Clavien-Dindo分级系统[14]进行胰腺癌术后并发症的分级,具体分为I~V级,其中III级及以上并发症患者纳入并发症组,根据《美国癌症联合委员会(AJCC)胰腺癌分期手册》第八版对切除标本的病理特征进行分类[15]。
患者入院后在未接受任何治疗前及术后4周未开始化疗前检测肿瘤学标记物等,同时收集围手术期资料,包括术前胆道引流情况、术中肿瘤大小、手术时间及术后并发症等。
1.4 随访
通过门诊和入院方式完成患者术后随访,以完成手术治疗为随访起点,因任何原因死亡或至2019年12月31日随访终止。所有患者术后每3个月复查血常规、肝肾功能、肿瘤标志物 ,并行胸部和腹部CT扫描,若病情需要,可将检查日期提前或增加磁共振成像。早期复发定义为术后6 个月内,术后6个月内未复发者归为非早期复发组。
1.5 统计学处理
应用SPSS 18.0统计软件进行比较分析,计数资料用例数(百分率)[n(%)]表示,组间比较采用χ2检验,采用Logistic回归对PDAC患者术后早期复发的因素进行多因素分析,并计算风险比(HR)及其对应的95%可信区间(CI)。以双侧P<0.05为差异有统计学意义。
2 结 果
2.1 患者基本资料
本研究141例患者中,64例患者(47.5%)接受NAC,103例患者(73.0%)接受PAC。45例(31.9%)为术后早期复发组,96例(68.1%)为非早期复发组。全组患者合计63例合并III级及以上并发症,详见表1。

表1 术后并发症类别(n)Table 1 Categories of postoperative complications (n)
2.2 PDAC 患者术后早期复发相关因素分析
分析结果显示,TNM 分期 、术前CA 19-9水平、NAC、术中肿瘤大小、术后并发症、术后CA 19-9水平、PAC与术后早期复发相关(均P <0.05),与其他临床病理因素无关(均P>0.05)(表2)。
2.3 PDAC 患者治疗模式及术后早期复发模式的比较
依据治疗方式的差别将141例患者分为单纯手术组(23例)、NAC组(15例)、PAC组 (54例)、NAC+PAC组(49例)。分析4组间局部复发与远处转移发生率的差异。结果显示,各组间在局部复发发生率有统计学差异(χ2=9.319,P=0.025),两两比较发现,单纯手术组明显高于NAC组(χ2=5.596,P=0.018)与NAC+PAC组(χ2=5.988,P=0.014),而单纯手术组与PAC组 无统计学差异(χ2=1.331,P=0.249),NAC组、PAC组、NAC+PAC组之间差异均无统计学意义(χ2=3.249、1.306、2.345,均P>0.05)。各组间远处转移发生率有统计学差异(χ2=18.593,P<0.001),两两比较发现,单纯手术组明显高于PAC组(χ2=9.675,P=0.002)和NAC+PAC组(χ2=10.145,P=0.001),NAC组也明显高于PAC组(χ2=8.278,P=0.004)和NAC+PAC组(χ2=8.829,P=0.003),而单纯手术组与NAC组 无统计学差异(χ2=0.003,P=0.957),PAC组与NAC+PAC组无统计学差异(χ2=0.039,P=0.844)(表3)。
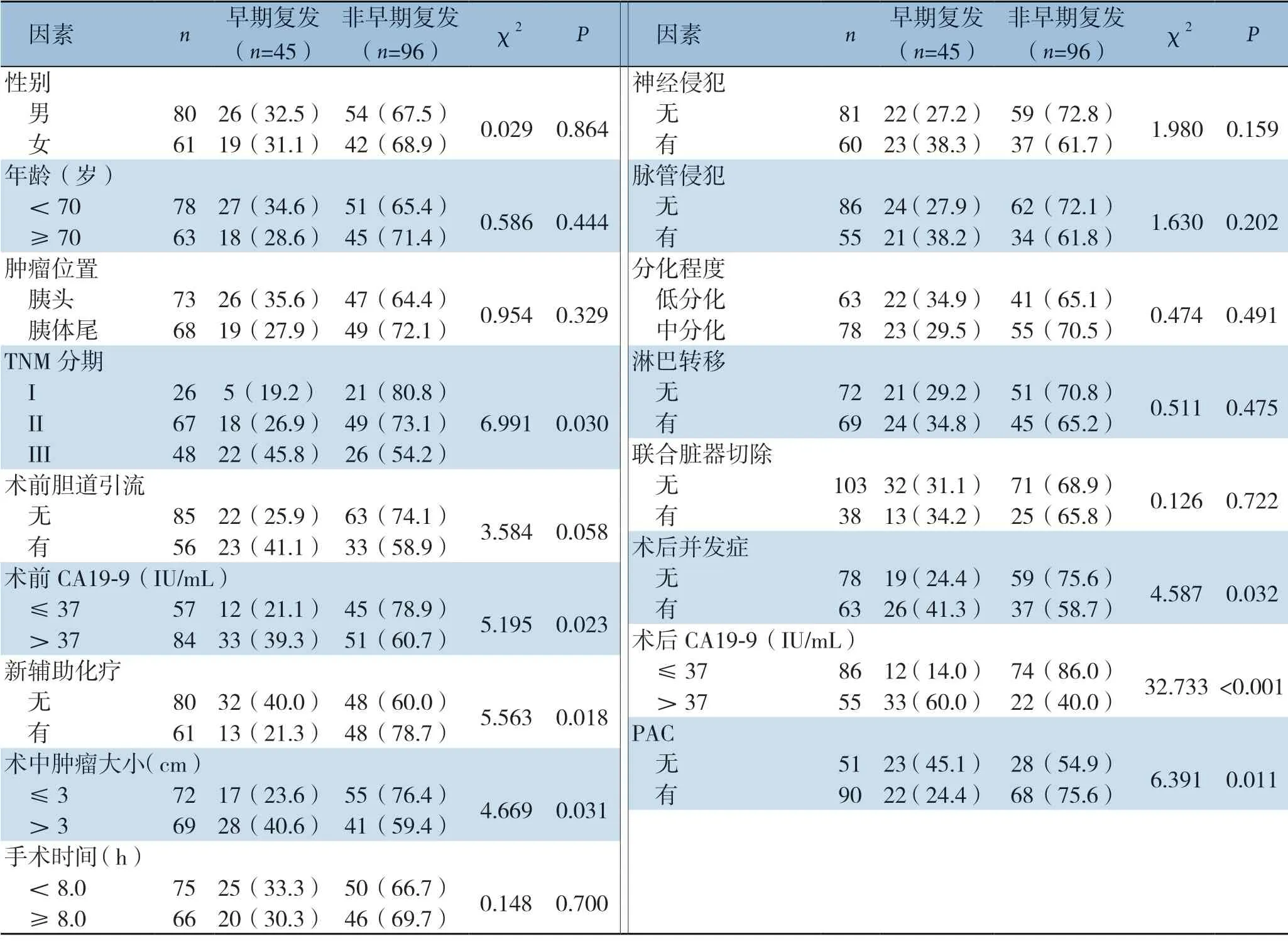
表2 早期复发与非早期复发患者临床病理特征比较[n(%)]Table 2 Comparison of the clinicopathologic characteristics between patients with and without early recurrence [n (%)]
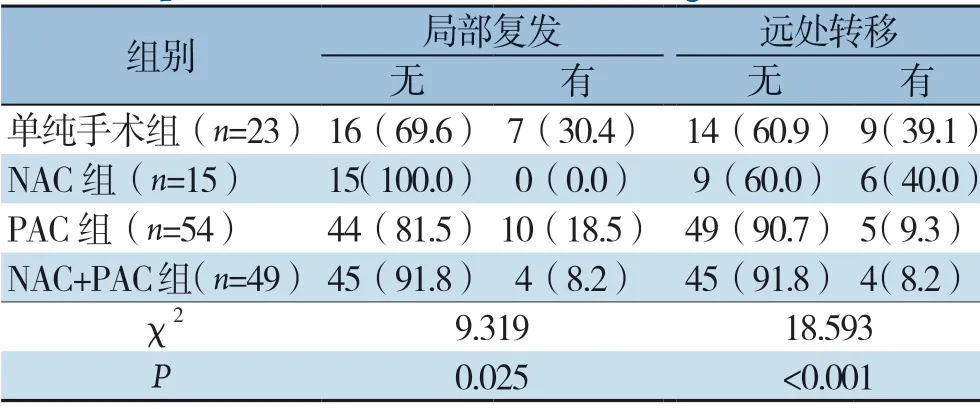
表3 不同治疗方案PDAC 患者早期复发部位分析Table 3 Analysis on the site of early recurrence in PDAC patients with different treatment regimens
2.4 PDAC 患者术后早期复发的多因素分析
将TNM 分期、术前CA 19-9 水平、NAC、术中肿瘤大小、术后并发症、术后CA 19-9 水平、PAC等临床病理因素进行多因素分析,结果显示,TNM 分期差(IIIvsI:HR=1.866,95%CI=1.148 ~3.035,P=0.012;III vs II:HR=1.790,95%CI=1.044~3.068,P=0.035)、术后CA 19-9 水平>37 IU/m L(HR=1.998,95%CI=1.200~3.325,P=0.008)和PAC缺失(HR=1.962,95%CI=1.176~3.273,P=0.010)是PDAC患者术后早期复发的独立危险因素(表4)。

表4 影响PDAC 患者术后早期复发的多因素分析Table 4 Multivariate analysis of early postoperative recurrence for PDAC patients
3 讨 论
美国国家综合癌症网络(NCCN)关于PDAC的新版指南[16]已将化疗参与的具体时间前移,化疗作为PDAC患者的序贯治疗,新版指南强调全身系统化疗应用于PDAC患者疾病进程中的各个阶段,包括可切除及交界可切除患者的新辅助治疗及局部进展期、转移性及复发性疾病的一线或后续治疗。对于可切除PDAC患者,尤其是存在高危因素的患者(如影像学证据、伴有CA19-9显著升高、原发肿瘤较大、区域淋巴结增大、BMI较低等)将从化疗中受益[17-18],因为它可以预防早期复发,这种早期复发即使在根治性切除后也很常见。
本研究显示,术后早期复发组的患者具有TNM分期晚、术前术后CA19-9升高、肿瘤直径超过3 cm、合并术后并发症及术前、PAC缺失等特点,证实术前、PAC对预防PDAC患者早期复发具有重要临床意义。
本研究为明确术前术后不同时期化疗对预防PDAC术后早期复发的临床意义,依据治疗方案的差别和复发部位的不同将入组患者进行分组比较,结果显示,在局部复发病例中,进行NAC的64例(NAC 组与NAC+PAC组)患者中仅有 4例出现局部复发,明显低于NAC缺失的患者(单纯手术组和PAC组);而只进行PAC的组中有 10例患者出现局部复发,与单纯手术组相比无统计学差异。在术后早期发生远处转移的患者中,单纯手术组和NAC组分别为9例(37.5%)和6例(25.0%),两组亦无统计学差异;而与之形成鲜明对比的是,PAC组和NAC+PAC组分别为5例(20.8%)和4例(16.7%)。此外,NAC+PAC组患者的局部复发和远处转移均明显低于单纯手术组。这些结果清楚地表明,NAC能较好地预防局部复发,但不能预防远处转移;而PAC可有效预防PDAC的早期远处转移,但对早期局部复发几乎无影响。
鉴于此,本研究对PDAC患者术后早期复发进行多因素分析,结果表明TNM分期晚、术后CA19-9>37 IU/mL及PAC的缺失是早期复发的独立危险因素,这与既往研究结果一致[19-20]。迄今为止,根据几项大规模随机对照研究的结果,PAC被认为是PDAC患者的标准治疗方案[21-23]。然而,本研究中约有30%的患者因术后恢复不佳或无法耐受化疗而拒绝PAC(单纯手术组与NAC组),由于PAC的缺失直接导致这些患者术后早期复发率明显升高,特别是进展期患者术后复发时间更早。
尽管本研究结果表明NAC不是PDAC患者的术后早期复发的独立危险因素,但依然发现它的重要价值,首先,NAC使局部微小病灶的早期治疗成为可能,特别是术前依靠影像学检查无法明确存在微小病灶患者的受益性更大;其次,术后并发症的发生势必妨碍辅助化疗的开始或完成,从而抵消了多模式治疗的好处。通过在手术切除前给予新辅助化疗,两种方式接受的机会都将增加;再者,虽然NAC尚无证据表明可改善患者远期预后,但有助于PDAC患者的肿瘤降期是得到一致认可的,而此类患者将获得手术的机会明显增加。新近发表的一项有关胰腺癌新辅助治疗的III期临床试验结果[24]表明,该研究共119例患者接受术前联合吉西他滨的新辅助放化疗方案,与直接PAC的患者相比,R0切除率明显提高,且肿瘤病灶局部更佳。
本研究有仍存在一定的局限性。一方面,这仅是单中心进行的回顾性研究,仅获得6年期间少数PDAC患者的数据,是小规模样本的结果。因此,需要增大样本量进行深入的研究以得出最终结论。另一方面,在本研究期间,NAC方案发生较大的变化[25-29],且PDAC各时间窗口的具体化疗方案目前没有明确的共识,现阶段大多借鉴对晚期胰腺癌有效的化疗方案,NCCN指南优先推荐以FOLFIRINOX或吉西他滨为基础的化疗方案[5,30-31],东亚地区尤以日本为主,选择以S-1 为基础的化疗方案,如联合吉西他滨、或者联合白蛋白紫杉醇。不同的化疗方案存在各自的优缺点,目前尚无最佳推荐,期待后续的RCT结果验证。本研究借鉴日本地区的研究结果,选择以GS方案,同时需要注意的是在开始使用新辅助化疗之前,很难预测哪些患者可能在病理反应方面受益,需后续研究明确获益人群特征。
总之,本研究提示PAC缺失是PDAC患者术后早期复发的独立危险因素,而NAC对预防PDAC的早期局部复发有很大的潜力。此外,对于不能进行PAC的患者,NAC作为弥补措施,应着重考虑它的临床价值。
