肺泡灌注黄芩甙元载药纳米治疗冠状病毒感染性肺炎大鼠的疗效与机制研究
2020-10-27周礼黄旭明张明兴
周礼 ,黄旭明,张明兴
1.广东药科大学附属第一医院康复医学科,广东 广州 510075;
2.清远市连南自治县人民医院脑科,广东 清远 540000
我国于2019年12月发现新型冠状病毒(2019-nCoV)感染性肺炎。传统治疗疗效不明确,寻找新的有效药物应成为治疗研究的重点。目前研究发现20%SARS-CoV表位与SARS-CoV-2,即2019-nCoV完全匹配,这些引起SARS-CoV免疫炎性反应的B细胞和T细胞表位极有可能对2019-nCoV有效[1]。因此进行SARS-CoV冠状病毒感染性肺炎的研究对于新型冠状病毒肺炎的疫情控制有极大意义。
目前对冠状病毒的研究多见于临床实验,体内研究有助于阐明冠状病毒感染的致病性,临床尸检结果都往往受经药物治疗等影响,观察不到单纯病毒感染造成的损伤,动物模型能更真实地反映冠状病毒感染情况及机制,更有利于筛选及研发药物[2]。回顾15 年前SARS-CoV 病毒流行亦引起肺部炎症及重症急性呼吸综合征,两种病毒均为同属冠状病毒,SARS-CoV的体内研究较2019-nCoR 有着较成熟和安全的实验条件,因此选择其进行相应研究[3-4]。
在多次疫情中,中药发挥了其特殊的作用,但其给药方式及疗效不确切。前期多项研究中也证实黄芩甙元(Baicalein)具有抗病毒及改善AD 大鼠神经系统免疫炎性反应的疗效[5-6],文献报道黄芩有广泛的生物活性,体内外实验证实其抗氧化可清除自由基,抑制人免疫缺陷病毒,治疗白血病[7-9]。但目前临床中多采取直接中药制剂口服,应用于冠状病毒中疗效不稳定,而脂质纳米粒(SLN)有缓释和稳定的生物特性,直接肺部给药,肺泡吸收面积大血管网络丰富,利于药物吸收转运[10-13]。本研究将Baicalein作为先导化合物进行结构修饰、纳米包装,在肺泡灌注基础上予定位给药,发现治疗后大鼠反应较前灵敏,考虑肺泡灌注黄芩甙元载药纳米治疗发挥抗病毒、抗免疫炎性反应的生理功能,该治疗方式比单纯肺泡灌注或口服给药更有利于发挥作用。
本实验制备SARS-CoV 大鼠模型,用肺泡灌注Baicalein载药纳米技术进行给药治疗,以行为学实验、病理学及生化等多项研究,验证其减轻免疫炎性反应的有效性及可行性,并揭示肺泡灌注Baicalein载药纳米技术改善冠状病毒感染大鼠的呼吸窘迫综合征作用机制。
1 材料与方法
1.1 实验动物与分组 SPF 级雄性Lewis大鼠(6周龄)96 只,体质量150~160 g,购于中山大学实验动物中心,饲养及实验按《实验动物使用及实验规程国家标准》及在P3+动物实验室[许可证号SYXK (京)2019.0003]负压隔离器中进行。所有实验动物在本实验室饲养环境中稳定1 周后按研究动物伦理委员会(IAEC)动物实验指南进行实验。根据随机数表法将Lewis 大鼠分为正常对照组、CoV 组、药物治疗组、安慰剂组,每组24 只。本研究使用的分离自冠状病毒肺炎患者的病毒PUMC01 株,主要使用Vero 细胞进行培养传代,经RT-PCR 确定为SARS 病毒,TCID50为106pfu/mL。
1.2 主要试剂及仪器 Baicalein购自美国APE×BIO公司;戊巴比妥钠购自中国中山大学实验中心;山嵛酸甘油酯购自法国GATTEFOSSE 公司;水溶性PVAc-203 购自北京正洁利达经贸有限公司;甘油、磷酸酶抑制剂、无水乙醇、苏木素-伊红染液购自天津大茂化学试剂有限公司;二甲苯、中性树胶购自国药集团化学试剂有限公司;SARS 病毒抗体诊断试剂盒购自北京华大生物技术有限公司;蛋白磷酸酶抑制剂混合物购自上海贝博生物公司;细胞因子ELISA试剂盒购自晶美生物有限公司。主要实验仪器:T型迷宫,酶标仪,电热恒温水浴箱,微量加样器,手术器械,病理切片机,涡旋混合器,超低温冰箱,脱色摇床,磁力搅拌器,高速搅拌机;Thermo Ascent FL荧光化学发光微孔板;ZetasizerNano ZS系列纳米粒度及Zeta电位分析仪;高速离心机,光学显微镜等。
1.3 实验方法
1.3.1 动物处理方法 对照组常规喂养,余组进行CoV 攻毒。鼻喷雾法接种病毒105TCID50(1 mL 体积)。于感染后第3、7天检测血清IgG抗体均为阳性,且抽样活检证书感染后肺部有相应病理变化。攻毒后7 d,随机分成CoV组、治疗组、安慰剂组;CoV组继续研究观察,治疗组按设计剂量肺泡灌注Baicalein载药纳米[Baicalein 10 mg/(kg·d)]治疗两周,安慰剂组给予肺泡灌注PBS 灌注液治疗两周。各组大鼠取攻毒后0 d、3 d、7 d、14 d、28 d进行体征反应等评估,观察比较各组皮毛、体重、食欲反应及“T”型迷宫实验,上述时间点行咽拭子及肺组织病毒分离方法检测病毒外排与复制的情况,于0 d、3 d、7 d、14 d、28 d每组各抽取模型动物安乐死后,肺组织匀浆上清细胞因子TNF-α、IL-6、IFN-γ及肺组织病理检测等后续实验。评估病程及治疗前后各组的动物病理变化及免疫学改变。
1.3.2 载药纳米的制备 黄芩甙标准品购自卫生部药品检定所;黄芩甙元标准品购自美国APExBIO公司;取0.5 g PVAc-203 和0.25 g 甘油加入到50 mL水中,在加热搅拌溶解后冷却。山嵛酸甘油酯0.5 g及1 mg Baicalein 熔融成有机相后逐滴加入75℃的上述水相中,11 000 r/min搅拌保持75℃,用高速剪切法,剪切速率为24 000 r/min,剪切时间为10 min,呈乳状液,4℃冰箱放置固化得平均粒径分别为200 nm 的Baicalein 的纳米水混悬液[11-12]。用HPLC 检测纳米制剂中黄芩甙元的含量,并作酶解前后的对比,可以准确而可靠地鉴定其保甙的效果,保证其内在质量[14-15]。
1.3.3 支气管肺泡灌洗术 按经典的灌洗操作方法进行设计[16-17]。灌洗液选取磷酸盐缓冲液(PBS,pH7.4),配置加入适量药物或安慰剂后,气管插管后进行在体操作的全肺灌洗技术,缓慢轻柔灌洗两次,单次灌洗量3~5 mL,灌洗液每次在肺组织内停留时间28 s[18-19]。
1.3.4 T 迷宫行为学实验 实验设计“T”型迷宫两臂,正确臂亮灯并放置食物,为奖励区,非正确臂尽头不亮灯无食物,转换开关变换正确臂区,进入亮灯区成功觅食,动物在实验前进行连续3 d的训练。第4日测试记录15 次随机变换正确臂,计算3 min 内每只大鼠成功到达正确臂的时间。
1.3.5 病毒分离及抗体检测 各组动物各时间点取肺脏组织标本0.5 mm3剪碎研磨成匀浆液,加于1.5 mL 离心管。离心6 000 r/min,10 min。将第一代上清24孔板内接种于VERO细胞孵化传代,三代后鉴定病毒。利用酶联免疫法进行SARS-CoV 特异性抗体IgG 检测,动物3%戊巴比妥钠麻醉后,心尖插入针头取血l mL分离血清,按试剂盒说明书进行操作。
1.3.6 肺组织匀浆上清细胞因子的测定 各组实验动物在相应时间点取血后,分二批取材。第一批处死后取肺组织冰域研磨匀浆,加入DMEM液配成10%的肺组织匀浆,2 800×g离心10 min,取上清。利用ELISA试剂盒测定细胞因子TNF-α、IL-6、IFN-γ的水平。
千里之行,始于足下,重视一堂课的导入,是一堂课成功的关键。若选准、选活了“切入点”,则能有效地设置问题情景,激活学生的思维,迅速地使学生进入“角色”,从而充分调动学习的积极性,主动性,使学生学起来兴趣盎然。俗话说:“好的开始是成功的一半”,因此,我非常重视课堂的导入设计,本文就是笔者的一点粗浅的体会。
1.3.7 病理组织学实验 各组实验动物第二批处死后取肺等组织,常规固定包埋、病理组织切片处理后,HE 染色,脱水封片,显微镜镜检观察各组动物的肺组织学结构,并对相关图像采集。
1.4 统计学方法 应用SPSS18.0 统计学软件分析实验数据,计量数据符合正态分布,以均数±标准差(±s)表示,多组间比较采用单因素方差分析,组间两两比较采用独立样本t 检验,以P<0.05 表示差异有统计学意义。
2 结果
2.1 建模评估 CoV组、治疗组及安慰剂组动物均采用鼻腔喷雾接种病毒105TCID50(1 mL体积)。于攻毒处理后第0、3、7 天检测血清IgG 抗体为阳性,感染后Lewis 大鼠具有精神萎靡、被毛粗乱,消瘦,活动减少,觅食量减少等表现,合造模成功检测标准,完成造模,见表1。

表1 攻毒SARS-CoV后各组大鼠IgG滴度值
2.2 行为学检查
2.2.1 动物行为学表现 攻毒处理后第1、3、7天CoV 组、治疗组及安慰剂组感染后Lewis 大鼠具有精神萎靡、被毛粗乱、消瘦、活动减少、觅食量减少等表现,攻毒7 d 后,予肺泡灌注黄芩甙元载药纳米、肺泡灌注安慰剂治疗。在实验14 d、28 d两个时间点,CoV组大鼠体质量进行性下降,反应萎靡;治疗组动物体质量无继续下降,活动及觅食量有明显改善,大致恢复攻毒前水平;安慰剂组动物体质量无继续下降,活动稍增多,觅食量较前稍增多。
2.2.2 T 迷宫实验 结果显示在0 d 各组大鼠达正确臂端耗时大致相同,差异无统计学意义。3 d时,与对照组相比,治疗组、CoV组、安慰剂组在迷宫中到达正确臂使用的时间增加,差异无统计学意义(P>0.05)。在7 d时,与对照组相比,治疗组、CoV组、安慰剂组在迷宫系统达正确臂时间增加,差异有统计学意义(P<0.05);治疗组、CoV 组、安慰剂组组间比较差异无统计学意义(P>0.05);7 d予肺泡灌注黄芩甙元载药纳米、肺泡灌注安慰剂治疗。14 d时,CoV组大鼠在到达正确臂时间为(36.29±1.58)s,与对照组(17.04±1.68)s比较差异有统计学意义(P<0.05)。而通过治疗14 d,治疗物组大鼠到达食物臂端的时间为(22.05±1.14)s,耗时较同时间点CoV组的明显减少,差异有统计学意义(P<0.05)。安慰剂组大鼠到达食物臂端所花费的时间减少;与安慰剂相比,治疗组大鼠到达食物臂端所花费的时间明显减少,差异有统计学意义(P<0.05)。在28 d,与CoV组相比较,治疗组、安慰剂组大鼠到达食物臂端所花费的时间明显减少,差异有统计学意义(P<0.05),见图1。
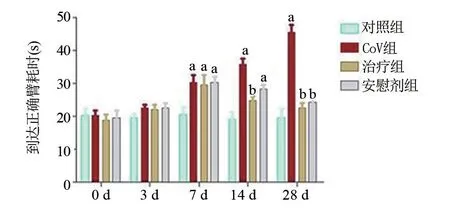
图1 各组大鼠的T型迷宫实验结果
2.2.3 病毒分离 CoV 组大鼠感染后3 d、7 d、14 d、28 d 的肺部病毒分离为阳性。治疗组大鼠感染后3 d、7 d 肺部病毒分离均为阳性,治疗干预后在14 d、28 d 病毒分离为阴性。安慰剂组感染后3 d、7 d肺部病毒分离均为阳性,治疗干预后在14 d、28 d病毒分离仍为阳性。

表2 各组大鼠的病毒检测汇总
2.2.5 肺匀浆上清细胞因子改变 在接种病毒前,各组大鼠肺组织匀浆上清中,TNF-α、IL-6、IFN-γ水平差异无统计学意义(P>0.05)。在接种病毒后3 d,CoV 组、治疗组、安慰剂组肺组织匀浆TNF-α、IL-6、IFN-γ水平均明显高于对照组水平,差异有统计学意义(P<0.05)。接种病毒后7 d,CoV 组、治疗组、安慰剂组肺组织匀浆TNF-α、IL-6、IFN-γ水平增高程度均较3 d 时更加明显,与各自攻毒前水平有显著增高,差异有统计学意义(P<0.05),与对照组相比有显著增高,差异有统计学意义(P<0.05)。在14 d、28 d,各组细胞因子水平有所下降,其中CoV 组TNF-α、IL-6、IFN-γ水平接种后3 d 相比,差异无统计学意义(P>0.05);治疗组、安慰剂组动物的TNF-α、IL-6、IFN-γ水平下降明显,与7 d 时各组的细胞因子水平相比,差异有统计学意义(P<0.05),见图2~图4。
2.2.6 肺组织病理学结果 在实验取大鼠肺组织活检,显微镜下提示在0 d 时各组大鼠肺组织无炎性浸润等异常(图5A)。攻毒后 3 d、7 d 时,Cov 组、治疗组、安慰剂组动物的肺组织可见:支气管上皮鳞状化生及脱落、黏膜层黏液腺增生;肺间隔增宽并相互融合、血管扩张充血、周围水肿伴大量炎细胞浸润,肺泡腔内存在纤维素样渗出物。与3 d 时比较,7 d 时各组的炎性损伤加重,出现严重的肺泡损伤(图5B)。14 d 时,对照组大致同前;CoV 组可见肺间隔断裂,肺泡弥漫性破坏伴单核细胞浸润,肺泡上皮细胞增生,有的融合形成多核肺细胞,相关周围血管水肿明显(图5C);治疗组可见炎症组织病变区缩小,淋巴细胞浸润数量较前减少,肺泡内渗出物减少,炎症改变较前减轻;安慰剂组见肺组织局限性炎症改变,与第7 天类似,并有肺间隔增厚增宽,肺间隔内有出血及渗出,内见大量单核细胞、组织细胞浸润。28 d时,对照组大致同前;CoV组见肺泡结构被破坏,纤维结缔组织增生,伴增厚的肺间隔内有红细胞及淋巴细胞浸润(图5D);安慰剂组炎症组织病变区缩小,肺间隔增厚,可见纤维结缔组织增生,肺间隔内见出血及渗出,其中可见少许单核细胞、组织细胞浸润(图5E);治疗组可见炎症组织病变区明显缩小,肺泡结构完整,无渗出,未见纤维结缔组织增生(图5F)。
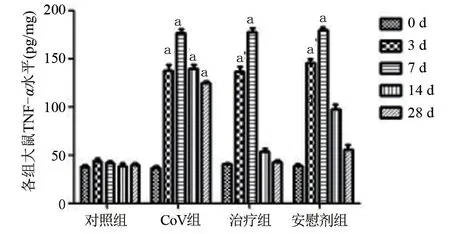
图2 各组大鼠攻毒后肺组织匀浆上清TNF-ɑ水平变化

图3 各组大鼠攻毒后肺组织匀浆上清IL-6水平变化

图4 各组大鼠攻毒后肺组织匀浆上清IFN-γ水平变化
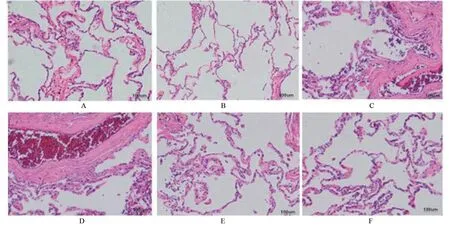
图5 各组大鼠大肺组织病理组织学改变(HE×100)
3 讨论
据报道,冠状病毒感染性肺炎患者以呼吸道症状为主,辅助检查可见典型的胸部CT影像特征,给人类健康带来了巨大的危害,因此,研究其病因及有效治疗手段十分重要。本研究拟通过表位匹配的冠状病毒模型进行相关研究,阐明新型冠状病毒感染的发病机制及系统探讨治疗手段。
根据目前临床流行病学研究报道指出,冠状病毒感染性肺炎的临床症状聚焦感染,为以肺部感染为主的全身性免疫炎性反应。本研究鼻喷雾法接种构建冠状病毒感染性肺炎大鼠模型,观察到病毒感染后7 d时,与对照组相比,CoV组大鼠出现明显的精神萎靡、活动觅食减少、被毛粗乱、消瘦,行为学检查提示在T迷宫中到达正确臂耗时显著增加;CoV组大鼠肺组织分离出冠状病毒血清SARS-CoV特异性抗体IgG检测阳性,且随着感染的时间延长而滴度增高,7~14 d时达峰值;肺组织病理学检查见肺间隔增宽并相互融合、血管扩张充血、周围水肿伴大量炎细胞浸润等炎症改变。14 d时,无治疗的CoV组大鼠病理检查提示肺部炎性损伤加重,与调研中冠状病毒感染患者的症状相吻合。本研究也观察了肺组织匀浆上清炎性相关细胞因子的表达情况。实验结果亦显示与正常对照组相比,CoV 组大鼠的肺匀浆上清中检测出的IL-6、TNF-α、IFN-γ水平明显增高,而与3 d 时比较,7 d 时CoV组大鼠的肺匀浆上清中IL-6、TNF-α、IFN-γ水平也被证实增高更加明显。
目前临床研究报告指出中药及肺泡灌注在冠状病毒感染的疫情控制中发挥了其特殊作用,多项研究发现黄芩甙元具有抗病毒及改善免疫炎性反应的疗效,肺泡灌注清除肺泡黏液[19]。分组进行肺泡灌注载药纳米黄芩甙元技术治疗有效性的探讨,研究观察到,在14 d、28 d 两个时间点,无治疗的CoV 组大鼠体重进行性下降,反应萎靡;治疗组及安慰剂组大鼠体重无继续下降,活动及觅食量有改善,其中治疗组改善较安慰剂组明显。行为学实验亦提示在实验7 d、14 d 时,治疗组大鼠T 迷宫实验中达正确臂耗时显著少于CoV 组,且疗效随着时间发展得到进一步改善。病理学结果提示14 d 时,CoV 组肺部炎性损伤加重,治疗组见炎症组织病变区缩小,淋巴细胞浸润数量及肺泡内渗出物减少,安慰剂组仍可见肺组织呈局限性的大致同前的炎症改变;28 d 时治疗组可见炎症组织病变区明显缩小好转,肺泡结构完整,无出血、渗出;而CoV 组可见病变区肺泡破坏并出现纤维结缔组织增生,伴有出血、渗出等严重的破坏。安慰剂组亦有相应好转,炎症组织病变缩小,但可见肺间隔内见出血、渗出、少许单核细胞等浸润。上述研究结果证实冠状病毒感染性疾病有淋巴细胞浸润数量及肺泡内渗出物增多等特征性病理改变;感染冠状病毒后,应用肺泡灌注黄芩甙元载药纳米的治疗方式,可有效减轻该炎性反应,改善大鼠的机能,通过内源性抗氧化防御保护了器官组织的炎性损伤。冠状病毒感染可造成肺泡黏液组织分泌增多等病理改变,而安慰剂组单纯肺泡灌注清除肺泡黏液,疗效不如治疗组。
目前国内外研究指出,冠状病毒感染性肺炎的间质性肺炎与免疫炎症反应程度、冠状病毒的感染及复制相关。本研究中,14 d时治疗组肺部病毒分离转阴,血清IgG抗体滴度在治疗后即逐渐下降,在28 d时,滴度下降明显,与对照组比较差异无统计学意义。而安慰组单纯肺泡灌注干预后病毒分离仍为阳性,在14 d、28 d 时,血清IgG 抗体滴度有所下降。另外,在14 d、28 d,治疗组及安慰剂组的肺匀浆上清中IL-6、TNF-α、IFN-γ因子水平下降,在28 d 时,治疗组上述因子水平与同组在3 d、7 d时相比,细胞因子水平明显下降,改变是有统计学意义的;且在28 d时,与对照组相比,治疗组上述因子水平差异无统计学意义。结果所示,经肺泡灌注载药纳米黄芩甙元技术治疗后,治疗组的大鼠行为临床状态、肺部病变的改变与其肺组织匀浆上清的IL-6、TNF-α、IFN-γ水平改变相关。安慰剂组肺部炎症减轻,匀浆上清细胞因子水平所下降,但治疗组较安慰剂组有效。验证肺泡灌注黄芩甙元载药纳米的治疗方式通过内源性抗氧化防御,减轻免疫炎性反应,并抑制了病毒的复制及存活,抑制了肺组织的应激损伤;而安慰剂组单纯使用肺泡灌注技术可稀释气管肺泡分泌物、畅通气道,无法从根本上清除病毒,疗效不及治疗组。
综上所述,肺泡灌注载药纳米黄芩甙元技术通过减轻免疫炎性反应改善冠状病毒感染大鼠的急性呼吸综合征,对冠状病毒感染性肺炎有明确治疗效果的,值得应用推广。这一发现为新型冠状病毒的临床药物研发奠定了基础,对新型冠状病毒的发病机制的研究提供研发新思路。
