去甲基姜黄素对脑梗死大鼠COX-2和iNOS水平的影响
2020-10-27葛龙敏李玥熠祝春华
葛龙敏, 李玥熠, 祝春华
(1.河北省石家庄市第三医院保健科,河北 石家庄 050011;2.河北医科大学基础医学院2016级临床医学一大班,河北 石家庄 050017;3.河北医科大学第二医院神经内科,河北 石家庄 050000)
从全世界范围来看,卒中是目前导致成年人残疾和死亡的最重要原因,给社会和家庭都带来沉重负担。我国缺血性卒中患者约占3/4以上,并且近年来发病率和病死率的增长速度明显超过了世界平均水平[1]。尽管重组组织纤溶酶原激活剂(recombinant tissue plasminogen activator,rtPA)等静脉溶栓药物和血管内治疗技术的推广应用,已成为急性缺血性脑卒中重新开通血管的最有效方法,然而由于治疗时间窗较短,仅约2%的患者从中获益。尽管竭尽全力的挽救缺血脑组织,但仍然有超过50%的患者致残甚至死亡[1]。近年来在脑梗死后的病理生理机制方面的研究已经取得了重大进展,但目前仍迫切需要探寻更有效的治疗药物,来改善脑梗死的预后。姜黄素(curcumin)是中药姜黄的主要活性成分,是来源于姜科植物的一种小分子植物酸性多酚。研究发现,姜黄素具有抗炎、抗血栓形成、抗肿瘤、抗凋亡以及神经保护作用等[2]。一般所指的姜黄素是包括姜黄素、去甲基姜黄素(demethoxycurcumin,DMC)和双去甲基姜黄素(bisdemethoxycurcumin,BDMC)三种化学成分的混合,其中姜黄素所占比例最大。但是,由于姜黄素在酸性或中性环境中水溶性差,在碱性溶液中又不稳定,使其口服制剂的生物利用度较低;此外,姜黄素具有体内清除迅速的特点,也是制约其药物应用的主要原因[3-4]。越来越多的证据表明,DMC比姜黄素具有更好的抗肿瘤和抗炎效果,并具有更强的疗效和更好的生物稳定性,成为一种具有吸引力和前景的姜黄素替代品[5]。前期研究结果显示[6],DMC通过降低血管内皮细胞环氧合酶2(cyclooxygenase-2,COX-2)水平,改善自发性高血压大鼠(spontaneous hypertensive rats,SHR)的内皮功能。COX-2不仅介导高血压导致的血管内皮损害,还是参与组织缺血后炎症反应的重要分子。而DMC是否也通过抑制COX-2对脑梗死有保护作用,目前未见详细报道。因此,本研究采用SHR构建大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型,观察DMC对COX-2和iNOS的调控作用,探讨DMC对脑梗死的保护作用。
1 材料与方法
1.1实验材料 DMC(购于成都曼斯特制药有限公司),分子式C20H18O5,纯度大于98%;二甲基亚砜(dimethyl sulfoxide,DMSO)(美国Sigma-Aldrich公司);兔抗大鼠COX-2多克隆抗体(美国Abcam公司);兔抗大鼠iNOS多克隆抗体(美国Abcam公司);鼠抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)多克隆抗体(美国Ambion公司);PVDF膜(美国Millipore公司);Synergy-HT多功能酶标仪(美国Bio-Tek);5417R冷冻高速离心机(德国Eppendorf公司);线栓(2432-A,北京沙东生物技术有限公司),线体总长4.0 cm,直径0.24 mm,末端呈球形直径为(0.32 ± 0.02) mm。
1.2实验动物和分组 雄性30周龄的SHR由东南大学实验动物服务中心提供,饲养环境为室温22~24 ℃,光照/黑暗周期为12 h,自由摄取标准饮食和水。将SHR随机分为对照组和DMC组。参照前期观察DMC改善SHR血管内皮功能的动物实验数据[6],DMC组大鼠给予腹腔注射DMC(10 mg/kg)+DMSO,1次/d,持续3周;对照组给予溶剂对照,即腹腔注射同等体积的DMSO,1次/d,持续3周。
1.3构建SHR脑梗死模型 参照Longa等[7]的线栓法制作右侧MCAO动物模型。水合氯醛(35 mg/kg)腹腔注射麻醉,腹部朝上固定大鼠。颈部去毛后消毒,于正中部位切口约3.0 cm,沿胸锁乳突肌内缘逐层钝性分离肌肉和筋膜至颈总动脉(common carotid artery,CCA),并沿CCA向上分离血管以及与血管伴行的神经,谨慎剥离颈外动脉(external carotid artery,ECA)以及颈内动脉(internal carotid artery,ICA),再沿ECA向颅底方向剥离,结扎ECA发出的分支翼腭动脉,使用动脉夹暂时夹闭ICA和CCA,在ECA上剪一切口,由此口处插入线栓并进入ICA的颅内段,松开ICA动脉夹,线栓进入深度为距离CCA分叉处约18 mm,结扎固定,消毒后缝合皮肤。手术中及术毕维持SHR肛温在37 ℃左右,直至其恢复自主活动。全部SHR完成手术后,均在20~25 ℃恒温、洁净条件下饲养,自由进食水。评价MCAO模型成功的标准为同时具备以下体征:①疼痛刺激时左侧肢体回缩迟钝或消失;②抓尾悬空时,SHR左前肢向胸前屈曲;③自主行走时大鼠身体向右侧倾,或向右转圈不能走直线;④右侧眼部出现 Honer's症。
1.4神经功能评价 术后24 h时,采用单盲法、改良的Longa分级法[7],评价各组大鼠MCAO术后肢体神经功能缺失情况:无肢体功能异常为0分;左侧前肢不能伸展为1分;左侧前肢屈曲为2分;身体轻度向左侧转圈为3分;身体严重向左侧转圈为4分;整个身体向左侧倾倒为5分。
1.5测量脑梗死体积 MCAO术后24 h时,将各组大鼠断头并剥取脑,去除小脑和脑干,在脑切片模具上均匀、冠状将大脑切成5片,厚度约3 mm,全部浸入2%的2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)溶液中染色,放置37 ℃恒温环境30 min后,在4 %多聚甲醛液体中固定24 h。红色区域为正常脑组织,苍白色区域为脑梗死病灶。脑片逐个拍照,利用图像分析软件 Image J(ver1.37c,NIH)测定脑梗死面积,并采用公式=(矫正右侧脑梗死体积/左侧大脑半球体积)×100%计算脑梗死体积的百分比数值。
1.6Western blot方法 检测COX-2、iNOS蛋白水平 MCAO术后24 h时,各组SHR取脑梗死核心周围的皮层脑组织,采用Lowry法(Bio-Rad Laboratories,Hercules,CA,USA)测定蛋白浓度。等数量的蛋白质样品在10% SDS-聚丙烯酰胺凝胶上电泳约100 min,在4 ℃条件下转移、固定到PVDF膜上。用5%脱脂牛奶室温非特异性封闭1 h后,加入兔抗大鼠COX-2(1∶500封闭液稀释)、兔抗大鼠iNOS多克隆抗体(1∶500封闭液稀释),鼠抗GAPDH多克隆抗体(1∶400,封闭液稀释),4 ℃孵育过夜。后将膜在PBST中洗涤3次,然后与羊抗兔IgG荧光抗体抗体(1∶3 000,封闭液稀释)在室温下孵育1 h。最后一次洗膜后,酶标仪上扫描,并测定目标抗体条带的单位密度。以GAPDH作为内参。
1.7统计学方法 应用SPSS 13.0统计软件处理数据。计量资料比较采用独立样本t检验。P<0.05为差异有统计学意义。
2 结 果
2.1DMC减轻MCAO术后的神经功能损害 在术后24 h时,对照组和DMC组Longa评分均较高,与对照组比较,DMC组的Longa评分显著降低,差异有统计学意义(P<0.05)。见表1。
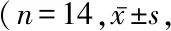
表1 DMC减轻MCAO术后神经功能损害 分)
2.2DMC显著减小MCAO术后脑梗死体积 对照组和DMC组均可见不同大小的脑梗死病灶。与对照组比较,DMC组脑梗死病灶体积明显减小(P<0.05)。见图1和表2。
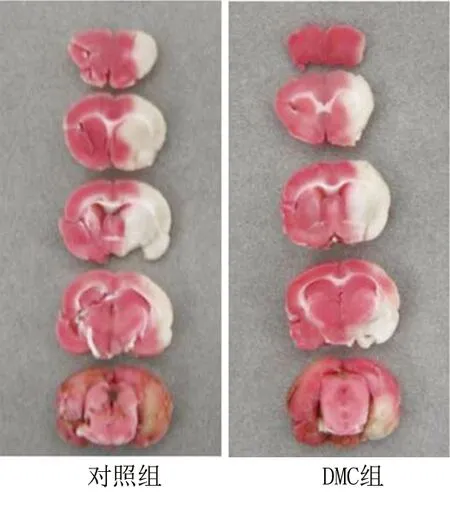
图1 DMC减小MCAO后脑梗死体积
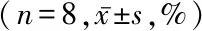
表2 DMC减小MCAO后脑梗死体积
2.3DMC抑制MCAO术后COX-2、iNOS的表达水平 Western blot的结果显示,MCAO术后24 h时,与对照组比较,DMC组COX-2、iNOS蛋白表达水平被显著抑制,差异有统计学意义(P<0.05)。见表3。
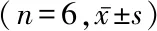
表3 DMC抑制MCAO术后COX-2、iNOS蛋白表达水平
3 讨 论
高血压是脑卒中最重要的危险因素,与脑卒中之间存在强烈的、连续的、一致的、独立的相关性[8]。在我国,因脑卒中所致的社会和经济负担中有73%与高血压有关[9]。前期研究结果显示,DMC抑制COX-2水平,改善了SHR肾动脉的血管内皮功能,并有直接降低SHR血压的作用[10]。在此基础上,本研究进一步观察了DMC对SHR脑梗死的作用。选择SHR构建MCAO模型,与普通大鼠比较,能够更好地模拟脑梗死的发生、发展过程,更符合目前脑梗死临床背景。本研究结果显示,DMC预处理能够显著改善SHR脑梗死后肢体的神经功能,并减小了脑梗死体积,抑制COX-2和iNOS表达水平。与Ramkumar等[11]发现DMC抑制COX-2、iNOS等炎症因子,对帕金森病大鼠模型具有抗炎、抗氧化等神经保护作用的结果类似。有研究发现,在帕金森治疗过程中,DMC是最有效的抑制左旋多巴代谢酶的药物之一[12]。此外,Hatamipour 等[10]对于DMC的广泛作用进行的系统综述中,详细总结了DMC具有抗炎、神经保护、抗高血压、抗菌和血管舒张等作用,并且根据DMC抗炎和神经保护作用机制方面的研究显示,COX-2、iNOS是重要的参与分子。
环氧合酶(cyclooxygenases,COX)是花生四烯酸转化为前列腺素的关键酶,COX家族包括COX-1和COX-2两种亚型。COX-2不仅介导血管内皮的炎症反应,产生活性氧(reactive oxygen species,ROS)导致内皮细胞功能紊乱和血管收缩,而且也是脑梗死后炎症性脑损伤过程的重要参与者[6]。脑梗死后COX-2的表达水平于12~24 h时达到高峰,主要分布于脑梗死病灶周围的神经元和血管内皮细胞。而且,在脑梗死模型中选择性抑制COX-2水平可以减少20%~30%的脑梗死体积,并有效减少神经元损伤,且与抑制谷氨酸神经毒性以及继发的炎症反应有关[13]。因此认为,COX-2参与了脑梗死早期的损伤过程,可能是治疗脑梗死的一个有价值的治疗靶点。DMC是传统中药的有效成分,具有抗炎、抗肿瘤、抗凋亡等多效性。本研究中,DMC抑制COX-2水平,减轻了脑梗死后炎症反应,具有脑保护作用。
一氧化氮(nitric oxide,NO)是广泛分布于各种组织,特别是神经系统的生物信号分子。研究表明,脑梗死早期NO即反应性显著升高,NO可以刺激线粒体产生超氧化物和二氧化氢,通过细胞凋亡机制以及抑制呼吸和糖酵解过程而加速细胞死亡。一氧化氮合酶(nitric oxide synthase,NOS)是催化NO合成的关键酶,包括nNOS、eNOS和iNOS三种亚型。其中,nNOS主要定位于正常神经元,eNOS主要存在于内皮细胞和一些神经元中。与前两者不同,iNOS只是在炎症状态下诱导表达,在中枢神经系统主要分布于胶质细胞。在脑梗死时iNOS被迅速诱导并产生大量NO,两者共同参与炎症反应过程。有大量研究证明,抑制iNOS表达水平能够明显抑制炎症反应和氧化应激,从而减小脑梗死体积、减轻缺血性脑损伤[14]。
COX-2和iNOS不仅仅是两个参与炎症反应的重要分子,在炎症反应过程中两者之间还有紧密关联。在体外研究中发现,COX-2抑制剂对心肌细胞缺氧时的保护作用与抑制iNOS表达增强有关[15]。与Romana-Souza等[16]在压疮小鼠皮肤创面愈合的研究结果相似,COX-2选择性抑制塞来昔布通过降低iNOS和COX-2的表达,改善压疮创面愈合,减轻创面炎症,促进真皮重建和瘢痕形成。由此可见,在参与不同组织、不同环境的炎症反应过程中,COX-2对iNOS可能有一定调控作用,详细机制仍需深入研究。
在本研究中,DMC抑制了MCAO诱导的COX-2和iNOS表达,抑制炎症反应,减轻缺血性脑损伤。在前期研究证明DMC有效抑制血管内皮炎症、改善SHR肾动脉血管功能的研究基础之上[6],进一步证明了DMC预处理对脑梗死具有保护作用。但对脑梗死后干预治疗是否具体同等的效果以及详细机制仍需进一步探讨。
