圈养野生动物粪便中大肠杆菌的分离鉴定和耐药性分析
2020-10-27林德贵谢绪昌
刘 青 雷 蕾 李 伟 仉 伟 林德贵* 汪 洋* 谢绪昌*
(1.中国农业大学动物医学院,北京,100193;2.济南动物园,济南,250031)
目前动物细菌感染性疾病防治主要依赖抗菌药物[1],抗菌药长期不当使用导致的细菌耐药性问题变得日益严峻,全国各地均出现了不同程度的耐药菌,而且交叉耐药、多重耐药现象也在加剧[2]。大肠杆菌(Escherichiacoli)为革兰氏阴性菌,在土壤、水、动物粪便等多种环境中均有分离,是人和动物消化道的常见菌,也是进行流行病学调查和研究的重要指示菌。大肠杆菌不仅可以通过外源捕获耐药基因和自身基因突变产生耐药性,还可将耐药因子进行垂直和水平传播,可以通过食物链或接触等方式在不同的生态系统间传播[3-4],成为动物体内潜在的耐药基因库[5-6]。
圈养野生动物抗菌药物主要用于个体动物抗感染治疗,部分用于细菌性疾病的预防,没有作为促生长剂添加使用,但在临床治疗过程中多重耐药菌的比例也日益增多。据报道圈养虎(Pantheratigris)源大肠杆菌对氯霉素的耐药率达85%,对氟苯尼考的耐药率为78%[7];陆晓健等[8]从某动物园中分离出69株大肠杆菌进行耐药性检测,结果对头孢唑林、四环素、复方新诺明的耐药率分别达41.42%、61.13%、48.28%;伍清林等[9]从圈养珍禽舍及动物体内分离的18株大肠杆菌均为多重耐药菌株。圈养野生动物耐药菌的不断增加,给临床治疗带来不小的压力,因此通过对动物体内常在菌抗菌药物耐药性的检测,了解动物群体耐药性,探索耐药性产生的原因至关重要,不仅为临床治疗合理用药提供参考和指导,也为制定野生动物抗菌药物应用政策、管理措施及评价干预手段等提供数据。圈养野生动物有种类多、数量少的特点,本文按照食性结构将其分为四大类:草食动物、杂食动物、肉食动物及禽类动物进行耐药性分析。
1 材料与方法
1.1 样本采集
2019年5—10月,用无菌棉签采集圈养野生动物新鲜粪便,放入含有500 μL无菌PBS的1.5 mL离心管中,其中包括草食动物40份,杂食动物27份,禽类26份,肉食类14份,合计采集样本107份;采集动物常用蔬菜5份、水果3份、肉类3份、鱼类5份、颗粒料2份、饮水2份,共计20份至无菌密封袋内,冰盒暂存,2 h内带回实验室进行处理。
1.2 试剂与材料
抗生素标准品:β-内酰胺类(氨苄青霉素、阿莫西林、头孢唑啉、头孢噻肟钠、美罗培南)、多肽类(多黏菌素)、喹诺酮类(诺氟沙星、环丙沙星)、氨基糖苷类(卡那霉素、庆大霉素)、酰胺醇类(氯霉素、氟苯尼考)、四环素类(土霉素、多西环素)、磺胺类(磺胺甲噁唑)购自北京索莱宝科技有限公司;麦康凯琼脂、营养肉汤、脑心浸液肉汤、MH肉汤培养、缓冲蛋白胨水(BPW)基购自青岛海博生物技术有限公司;ECC显色培养基购自上海欣中生物工程有限公司;质控菌株:大肠埃希菌ATCC 25922购自山东鑫科生物科技股份有限公司。
2 试验方法
2.1 抗生素的配制
按照美国临床实验室标准委员会(CLSI 2017)中的方法配制抗生素储存液,-20 ℃保存待用。
2.2 大肠杆菌的分离
将500 μL含有粪样的PBS加入内含2 mL灭菌营养肉汤的试管中,37 ℃恒温培养12 h;将食物样品25 g加入225 mL BPW中充分振荡,将洗涤液置于摇床中复活4 h后,取500 μL加入含2 mL灭菌营养肉汤的试管中,37 ℃恒温培养12 h。将扩增后的菌液稀释到适宜浓度涂布到ECC显色培养基中,37 ℃培养18—24 h,选取平板上蓝绿色单菌落进行纯化,纯化后挑取单菌落至1 mL脑心浸液肉汤中培养4 h,取400 μL菌液加入200 μL 60%甘油中,-20 ℃冷冻保存。
2.3 大肠杆菌的鉴定
采用水煮法提取纯化后的细菌DNA,利用细菌16S rRNA基因通用引物(16S-F:AGAGTTTGATCMTGGCTCAG,16S-R:GGTTACCTTGTTACGACTT)进行PCR扩增,阳性产物送至上海生物工程有限公司进行测序。将测序结果与GenBank中参考菌株的序列进行相似性比对,同源性达到99%以上即判定为大肠杆菌。
2.4 耐药性检测
根据CLSI推荐的微量肉汤法,对分离的大肠杆菌进行抗菌药物最小抑菌浓度(minimal inhibitory concentration,MIC)检测,阳性对照为大肠杆菌ATCC 25922菌株,结果判定参照CLSI标准以敏感(S)、中介(I)和耐药(R)3种形式记录。
2.5 耐药基因型检测
引物序列及反应条件见表1,PCR体系:2×TaqMaster Mix 12.5 μL,上、下游引物各0.5 μL,DNA模板2 μL,ddH2O补齐至25 μL。反应程序:95 ℃预变性5 min,95 ℃变性0.5 min,退火0.5 min温度见表1,延伸时间见表1,30个循环,72 ℃延伸10 min。1%—2%琼脂糖凝胶电泳鉴定,结果用凝胶成像系统观察。

续表1
3 结果与分析
3.1 大肠杆菌分离鉴定
动物粪便样本中大肠杆菌的分离率为100%,食物源大肠杆菌的分离率65%,共计分离出120株。其中草食动物40株,杂食动物27株,肉食动物14株,禽类动物26株,食物13株,具体分离情况见表2。
3.2 体外药物耐药率结果
通过对分离出的120株大肠杆菌耐药性进行检测,动物源大肠杆菌有49.5%菌株对至少1种抗生素耐药,其中四环素和磺胺类耐药率最高,均为41.1%,其次是β-内酰胺类、酰胺醇类和氨基糖苷类,分别为31.8%、17.8%、14.0%,多肽类和喹诺酮类较敏感,分别为3.7%和4.7%,没有出现耐美罗培南菌株,15种抗菌药物耐药率见图1。
不同种动物对抗菌药物的耐药情况有显著差异,其中肉食动物源大肠杆菌中92.9%的菌株对至少1种药物耐药,其次是禽类动物源和杂食动物源大肠杆菌,分别是69.2%、48.1%,草食动物较低为22.5%,食物样本中仅分离出1株耐药菌,详细结果见表3。
对3类及以上抗菌药物耐药定义为多重耐药菌,共计分离出35株多重耐药菌,其中从肉食动物、禽类动物中分离的多重耐药菌株较多,均为12株,其次为杂食动物,草食动物最低,仅1株。

表2 大肠杆菌分离统计

图1 圈养野生动物粪便大肠杆菌对15种抗菌药物的耐药率结果Fig.1 Results of resistance rate of fecal Escherichia coli of wild animals to 15 antimicrobial agents

表3 大肠杆菌耐药表型结果

图2 不同种类圈养野生动物粪便大肠杆菌多重耐药情况对比Fig.2 Comparison of multiple drug resistance of fecal Escherichia coli in different kinds of wild animals
3.3 耐药基因型检测结果
对53株动物源性耐药菌和1株食物源性耐药菌进行22种耐药基因型检测,结果显示tetA、sulII、blaTEM是最流行的耐药基因。动物源性耐药菌有50% β-内酰胺类耐药菌株携带blaTEM基因,四环素类耐药菌株有78.2%携带tetA基因,磺胺类耐药菌株有45.5%携带sulII基因。耐酰胺醇类、四环素和磺胺类菌株可检测出携带两种以上耐药基因(表4)。
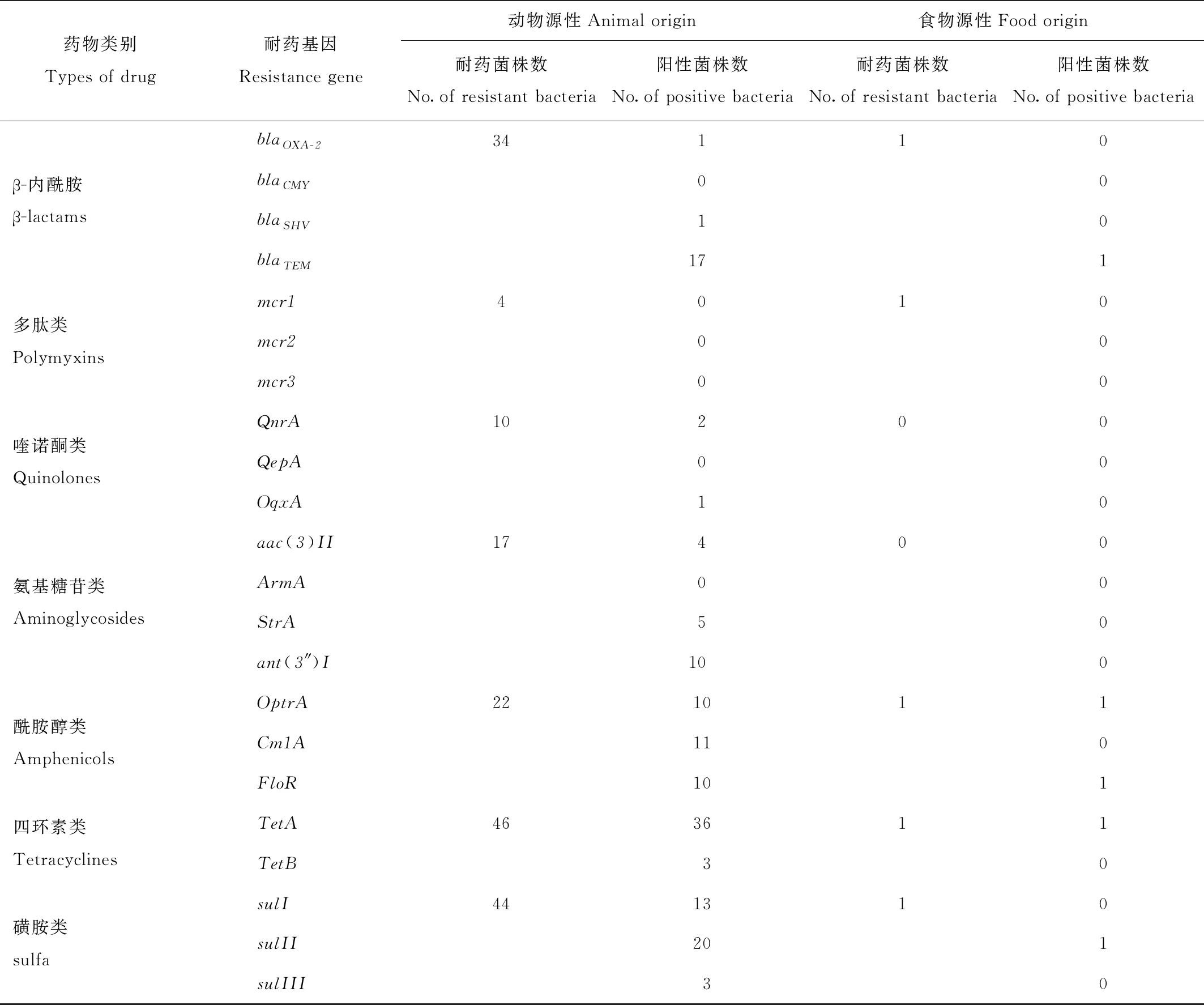
表4 耐药基因型检测结果
4 讨论
本研究初步调查了该园区圈养野生动物粪便中大肠杆菌的耐药情况,107株动物源性样本中,49.5%的菌对至少1种抗菌药物耐药。对磺胺类、四环素类、β-内酰胺类的耐药率较高,分别为41.1%、41.1%、31.8%,这一结果普遍低于畜牧业中猪源、禽源大肠杆菌的耐药率[10-12]。圈养野生动物大肠杆菌耐药性的产生与多种因素有关。
4.1 抗菌药物使用
本研究中四环素和磺胺类抗生素耐药率较高,这与陆晓健等[8]的检测结果一致。野生动物在治疗时为降低应激反应,在动物可以自主采食的前提下首选口服药物进行治疗,磺胺类药物中的复方新诺明又是常用的口服用药之一,使用时间长、范围广,这可能是其产生高耐药率的重要因素。此外磺胺类药物主要耐药基因sul可通过转座子、质粒和整合子在细菌间传递[13],进一步提高了细菌对该类药物的抗性。其中sulII、sulI检出率较高,与部分猪源、禽源、狐源等大肠杆菌耐药基因的检测结果相同[14-18]。
β-内酰胺类药物也是临床中使用较多的一类抗生素,其中第一代头孢菌素使用时间较长,所检测出的耐药菌株对青霉素和阿莫西林、头孢唑啉耐药浓度均大于128 μg/mL,显示出了较高的耐药性。近几年随着第三代头孢菌素在野生动物治疗领域的普及使用,约1/3菌株对头孢噻肟耐药,韩天飞等[19]指出TEM型β-内酰胺酶耐药基因总体呈现检出率高、亚型多的特点,本研究中有50%耐药菌株携带blaTEM基因,因此要特别注意超广谱β-内酰胺酶的产生。
喹诺酮类耐药率较低,为4.7%,仅在肉食动物和杂食动物粪便中分离出4株和1株耐喹诺酮类耐药菌株,这与临床用药相一致。另外多肽类药物在该园区没有用药记录,耐药基因的来源有待进一步研究。
4.2 耐药基因传播方式
牛建宁等[20]指出大肠杆菌对四环素的耐药性是所有抗生素中最严重的,这与四环素广泛被用于治疗、预防以及用作生长促进剂紧密相关。园区内四环素类药物中常用的是土霉素,主要用于肠道感染的治疗,但近几年的使用量明显减小,也没有作为促生长剂添加使用,高耐药的产生可能与该类药物耐药基因的传播方式有关。tet基因广泛存在于人、动物和环境中分离的细菌中,大多数tet基因都与结合或移动元素相连,在细菌的种间或属间进行转移,因此在细菌中广泛分布。本研究中有78.2%的耐药菌株携带tetA基因,提示主动外排作用是对四环素类药物产生耐药性的主要机制。
氨基糖苷类抗生素对多数革兰氏阴性菌杆菌有较强的作用,常用于消化道疾病的治疗,常用的是庆大霉素、卡那霉素。这2种药物在临床治疗中使用较普遍,但耐药率较低,本研究中检测到的耐药基因全部来源于氨基糖苷修饰酶的化学修饰作用,没有检测到位于可转移质粒的复合转座子上的armA基因。
4.3 动物种属差异性
四大类动物耐药率差异明显,草食动物耐药率最低,多重耐药菌株也最少,杂食动物、禽类动物其次,肉食动物耐药率最高,多重耐药也最严重,产生这一种属差异的原因推测有二。第一,与用药方式有关。口服抗菌药物会对草食动物瘤胃内微生物群落的发育、繁殖有强烈的抑制作用,可造成严重的消化机能障碍,因此草食动物抗菌药物的使用均为个体抗感染治疗,也很少选用广谱抗生素,群体抗菌药物的使用量明显低于其他种属动物。其二,推测与饮食结构有关。草食动物食物组成主要以牧草为主,还有少量果蔬和精饲料组成,在这些食物样本检测中均未分离出耐药菌株。肉食动物,包括以肉类为主食的秃鹫(Aegypiusmonachus)、兀鹫(Gypsfulvus)等猛禽,对7大类抗菌药物都表现出较高的耐药性,且与主要食物肉块中分离出的耐药菌株的耐药表型和耐药基因型相近。值得注意的是,对耐药菌的基因型检测发现,酰胺醇类耐药基因中介导氟苯尼考耐药的floR基因检出率达45.5%,但这类药物并未用于肉食动物的抗感染治疗。
如何防范圈养野生动物细菌耐药性的进一步发展值得深思,合理使用抗菌药物是减少耐药菌株的有效措施,临床治疗时不能经验性选药,要明确感染病原菌类型,有针对性地进行治疗,要重视药物敏感性检测,提升药物使用效率。其次还要加强食物检测力度,特别是容易携带耐药菌的肉类产品,以减少耐药基因的产生以及诱导产生的条件,从而改善圈养野生动物细菌性耐药现状。
