下调Smad1基因抑制RA-FLS侵袭和迁移
2020-10-26楚天舒邵凤民
王 培 楚天舒 阎 磊 刘 冰 朱 清 邵凤民
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性系统性自身免疫性疾病[1]。随着RA病情发展,关节软骨和骨可能遭到破坏,最终引发关节畸形及功能丧失,导致患者生活质量下降,给家庭和社会造成较大的经济负担[2]。滑膜成纤维细胞(fibroblast-like synoviocytes,FLS)是滑膜衬里层细胞,RA的发生、发展与FLS侵袭和迁移密切相关。有研究表明,RA患者滑膜组织中的FLS可以通过产生大量的基质金属蛋白酶(matrix metalloproteinases,MMPs),通过降解细胞外基质中的成分促进上皮间质转化(epithelial-mesenchymal transition,EMT)等过程,增强滑膜成纤维细胞的迁移和侵袭能力,进而加速RA疾病的进展[3,4]。E-cadherin属于跨膜蛋白,对维持上皮结构和极性方面具有重要作用,在EMT发生过程中上皮型标志蛋白E-cadherin的表达下调,而间质型标志蛋白α-SMA、vimentin的表达上调。Smad1基因属于Smads家族成员之一,参与细胞信号转导。多项研究表明,Smad1与晚期癌症分期和转移密切相关[5,6]。多项研究表明,Smad1与多种肿瘤细胞侵袭和转移密切相关,包括肝癌、头颈部鳞状细胞癌等[7,8]。Zhang等[9]研究表明,RA患者滑膜组织和FLS中Smad1的表达水平明显上调。然而,Smad1是否可对滑膜成纤维细胞的侵袭及迁移能力产生影响及其在RA发生和进展中的作用尚未见报道。本研究通过在RA-FLS(MH7A细胞)中转染Smad1小干扰RNA(small interfering RNA,siRNA),观察敲减Smad1对MH7A细胞侵袭和迁移的影响及可能的作用机制。
材料与方法
1.材料:人类风湿关节炎滑膜成纤维细胞(MH7A细胞)购自日本Riken生物资源中心;胎牛血清购自美国Gibco公司;DMEM培养基、胰蛋白酶均购自美国Hyclone公司;实验所用引物购自上海生工生物工程有限公司;Smad1 siRNA序列(正向引物:5′-AAUACUUUGCUACUUACACAU-3′;反向引物:5′-GUGUAAGUAGCAAAGUAUUUG-3′)及对照序列(正向引物:5′-UUCUCCGAACGUGUCACGUTT-3′;反向引物:5′-ACGUGACACGUUCGGAGAATT-3′)均购自上海吉玛制药技术有限公司; Trizol试剂及Lipofectamine 2000转染试剂购自美国Invitrogen公司;反转录试剂盒购自日本TaKaRa公司;2×SYBR Green Master Mix试剂盒购自北京中科瑞泰生物科技有限公司;Matrigel基质胶购自美国BD公司;RIPA细胞裂解液、BCA蛋白浓度测定试剂盒、结晶紫购自上海碧云天生物技术有限公司;E-cadherin抗体、vimentin抗体、α-SMA抗体、Smad1抗体、GAPDH抗体及辣根过氧化物酶标记的二抗购自美国Cell Signal公司;MMP-3抗体和MMP-13抗体购自北京中杉金桥生物技术有限公司;Transwell小室购自美国Corning公司。
2.细胞培养:MH7A细胞培养在含10%灭活的胎牛血清的DMEM培养基中,放置在37℃、5%CO2及饱和湿度的培养箱中常规培养,隔天换液,待细胞贴壁后进行传代,取对数生长期的MH7A细胞进行后续实验。
3.细胞转染和分组:提前1天将对数增殖期的MH7A细胞种植到6孔板中,种植密度为4×105个/孔,在37℃培养箱中继续培养,待细胞生长融合度约60%时进行转染,设置转染组(转染Smad1 siRNA序列的MH7A细胞),阴性对照组(转染对照siRNA序列的MH7A细胞),同时设置空白对照组(不做转染处理的MH7A细胞),具体转染步骤参照Lipofectamine 2000转染试剂说明书进行。将转染后各组细胞置于37℃、CO2培养箱中继续培养。
4.qRT-PCR检测Smad1基因mRNA表达情况:分别收集转染48h后转染组、阴性对照组和空白对照组MH7A细胞,Trizol法提取总RNA,检测RNA的浓度和纯度,使用反转录试剂盒合成cDNA。以cDNA为模板,使用2×SYBR Green Master Mix试剂盒进行PCR扩增。反应体系采用20μl,以GAPDH为内参,每个样品设置3个重复。Smad1 正向引物:5′-TTGATGTGCTTTGTGTGCCC-3′;反向引物:5′-CCACAGCAAAATTCCGCCAG-3′;GAPDH 正向引物:5′-AAGGGCCCTGACAACT-CTTT-3′;反向引物:5′-CTCCCCTCTTCAAGGGGTCT-3′。反应程序:94℃ 5min;94℃ 30s,60℃ 30s,72℃ 15s,40个循环。以相对定量法2-ΔΔCt分析各组MH7A细胞中Smad1基因mRNA相对表达水平。实验重复3次,取平均值。
5.Western blot法检测Smad1蛋白表达情况:分别收集转染48h后的各组MH7A细胞,加入RIPA细胞裂解液在冰上裂解细胞提取蛋白。BCA法测定蛋白浓度,取30μg变性蛋白行12%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,将分离的蛋白电转至硝酸纤维素膜上,随后封闭。分别加入1∶500稀释的Smad1一抗和1∶8000稀释的GAPDH一抗,4℃过夜杂交。TBST洗膜,加入1∶5000稀释的二抗,室温孵育1h。TBST洗膜3次,显色,转移至暗室曝光,标准化数值以Smad1条带和GAPDH内参条带的比值确定,用凝胶成像系统采集图像,用Image J软件对图像统计分析,计算各组MH7A细胞中Smad1蛋白相对表达水平。实验重复3次,取平均值。
6.Transwell实验检测MH7A细胞侵袭和迁移能力:分别取处于对数生长期的各组MH7A细胞,以不含血清的DMEM培养基饥饿处理12h,收集细胞并制成1×106/ml的细胞悬液,取200μl细胞悬液接种于孔径为8μm的Transwell小室的上室,在下室加入600μl含10%胎牛血清的DMEM培养基,于37℃培养箱中继续培养24h。取出Transwell小室,擦去上室未穿膜的细胞,以4%多聚甲醛固定20min,结晶紫中染色10min,洗去染液,风干,在显微镜下随机选取5个视野观察并计数迁移细胞数,实验重复3次。Transwell细胞侵袭实验与细胞迁移实验不同之处在于Transwell小室的上室预先以100mg/L的Matrigel基质胶包被,其余步骤相同。
7.Western blot法检测E-cadherin、vimentin、α-SMA、MMP-3和MMP-13蛋白表达情况:E-cadherin、vimentin、α-SMA、MMP-3和MMP-13一抗均以1∶1000稀释,其余步骤同材料与方法5。
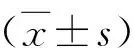
结 果
1.转染Smad1 siRNA对MH7A细胞Smad1表达的影响:转染48h后,qRT-PCR和Western blot法实验结果显示,与阴性对照组比较,转染Smad1 siRNA的MH7A细胞中Smad1的mRNA和蛋白表达显著降低(P<0.05);空白对照组和阴性对照组间比较,差异无统计学意义(P>0.05),详见图1和表1。

图1 各组MH7A细胞中Smad1 mRNA和蛋白表达量A.Smad1 mRNA表达量;B.Smad1蛋白表达量;与阴性对照组比较,*P<0.05

表1 各组MH7A细胞中Smad1 mRNA和蛋白表达量比较
2.抑制Smad1对MH7A细胞EMT的影响:Western blot法检测结果显示,与阴性对照组比较,转染组MH7A细胞中vimentin和α-SMA表达水平均下调(P<0.05), E-cadherin的表达水平上调(P<0.05);而空白对照组和阴性对照组间各蛋白表达量比较,差异无统计学意义(P>0.05),详见图2和表2。
3.抑制Smad1的表达对MH7A细胞侵袭和迁移的影响:Transwell实验检测结果显示,与阴性对照组比较,转染组侵袭和迁移细胞数明显减少(P<0.05);而空白对照组和阴性对照组间侵袭和迁移细胞数比较,差异无统计学意义(P>0.05),详见图3和表3。

图2 Western blot法检测各组MH7A细胞中E-cadherin、vimentin和α-SMA的表达

表2 抑制Smad1基因对MH7A细胞EMT的影响
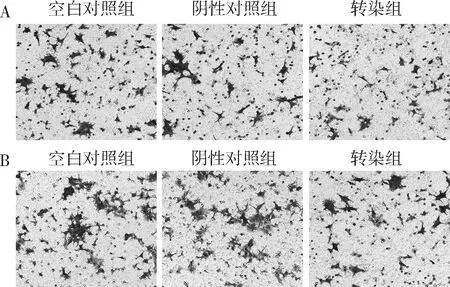
图3 Transwell实验检测MH7A细胞A.侵袭能力;B.迁移能力

表3 抑制Smad1基因对MH7A细胞侵袭和迁移能力的影响
4.抑制Smad1的表达对MH7A细胞中MMP-3和MMP-13表达影响:Western blot法检测结果显示,与阴性对照组比较,转染组MH7A细胞中MMP-3和MMP-13的表达明显下调(P<0.05);而空白对照组和阴性对照组细胞中MMP-3和MMP-13的表达比较,差异无统计学意义(P>0.05),详见图4和表4。

图4 各组MH7A细胞中MMP-3和MMP-13的表达

表4 抑制Smad1基因对MH7A细胞中MMP-3和MMP-13表达的影响
讨 论
RA是一种全身自身免疫性疾病,长期以来,普遍认为T细胞和其他免疫细胞及其细胞因子在RA的发生和发展中起关键作用[10]。然而,近年来,从RA患者中分离的滑膜成纤维细胞的多项研究对这一概念提出了强烈的质疑[11]。国内外研究者从信号通路、细胞凋亡、细胞侵袭和迁移等多个方面研究了滑膜成纤维细胞,结果显示滑膜成纤维细胞在发育过程中起主导作用[12~14]。Smads蛋白是生物体内转化生长因子β1(transforming growth factor-β1,TGF-β1)信号转导和调节的重要因子,当Smads表达异常时会影响TGF-β1信号转导,导致疾病的发生[15]。Smad1是Smads蛋白家族重要成员之一,Chen等[16]的研究指出miR-345可通过靶向下调Smad1蛋白来抑制前列腺癌细胞的增殖、迁移和侵袭。目前,关于Smad1是否可以抑制滑膜成纤维细胞的侵袭及迁移,进而阐述其在RA发生、发展中的作用研究较少。本研究通过在MH7A细胞中转染Smad1 siRNA抑制Smad1基因的表达,通过Transwell实验发现,抑制Smad1的表达后MH7A细胞侵袭和迁移能力均明显受到抑制,Yong等[7]研究也表明,抑制Smad1蛋白的表达可以抑制肝癌细胞的侵袭和迁移。
本研究还发现Smad1基因表达的抑制可以下调MH7A细胞中MMP-3和MMP-13蛋白的表达。MMPs蛋白质是一系列酶,其降解细胞外基质的所有组分,可增强细胞的迁移和侵袭[17]。其中,MMP-3和MMP-13是RA滑膜组织中两种高表达蛋白[18]。MMP-3可以切割E-cadherin的生物活性片段,促进上皮细胞溶解和释放,促进EMT的发生,诱导细胞运动,在骨的破坏和软骨各种组分的降解中起关键作用;MMP-13促进RA的骨质破坏[19]。本研究通过Western blot法检测各组MH7A细胞中EMT标志物E-cadherin、vimentin和α-SMA的表达水平,结果显示,抑制Smad1的表达可下调vimentin和α-SMA的表达,上调E-cadherin的表达,抑制EMT的发生。多项研究表明,EMT过程是肿瘤发生侵袭和转移的关键步骤,同样可能影响RA侵袭和迁移过程[20,21]。Xiong等[22]发现RA患者滑膜成纤维细胞中miR-21表达的抑制可通过TGF-β1/Smad4/7信号通路抑制MMPs蛋白的表达,从而降低滑膜成纤维细胞的侵袭力。结合本研究结果,干扰Smad1基因后MH7A细胞中MMP-3和MMP-13表达降低,推测Smad1基因在RA滑膜组织中的高表达可能通过上调MMP-3和MMP-13蛋白的表达,促进EMT过程,从而促进滑膜成纤维细胞的侵袭和迁移能力。
综上所述,抑制Smad1基因表达后,MH7A细胞中侵袭和迁移能力显著减弱,其作用机制可能与下调细胞中MMP-3、MMP-13蛋白表达进而阻碍EMT过程有关。然而,Smad1基因通过调控MMPs的表达影响EMT过程,而EMT进一步对RA-FLS侵袭和迁移影响的机制需进一步探究,后续将在RA动物模型中进行深入探究。随着Smad1基因的深入探究,其可能成为类风湿关节炎基因治疗的作用靶点。
