黄芪多糖对高氧致新生大鼠支气管肺发育不良mir-34a/sirt1 轴的影响
2020-10-25丁波李智敏黄建玲
丁波,李智敏,黄建玲
支气管肺发育不良(Bronchopulmonary Dysplasia,BPD)是早产儿的一种慢性肺部疾病,肺发育不成熟是该病主要原因之一,肺功能受阻早产儿一般会置于氧环境中一定时间,但置于高氧环境中氧产生的毒素会直接损伤肺部[1]。研究发现,微小RNA-34a(microRNA-34a,mir-34a)/沉默信息调节因子 1(silent information regulator 1,sirt1)轴中 mir-34a 上调可抑制sirt1 蛋白的表达从而加快脑内炎症反应[2],上调mir-34a可促进过氧化氢引起的细胞氧化应激损伤,下调mir-34a可减缓氧化应激损伤[3]。黄芪多糖(Astragalus Polysaccharide,APS)是中药黄芪主要活性成分之一,具有抗炎、抗氧化药理作用,可降低溃烂性结肠炎中炎性因子水平从而治疗溃烂性结肠炎[4],还可提高仔猪抗氧化能力改善疾病状况[5],但其对BPD大鼠肺损伤的作用尚未发现报道。本研究通过构建BPD模型,观察APS对BPD大鼠肺组织中炎症反应、氧化应激反应的影响并探讨其作用机制,旨在揭示其保护BPD 大鼠肺损伤的分子机制。
黄芪多糖对高氧致新生大鼠支气管肺发育不良mir-34a/sirt1 轴的影响

图1 大鼠建模后肺组织形态学变化(HE×200) 图2 免疫组化法检测大鼠建模10、17 d肺组织中沉默信息调节因子1(sirt1)表达比较(HE×400)
1 材料与方法
1.1 一般材料
1.1.1实验动物 将2018年1月至2019年1月参加实验的健康SD大鼠由广州医科大学实验动物中心提供,许可证号:SYXK(粤)-2016-0143,清洁级,出生3 d体质量(9.45±0.25)g。实验动物中心温度(25±1)℃、湿度(60±10)%、12 h 黑暗12 h 光照常规饲养大鼠。所有实验均经本院动物实验伦理委员会批准。
1.1.2试剂与仪器 APS由天津华隆医药保健品有限公司提供,批准文号:Z20040085。苏木素-伊红(HE)染色试剂盒由武汉百浩天生物科技有限公司提供,货号:C0490。大鼠白介素-6(IL-6)、白介素-10(IL-10)、肿瘤坏死因子-α(TNF-α)酶联免疫吸附(ELISA)试剂盒由碧云天生物科技有限公司提供,货号分别为:PI326、PI522、PT516。超氧化物歧化酶(SOD)、丙二醛(MDA)ELISA 检测试剂盒由上海纪宁实业有限公司提供,货号分别为:N01762、N06457。一抗sirt1(抗鼠)、内参GADPH(抗鼠)、二抗羊抗鼠由英国abcam 公司提供,货号分别为:ab110304、ab8245、ab150117。RNAisoPlus、cDNA 逆转录试剂盒、2×HiSYBR Green QPCR Mix 由日本Ta-KaRa 公司提供,货号分别为:9108、DRR037A、ARR041A。蛋白裂解液由北京索莱宝科技有限公司提供,货号:R0010。脱脂奶粉由美国BD 公司提供,货号:232100。DAB 显色试剂由上海生工生物工程有限公司提供,货号:PW017。氧箱由美国Shellab 公司提供,切片机由德国Leica 公司提供,光学显微镜由日本Olympus 公司提供,实时荧光定量PCR(quantitative real-time polymerase chain reaction,qRT-PCR)仪由美国ABI公司提供,蛋白凝胶成像仪由上海Tanon公司提供。
1.2 方法
1.2.1动物造模 参照文献中方法建模[6]。将64只出生后3 d SD 大鼠按照随机数字表法分为空白对照组(NC 组)、APS 对照组(APS 组)、高氧诱导BPD 模型组(BPD 组)、APS 治疗 BPD 组(BPD+APS组),每组16 只。NC 组、APS 组大鼠暴露在空气中常规饲养;BPD组、BPD+APS组大鼠置于氧箱中,氧浓度维持在(70±5)%,同时吸收氧箱二氧化碳和水蒸气保持氧箱中压力恒定,其余条件与NC 组、APS组相同。24 h 后APS 组和BPD+APS 组腹腔注射100 mg·kg-1·d-1APS,注射体积100 µL,剂量参考文献[7],NC 组和BPD 组腹腔注射同体积生理盐水,直至大鼠处死。
1.2.2大鼠体质量变化 建模10 d 每组大鼠随机抽取8 只,腹腔注射麻醉大鼠称量体质量。建模17 d再次称量。
1.2.3HE 染色观察肺组织形态学变化 大鼠称完体质量后立即处死大鼠,打开胸腔,部分肺组织置于4%多聚甲醛中做HE染色和免疫组化实验,部分肺组织置于4 ℃冰箱做ELISA实验,部分置于-80 ℃冰箱做qRT-PCR 和蛋白免疫印迹(Western blot)实验。固定于4%多聚甲醛中的肺组织过夜后,转至不同浓度乙醇中脱水,二甲苯中透明,石蜡中包埋、冷冻凝固后在切片机上切片。切片制作完成后经脱蜡、复水、染色,再脱水、透明、封片完成HE染色,光学显微镜拍照。
1.2.4ELISA检测 大鼠肺组织中IL-6、IL-10、TNF-α、MDA水平和SOD活性置于4 ℃冰箱肺组织在收样6 h内冰上组织匀浆,5 000 r/min 离心5 min,收集上清液分装置于-20 ℃中待测。严格按照大鼠IL-6、IL-10、TNF-α、SOD、MDA ELISA试剂盒说明书步骤操作。
1.2.5qRT-PCR 检测 大鼠肺组织中mir-34a 水平-80 ℃超低温冰箱中每个样品取50 mg 组织,RNAisoPlus 提取肺组织总RNA,cDNA 逆转录试剂盒反转录cDNA,qRT-PCR 仪对mir-34a、内参 U6 扩增。引物序列:mir-34a-F:5’-TGGCAGTGTCTTAGCTGGTTGT-3’,mir-34a-R:5’-GTCGTATCCAGTGCGTGTCGTG-3’;U6-F:5’-GCTTCGGCAGCACATATACTA-3’,U6-R:5’-CGCTTCACGAATTTGCGTGTC-3’。上样体系:cDNA 1 µL(50 ng/µL),F/R(10 µM)各0.5 µL,2×Mix 10 µL,双蒸水(ddH2O)8.0 µL。反应条件:95 ℃、10 min;95 ℃、15 s,60 ℃、60 s,45个循环。2-ΔΔCT法计算肺组织中mir-34a表达水平。
1.2.6免疫组化检测 大鼠肺组织中sirt1 表达水平变化制作好的切片按1.2.3中HE染色相同方法脱蜡、复水,滴加过氧化氢灭火内源性过氧化氢酶,热修复抗原并加磷酸缓冲液冲洗,5%脱脂奶粉封片20 min,滴加一抗sirt1(1∶1 000)[阴性对照用同型同种鼠免疫球蛋白G(IgG)代替一抗]2 h,滴加二抗20 min后二氨基联苯胺(DAB)显色,苏木素复染核,盐酸酒精分色,脱水、透明、封片。光学显微镜拍照。免疫组化结果鉴定:胞质中出现黄色或棕色颗粒为阳性。阳性评分由两位病理科医师协商判断。阳性率0%~5%为阴性,6%~10%为弱阳性,11%~25%为阳性,>26%为强阳性。
1.2.7蛋白质印迹法检测 大鼠肺组织中sirt1 蛋白水平-80 ℃超低温冰箱中每个样品取30 mg 肺组织,使用高压灭菌过的手术剪剪碎后,在冰上研磨,每管加1 mL 蛋白裂解液冰上裂解30 min,组织匀浆液10 000 g离心5 min,上清液即为肺组织总蛋白。蛋白定量后聚丙烯酰胺凝胶电泳(PAGE)分离蛋白质,聚偏二氟乙烯(PVDF)膜280 mA 60 min 转膜;5%脱脂奶粉室温封闭2 h;对应加入一抗sirt1(1∶10 000)、甘油醛-3-磷酸脱氢酶(GADPH)(1∶5 000)4℃孵育过夜;对应加入二抗,室温孵育1 h。DAB显色试剂显色,蛋白凝胶成像仪拍照和定量分析。
1.3 统计学方法SPSS 22.0软件进行统计学分析,计量数据均用±s表示,组内比较用单因素方差分析,组间两两比较采用SNK-q法。P<0.05差异有统计学意义。
2 结果
2.1 体质量变化NC 组与 APS 组建模 10、17 d 体质量差异无统计学意义(P>0.05)。与NC 组、APS组对比,BPD组建模10、17 d体质量降低(P<0.05)。与 BPD 组相比,BPD+APS 组建模 17 d 体质量增加(P<0.05)。见表1。
表1 SD大鼠64只建模10、17 d体质量变化/(g,±s)

表1 SD大鼠64只建模10、17 d体质量变化/(g,±s)
注:NC组为空白对照组,APS组为黄芪多糖对照组,BPD组为高氧诱导支气管肺发育不良模型组,BPD+APS组为黄芪多糖治疗支气管肺发育不良组。与NC组相比,aP<0.05;与APS组相比,bP<0.05;与BPD组相比,cP<0.05
组别NC 组APS 组BPD 组BPD+APS 组F 值P 值鼠数16 16 16 16体质量建模10 d 22.17±3.41 22.21±3.19 17.46±2.66ab 20.17±4.32 3.380 0.032建模17 d 50.27±4.65 48.79±4.99 35.75±2.85ab 42.66±3.71c 20.516 0.000
2.2 大鼠肺组织形态学变化建模10、14 d,NC 组与APS 组大鼠肺组织气管和各级支气管结构完整,肺泡排列整齐,无间隔破坏,无炎症细胞浸润现象。BPD 组肺组织结构不完整,肺泡数量减少、体积增大,结构简单化,炎症现象明显。BPD+APS 组肺组织结构较完整,肺泡发育较好,大小均匀,间隔较均匀,炎症细胞浸润现象减少,肺泡结构接近NC组和APS组。见图1。
2.3 大鼠肺组织中IL-6、IL-10、TNF-α 水平变化建模10、17 d,NC 组和APS 组肺组织中IL-6、IL-10、TNF-α 表达差异无统计学意义(P>0.05)。与NC组、APS组相比,BPD组建模10、17 d肺组织中IL-6、TNF-α 表达升高,IL-10 表达降低(P<0.05);BPD+APS组建模10 d肺组织中IL-10表达降低,TNF-α表达升高(P<0.05)。与BPD 组相比,BPD+APS 组建模10、17 d肺组织中IL-6、TNF-α表达降低,IL-10表达升高(P<0.05)。见表2。
表2 SD大鼠64只建模后肺组织中IL-6、IL-10、TNF-α水平比较/(ng/L,±s)

表2 SD大鼠64只建模后肺组织中IL-6、IL-10、TNF-α水平比较/(ng/L,±s)
注:NC组为空白对照组,APS组为黄芪多糖对照组,BPD组为高氧诱导支气管肺发育不良模型组,BPD+APS组为黄芪多糖治疗支气管肺发育不良组,IL-6为白介素-6,IL-10为白介素-10,TNF-α为肿瘤坏死因子-α。与NC组相比,aP<0.05;与APS组相比,bP<0.05;与BPD组相比,cP<0.05
组别NC 组APS 组BPD 组BPD+APS 组F 值P 值鼠数16 16 16 16 IL-6建模10 d 143.62±44.62 144.37±48.31 211.32±47.68ab 159.66±39.17c 4.009 0.017建模17 d 137.82±39.21 143.66±42.02 218.66±48.04ab 152.22±31.08c 6.848 0.001 IL-10建模10 d 9.66±2.17 9.43±1.89 3.71±0.67ab 6.67±1.17abc 24.688 0.000建模17 d 9.17±1.75 9.19±1.66 3.42±0.53ab 8.17±1.25c 31.659 0.000 TNF-α建模10 d 276.65±66.05 274.18±57.15 496.52±81.91ab 357.77±65.31abc 18.721 0.000建模17 d 274.69±62.17 285.66±56.85 537.88±64.06ab 317.66±73.22c 29.686 0.000
2.4 大鼠肺组织中SOD 活性和MDA 水平建模10、17 d,NC 组和 APS 组肺组织中 SOD 活性和MDA水平表达差异无统计学意义(P>0.05)。与NC 组、APS组相比,BPD组建模10、17 d肺组织中SOD活性降低,MDA 表达升高(P<0.05);BPD+APS 组建模10 d 肺组织中 SOD 活性降低,MDA 表达升高,建模17 d 肺组织中SOD 活性降低(P<0.05)。与BPD 组相比,BPD+APS 组建模 10 d 肺组织中 SOD 活性升高,建模 17 d 肺组织中 SOD 活性升高,MDA 表达降低(P<0.05)。见表3。
表3 SD大鼠64只建模肺组织中SOD活性和MDA水平比较/±s

表3 SD大鼠64只建模肺组织中SOD活性和MDA水平比较/±s
注:NC组为空白对照组,APS组为黄芪多糖对照组,BPD组为高氧诱导支气管肺发育不良模型组,BPD+APS组为黄芪多糖治疗支气管肺发育不良组,SOD为超氧化物歧化酶,MDA为丙二醛。与NC组相比,aP<0.05;与APS组相比,bP<0.05;与BPD组相比,cP<0.05
组别NC 组APS 组BPD 组BPD+APS 组F 值P 值例数16 16 16 16 SOD/(U/mg)建模10 d 21.25±3.79 20.96±3.50 11.64±1.94ab 14.32±2.54abc 20.172 0.000建模17 d 23.66±4.05 22.18±4.18 8.96±1.95ab 16.95±3.45abc 28.467 0.000 MDA/(µmol/g)建模10 d 2.32±0.76 2.28±0.64 4.17±1.05ab 3.57±0.59ab 11.576 0.000建模17 d 2.39±0.81 2.47±0.56 4.32±0.95ab 2.86±0.71c 10.839 0.000
2.5 大鼠肺组织中mir-34a 表达水平变化建模10、17 d,NC 组与 APS 组肺组织中 mir-34a 差异无统计学意义(P>0.05)。与 NC 组、APS 组相比,BPD组、BPD+APS 组肺组织中 mir-34a 表达升高(P<0.05);与BPD组相比,BPD+APS组肺组织中mir-34a表达降低(P<0.05)。见表4。
表4 SD大鼠64只建模10、17 d肺组织中mir-34a表达水平比较/±s

表4 SD大鼠64只建模10、17 d肺组织中mir-34a表达水平比较/±s
注:NC组为空白对照组,APS组为黄芪多糖对照组,BPD组为高氧诱导支气管肺发育不良模型组,BPD+APS组为黄芪多糖治疗支气管肺发育不良组,mir-34a为微小RNA-34a。与NC组相比,aP<0.05;与APS组相比,bP<0.05;与BPD组相比,cP<0.05
组别NC 组APS 组BPD 组BPD+APS 组F 值P 值例数16 16 16 16 mir-34a建模10 d 1.00±0.12 1.01±0.15 2.38±0.47ab 1.62±0.38abc 33.917 0.000建模17 d 1.08±0.11 1.11±0.13 2.28±0.55ab 1.49±0.29abc 24.038 0.000
2.6 免疫组化法检测大鼠肺组织中sirt1 表达水平变化棕色代表sirt1 阳性,蛋白定位于细胞质。NC组与APS组在建模10、14 d sirt1蛋白阳性表达率差异无统计学意义(P>0.05)。与NC 组、APS 组相比,建模10、14 d BPD组sirt1蛋白阳性表达率降低,BPD+APS 组sirt1 蛋白阳性表达率升高(P<0.05)。与 BPD 组相比,BPD+APS 组建模 10、14 d sirt1 蛋白阳性表达率升高(P<0.05)。见图2、表5。
表5 SD大鼠64只建模10、17 d肺组织中sirt1阳性表达率比较/(%,±s)
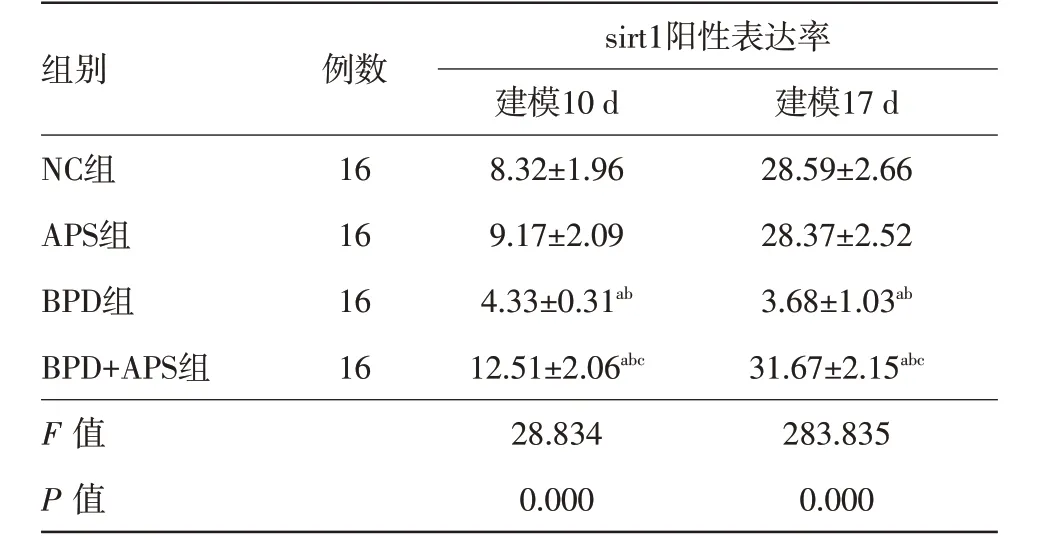
表5 SD大鼠64只建模10、17 d肺组织中sirt1阳性表达率比较/(%,±s)
注:NC组为空白对照组,APS组为黄芪多糖对照组,BPD组为高氧诱导支气管肺发育不良模型组,BPD+APS组为黄芪多糖治疗支气管肺发育不良组,sirt1 为沉默信息调节因子1。与NC 组相比,aP<0.05;与APS组相比,bP<0.05;与BPD组相比,cP<0.05
组别NC组APS组BPD组BPD+APS组F 值P 值例数16 16 16 16 sirt1阳性表达率建模10 d 8.32±1.96 9.17±2.09 4.33±0.31ab 12.51±2.06abc 28.834 0.000建模17 d 28.59±2.66 28.37±2.52 3.68±1.03ab 31.67±2.15abc 283.835 0.000
2.7 蛋白质印迹法检测大鼠肺组织中sirt1 表达水平变化NC组和APS组建模10、14 d肺组织中sirt1蛋白表达差异无统计学意义(P>0.05)。与NC 组、APS组相比,BPD组建模10、14 d sirt1蛋白表达降低(P<0.05)。与 BPD 组相比,BPD+APS 组建模 10、14 d sirt1蛋白表达升高(P<0.05)。见图3、表6。

图3 蛋白质印迹法检测大鼠建模后肺组织中沉默信息调节因子1(sirt1)蛋白表达水平比较
表6 SD大鼠64只建模后肺组织中sirt1蛋白表达水平比较/±s

表6 SD大鼠64只建模后肺组织中sirt1蛋白表达水平比较/±s
注:NC组为空白对照组,APS组为黄芪多糖对照组,BPD组为高氧诱导支气管肺发育不良模型组,BPD+APS组为黄芪多糖治疗支气管肺发育不良组,sirt1 为沉默信息调节因子1。与NC 组相比,aP<0.05;与APS组相比,bP<0.05;与BPD组相比,cP<0.05
组别NC 组APS 组BPD 组BPD+APS 组F 值P 值例数16 16 16 16 sirt1建模10 d 1.01±0.25 1.09±0.26 0.11±0.06ab 0.94±0.14c 43.368 0.000建模17 d 0.98±0.24 1.11±0.23 0.15±0.05ab 1.02±0.18c 43.906 0.000
3 讨论
BPD 多发生于早产儿,早产儿出生时体质量低、对氧的依赖性强,目前炎症反应、氧化应激、宫内感染、气压伤等均会导致肺组织损伤和修复异常[8]。研究发现早产儿吸入高浓度氧时会增强肺组织炎症,同时肺组织中出现大量的氧自由基,最终形成BPD[9],目前尚无确切有效的治疗方法。APS是豆科多年生草本植物蒙古黄芪或膜荚黄芪的干燥根中经提炼、浓缩制成的,是黄芪的主要活性成分之一,具有抗氧化、抗应激、抗衰老、抗肿瘤等作用,在BPD大鼠中可减缓炎症水平从而改善BPD病理状态[10]。本研究发现,建模10、17 d,APS组与NC组结果类似,体质量并未减轻,肺组织气管和各级支气管结构完整,肺泡排列整齐,无间隔破坏,无炎症细胞浸润现象,提示APS 对大鼠安全。建模10、17 d,与 APS 组与 NC 组比较,BPD 组大鼠体质量减轻,肺组织肺泡数量减少、体积增大,结构简单化,炎症现象明显,提示高氧可导致新生大鼠体质量减轻、肺组织结构破坏,表明BPD 大鼠造模成功。与BPD 组比较,BPD+APS 组大鼠体质量增加,肺组织肺泡发育较好,大小均匀,间隔较均匀,炎症细胞浸润现象减少,与 NC 组和 APS 组类似,提示 APS 可缓解BPD造成的大鼠体质量减轻、肺组织结构损伤症状,但具体作用机制尚不清楚。
炎性因子是参与炎症反应的细胞因子,其水平反映机体炎症水平。在炎症反应中,IL-6 能诱导急性炎症反应、IL-10有抗炎作用、TNF-α是出现最早、最重要的炎症介质[11]。研究显示,机械通气可致小鼠肺损伤支气管肺泡灌洗液中IL-6、TNF-α 水平升高、IL-10 水平降低,加快肺损伤[12]。本研究发现建模 10、17 d,NC 组和 APS 组肺组织中 IL-6、IL-10、TNF-α 表达差异无统计学意义,提示APS 本身不会增强正常大鼠肺组织炎症反应。与NC组、APS组相比,BPD 组建模10、17 d 肺组织中IL-6、TNF-α 表达升高,IL-10表达降低,提示高氧诱导BPD 可提高大鼠肺组织中促炎因子、炎症介质水平,降低抗炎因子水平从而增强机体炎症反应。与BPD 组相比,BPD+APS组建模10、17 d肺组织中IL-6、TNF-α表达降低,IL-10 表达升高,提示APS 治疗可减缓BPD 诱导的大鼠肺组织炎症反应增强现象,减缓疾病进程。
SOD 活性和MDA 水平是最常见的两种氧化应激指标,其水平反映机体氧化应激水平,氧化应激指体内氧化与抗氧化作用失衡,倾向于氧化,导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,是导致疾病的一个重要因素[13]。SOD 是自由基清除酶,反映抗氧化水平,具有抗炎能力;MDA 是过氧化反应产物,可反应过氧化水平[14]。机械通气致小鼠肺损伤支气管肺泡灌洗液中SOD活性下降、MDA水平升高增强肺损伤[15]。本研究发现建模 10、17 d,NC 组和 APS 组肺组织中SOD活性和MDA水平表达差异无统计学意义,提示APS 不影响正常大鼠肺组织中氧化应激反应。与NC 组、APS 组相比,BPD 组建模 10、17 d 肺组织中SOD 活性降低,MDA 表达升高,提示 BPD 会使机体抗氧化能力降低,氧化水平升高,机体氧化应激反应增强。与BPD组相比,BPD+APS组建模10 d肺组织中SOD活性升高,建模17 d肺组织中SOD活性升高,MDA 表达降低,提示 APS 可缓解 BPD 诱导的氧化应激反应增强现象,缓解疾病进程。
miRNA是一种小分子非编码RNA,活性与其靶基因结合性关系紧密,根据靶基因序列不同,其功能亦差别很大[16]。miR-34a在各种真核生物中广泛存在,被认为是一种抑癌基因,可作用多个靶基因[17];sirt1 是一种去乙酰化酶,是 mir-34a 的直接靶基因[18],研究发现sirt1可作为独立影响机制减弱炎症反应、改善氧化应激及线粒体等功能障碍水平[19]。缺氧引起心肌细胞损伤会导致mir-34a上调、sirt1下调,从而加速心肌损伤;复氧后mir-34a下调、sirt1 上调可保护心肌细胞[20]。本研究发现,建模10、17 d,NC组与APS组肺组织中mir-34a、sirt1差异无统计学意义,提示APS 不影响正常大鼠肺组织中mir-34a/sirt1轴水平。与NC组、APS组相比,BPD组mir-34a 表达升高、sirt1 表达降低,提示 BPD 可诱导mir-34a表达升高作用靶基因sirt1降低表达水平,促使炎症反应加剧、氧化应激水平升高。与BPD组相比,BPD+APS 组肺组织中mir-34a表达降低、sirt1表达升高,提示APS 可减缓BPD 诱导的mir-34a 升高、sirt1降低现象,降低mir-34a表达、升高sirt1表达,减弱炎症反应、改善氧化应激,实现对BPD 大鼠肺损伤的保护作用。
综上所述,APS可能通过抑制mir-34a表达促使其靶基因sirt1 上调,从而减缓炎症反应、改善氧化应激状态,减轻肺组织损伤,实现对BPD 大鼠肺组织的保护作用。
(本文图1,2见插图10-1)
