一例雉科鸟类跨属杂交及其亲本物种的鉴定
2020-10-25杜焓瑜匡高翔叶永红李广龙徐艳春
杜焓瑜 匡高翔 马 跃 叶永红 李 荣 李广龙 徐艳春,5*
(1.东北林业大学野生动物与自然保护地学院,哈尔滨,150040;2.重庆动物园,重庆,400050;3.国家林业和草原局野生动植物检测中心,哈尔滨,150040;4.国家林业和草原局林产工业规划设计院,北京,100010;5.国家林业和草原局野生动物保护与利用工程技术研究中心,哈尔滨,150040)
自然条件下近缘种之间的杂交较为普遍,据统计,16.4%的鸟类有杂交现象[1],近20%的鸡形目(Galliformes)鸟类可种间杂交[2]。杂交是打破物种界限的去分化过程,一方面可提高物种的遗传多样性和个体杂合度,减少有害基因的效应,促进适应性基因的水平传播,产生新的适应性性状,甚至可形成新的种化进程[3-4],但另一方面杂交也可能促进有害基因的跨种传播,带来繁殖障碍和远交衰退,造成个体不育和后代死亡,降低遗传多样性[5-6]。研究表明,在人工饲养条件下物种间杂交会变得更加容易,约21.1%的物种都可杂交[1],如白腹锦鸡(Chrysolophusamherstiae)和红腹锦鸡(C.pictus)、蓝孔雀(Pavocristatus)和绿孔雀(P.muticus)[7-8],甚至还可能发生跨属杂交[9-10],如红腹锦鸡和白冠长尾雉(Syrmaticusreevesii)[11]。动物园是人工饲养野生动物的场所,保存生物多样性是其核心使命之一[12]。因为杂交存在明显的双面效应,杂交后代的保护价值存在很多争议,通过种间杂交来达到保护的目的需慎重考虑,甚至不被提倡[3,13]。
雉科(Phasianidae)是鸡形目鸟类中最大的一科,中国雉科鸟类包括的属种约占世界的三分之一[11]。许多雉科鸟类由于羽衣华丽,姿态优美,颇受人们的喜爱;此外鸡形目鸟类适应性强,对笼舍环境和饲料要求低,饲养管理相对简单[14-15],是动物园展览的重要鸟类。近年来,越来越多的动物园开始采用大笼舍、大空间、高度丰容的环境进行多物种混合饲养和展出,形成了“鸟语林”“雉鸡苑”“百鸡园”“百鸟园”等具有品牌特色的展示方式。但混合展示同时也给遗传管理带来难度,不仅种内的婚配难以控制,而且还经常发生跨种交配。产生的杂交后代在外部形态上有时有着明显的双亲特征,如特殊羽毛类型、花纹样式等。但在亲本物种比较相似的情况下,或者经过多代杂交、回交后,杂交个体或其亲本物种则常常无法确证,从而妨碍对其后代的管理。因而,除了形态学方法之外,需要建立更加准确的杂交个体亲本的鉴定方法。
2019年,重庆动物园混合饲养的鸡形目鸟类中,发现1只自然交配繁殖的杂交个体(图1),据饲养繁殖记录显示,其2018年5月出壳,现已为成体。从其形态特征上初步推测亲本可能为环颈雉(Phasianuscolchicus)、蓝孔雀或贵妃鸡(Gallusgallusdomesticus)。本研究以此案例为对象,利用其形态学特征、线粒体基因和微卫星遗传标记建立一套鉴别杂交个体亲本的方法,为动物园散养模式下鸟类种群的遗传管理提供借鉴。

图1 饲养条件下鸡形目鸟类自然交配产生的杂交个体Fig.1 The hybrid phasianid produced by natural mating in captivity
1 材料与方法
1.1 形态学测量方法
本实验形态学测量样本均来自重庆动物园未知杂交个体的饲养笼舍,所选个体均为成体,其中贵妃鸡12只(6♂、6♀)、蓝孔雀12只(6♂、6♀)、环颈雉6只(3♂、3♀)、待鉴定杂交个体1只。
鸟类捕捉后,按照规程保定[16],用卡尺和卷尺测量记录9个形态学参数:体长(自喙尖到尾羽基部的长度);尾长(自尾羽基部至末端的直线距离);翅长(自翼角至翼尖的直线距离);喙长(即嘴峰长,自喙基与羽毛的交界处至上喙喙尖的直线距离);口裂长(自嘴峰到口裂后缘的直线距离);跗蹠长(胫跗骨与跗蹠骨之间的关节处至跗蹠骨与中间趾的关节处的距离);跗蹠前部鳞片数(自跗蹠基部到踝关节前面方形鳞片的数量);趾长(自爪基部到趾基部的直线距离);爪长(自爪端部到爪基部的直线距离);精确到mm。
1.2 分子遗传学鉴定
1.2.1 样品采集
从未知亲本杂交个体,6只贵妃鸡和11只蓝孔雀的胸部拔取廓羽1枚,分别编号为HY01、GF01—06和BP01—11,置于牛皮纸信封中,自然干燥,常温保存备用。后期为鉴定其核基因来源又采集蓝孔雀样本11只。本实验所有样品皆为羽毛样本。
1.2.2 DNA的提取
用灭菌的解剖剪剪取羽毛基部2 mm,置于1.5 mL离心管中剪碎,加入20 μL 1 mol/L DTT,295 μL TNE缓冲液(pH=8.0),35 μL 10% SDS溶液,20 μL蛋白酶K(10 mg/mL)56 ℃恒温消化过夜,直至羽根完全溶解。然后利用基因组DNA提取试剂盒(AxyPrep Biosciences,杭州)提取DNA。使用Nanodrop 2000c(Thermo Scientific,USA)核酸浓度测定仪测定所得DNA溶液的浓度,按照浓度将所有DNA样品稀释至20 ng/μL,置于-20 ℃保存备用。
1.2.3 性别鉴定
使用鸟类性别鉴定CHD基因通用引物 sex1′(5′-CTCCCAAGGATGAGAAACTGTGCAAAACAG-3′)和sex-mix(5′-CCTTCGCTGCCATTGAAGCTAATCTGGAAT-3′)[17],以已知雄性、雌性的贵妃鸡作为阳性对照,对杂交个体HY01进行性别鉴定。PCR反应在10 μL体系中进行,包括正反向引物各0.2 μL(10 μmol/L)、2×EasyTaq®PCR SuperMix(Transgen,北京)5 μL、ddH2O 1.6 μL、模板DNA 3 μL。扩增采用PE9700型DNA扩增仪(PE,美国),反应程序为94 ℃预变性3 min,94 ℃变性30 s,50 ℃退火45 s,72 ℃延伸50 s,扩增35个循环,最后72 ℃延伸10 min。扩增产物用2.8%的琼脂糖凝胶电泳分离(80 V稳压,1 h),以DL1000 marker(Takara,大连)为分子量标准估算扩增产物的大小,用凝胶成像仪拍照并记录实验结果。
1.2.4Cytb序列的PCR扩增及测序
使用鸟类Cytb基因的通用引物Mcb398(5′-TACCATGAGGACAAATATCATTCTG-3′)和Mcb869(5′-CCTCCTAGTTTGTTAGGGATTGATCG-3′)[18]扩增杂交个体和贵妃鸡的相应片段。PCR反应体积为50 μL,含有2×EasyTaq®PCR SuperMix缓冲液25 μL,正反向引物各1 μL(10 μmol/L),模板DNA(20 ng/μL)3 μL,用灭菌后的超纯水补足体积。反应程序为:94 ℃预变性5 min,94 ℃变性30 s,52 ℃退火45 s,72 ℃延伸30 s,扩增35个循环,最后72 ℃延伸7 min。扩增产物经1.5%的琼脂糖凝胶电泳分离(80 V 稳压,40 min),目的条带用AxyPrepTMDNA Gel Extraction Kit试剂盒进行纯化回收,用BigDyeTMTerminator v3.1 Cycle Sequencing Kit 进行Sanger法测序,测序由上海生工生物有限公司完成。同时从GenBank 中下载30条环颈雉和8条蓝孔雀的细胞色素b序列(Cytb)进行比较分析(图5)。
1.2.5 微卫星扩增及分型
从Hale等[19]和包文斌等[20]报道的位点中挑选能够用于鸡形目的微卫星位点及引物,经过实验验证,获得能够稳定扩增蓝孔雀和贵妃鸡的微卫星引物15对(表1),其中每对引物的上游引物的5′端进行FAM(蓝色)、JOE(绿色)、TAMRA(黑色)3种荧光标记。扩增后对PCR产物进行2%琼脂糖凝胶电泳检测,将成功扩增的产物送至上海生工生物科技有限公司,利用ABI3130遗传分析仪进行毛细管电泳,最终获得各位点基因分型数据。PCR 反应总体积为15 μL,其中:模板DNA(20 ng/μL)1.5 μL,TransStart®TopTaqDNA聚合酶0.3 μL,上下游引物(10 μmol/L)各0.3 μL,10 × TransStart®TopTaqbuffer 1.5 μL,2.5 mmol/L dNTPs 1.2 μL,用灭菌后的超纯水补足体积。PCR 扩增程序为:95 ℃预变性5 min,94 ℃变性30 s,退火30 s(退火温度Ta见表1),72 ℃延伸30 s,扩增35个循环,最后72 ℃延伸10 min。

表1 15个微卫星位点的引物序列及其退火温度

续表1
1.3 数据分析
1.3.1 形态学聚类分析
在数据分析前,用体长对尾长、翼长、喙长、口裂长、跗蹠长、四爪总长、四趾总长7个形态参数进行标准化来消除年龄及体型的影响,将7项参数与体长的比值作为最终分析指标。用跗蹠长对跗蹠前部鳞片数量进行标准化,得到跗蹠鳞片密度。标准化后得到8项形态学指标,用OriginPro 2018(OriginLab Corporation,USA)作箱形图直观展示疑似亲本和杂交个体之间的差异。利用SPSS 19.0对8项指标进行主成分分析,并利用欧式距离法(Euclidean distance)进行聚类分析。
1.3.2 分子生物学数据分析
将测得每条序列用DNAStar[21]软件包中的SeqMan进行校对,在Clustal W上将所有的序列进行比对,利用MEGA 5.05软件[22]基于Ts计算两两个体之间的Kimuar-2-parameter遗传距离,采用 neighbor-joining(NJ)法构建系统发育树,置信度为1 000次自举法检测,并计算未知杂交个体与环颈雉、蓝孔雀和贵妃鸡群体间的遗传距离,确定其母本信息。利用GENETIX 4.05软件对推测父本与等位基因之间的对应关系进行了因子对应(FCA)分析,验证遗传标记的有效性。利用Population 1.2.32软件基于Nei氏遗传距离构建NJ系统发育树,计算未知杂交个体分别与蓝孔雀、贵妃鸡的遗传距离。
2 结果
2.1 性别鉴定
利用性别鉴定引物sex1′/sex-mix对已知性别的贵妃鸡和杂交个体均成功扩增,其中已知雄性(1号泳道)得到1个297 bp的条带,已知雌性(2号泳道)得到257 bp和297 bp的2个条带。杂交个体(3号泳道)得到1条297 bp的条带,判定为雄性(图2)。
2.2 形态学指标聚类分析
形态指标比较结果显示,杂交个体的相对尾长与3种鸟的均值的差异分别为0.098 mm、-0.022 mm、-0.018 mm;相对翼长的差异分别为0.051 mm、0.079 mm、0.037 mm;相对喙长的差异分别为0.015 mm、-0.030 mm、-0.005 mm;口裂长的差异分别为0.003 mm、-0.025 mm、0 mm;跗蹠长的差异分别为-0.018 mm、-0.027 mm、0.023 mm。跗蹠鳞片密度的差异分别为0.010 mm、-0.060 mm、0.009 mm;四爪长的差异分别-0.026 mm、-0.027 mm、0.014 mm;相对四趾长的差异分别为-0.061 mm、-0.108 mm、0.021 mm(表2)。杂交个体在以上形态指标上更加接近于环颈雉和贵妃鸡,而与蓝孔雀较远(图3),说明双亲很可能为环颈雉和贵妃鸡。
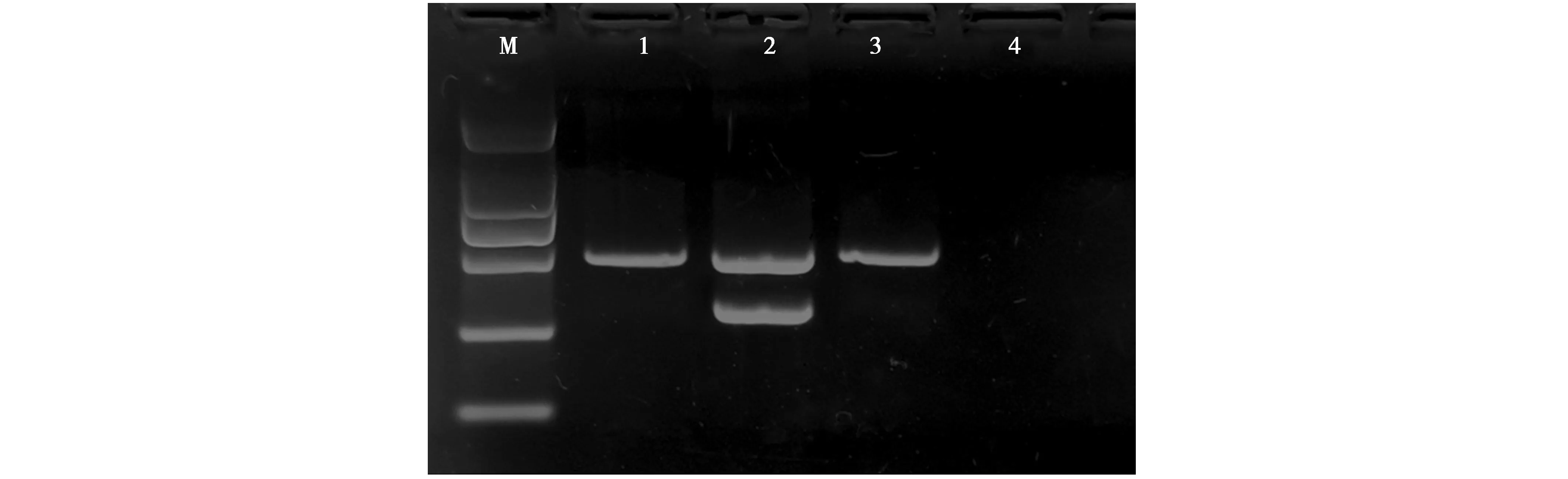
图2 通过引物sex1′/sex-mix对杂交个体进行性别鉴定的琼脂糖凝胶电泳图Fig.2 The agarose gel electrophorogram of PCR products for sex determination of hybrid bird using the primer pair sex′/sex-mix 注:1、2号泳道分别为已知雄性♂、已知雌性♀的阳性对照;4号泳道为阴性对照(ddH2O);3号泳道为杂交个体;M为DL1000 Marker(片段分别为1 000 bp、700 bp、500 bp、400 bp、300 bp、200 bp、100 bp) Note:Lane 1 and 2 are positive controls of known male,known female.Lane 4 is negative control(ddH2O).Lane 3 is the hybrid bird.M is DL1000 DNA fragment size ruler(1 000 bp,700 bp,500 bp,400 bp,300 bp,200 bp,100 bp)
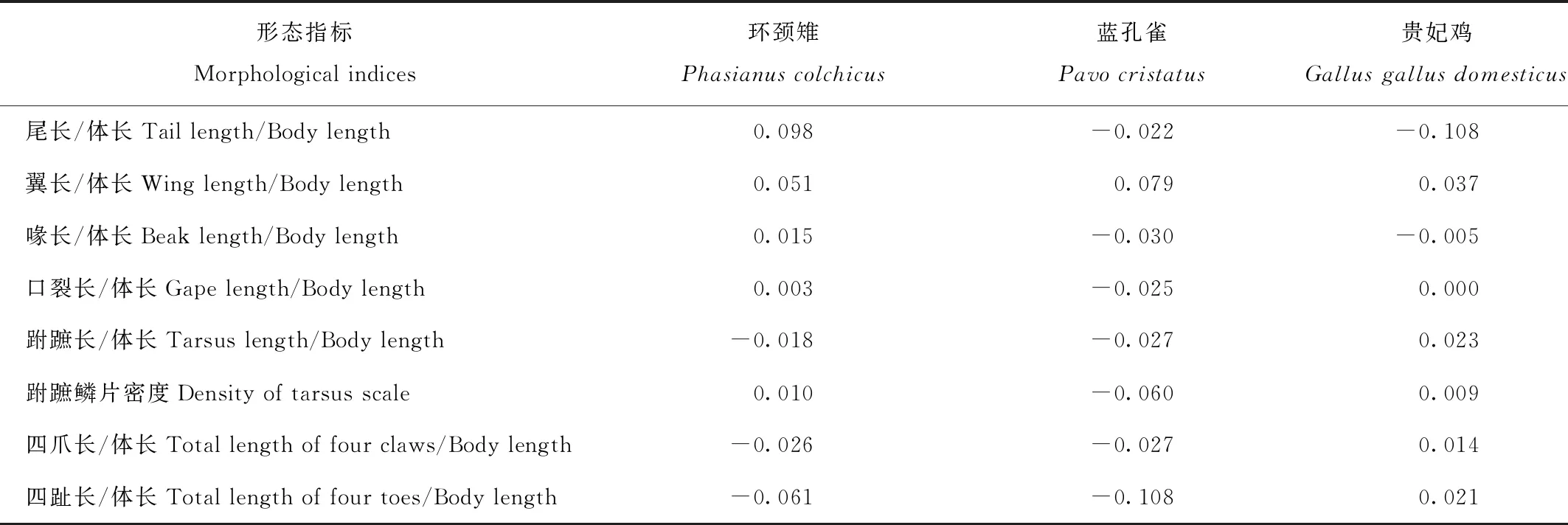
表2 杂交个体和雄性贵妃鸡、环颈雉和蓝孔雀群体均值的差异
主成分分析的前两个主成分累计贡献率为99.637%,其中第一主成分贡献率为94.360%,尾长/体长等8项指标在第一主成分上都具有很高载荷(大于0.9),说明8项指标均具有很好的解释形态差异的能力。杂交个体与贵妃鸡的欧式距离最小,为0.119,与环颈雉的距离为0.131,与蓝孔雀的距离最大,为0.742(表3)。4组个体被聚为两大分支,第一支包含贵妃鸡、杂交个体和环颈雉,第二支只有蓝孔雀(图4)。结果进一步说明杂交个体与蓝孔雀的关系较远,而与贵妃鸡和环颈雉的关系较近。
2.3 母系鉴定结果
实验测得的Cytb基因片段大小为421 bp。以杂交个体与环颈雉(n=30)、蓝孔雀(n=8)和贵妃鸡(n=6)共45个个体的Cytb序列计算遗传距离,结果显示,杂交个体与环颈雉、贵妃鸡和蓝孔雀群体的遗传距离分别为(0.007±0.003)、(0.107±0.018)和(0.097±0.017),其与环颈雉群体的遗传距离较贵妃鸡和绿孔雀低1—2个数量级。NJ 系统树(图5)更加清晰地显示,所有个体分为两大分支,第一个分支包含所有的环颈雉序列。环颈雉序列进一步分为两个分支,而杂交个体属于第二个分支,bootstrap支持度为100%。第二个分支包括贵妃鸡和绿孔雀,二者又分数两个不同的分支,bootstrap支持度也达到100%。综合以上结果,可以认定杂交个体的母本为环颈雉。
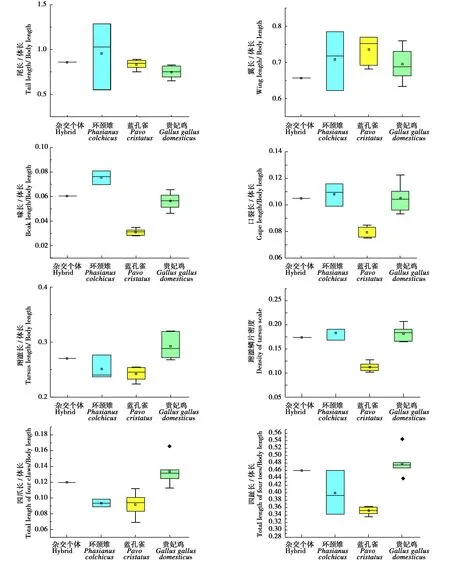
图3 杂交个体和3种疑似亲本的8项形态学指标的分布Fig.3 Distribution of eight morphometric indices of the hybrid and three suspect paternal species

表3 杂交个体和雄性贵妃鸡、环颈雉和蓝孔雀群体间的欧式距离
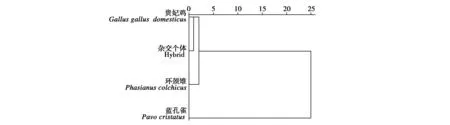
图4 杂交个体和雄性贵妃鸡、蓝孔雀、环颈雉群体的聚类分析Fig.4 Clustering analysis of the hybrid and male royal chicken(Gallus gallus domesticus),ring-necked pheasant(Phasianus colchicus)and blue peafowl(Pavo cristatus)
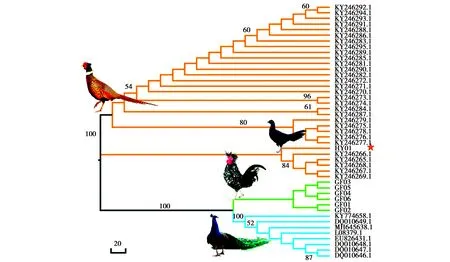
图5 基于Cyt b基因构建的杂交个体、环颈雉、贵妃鸡和蓝孔雀的NJ系统树Fig.5 Neighbor Joining tree of the hybrid bird,ring-necked pheasant,royal chicken and blue peafowl based on Cyt b sequences 注:★示杂交个体;分支上的数字为 bootstrap 值(低于50%的数值没有显示) Note:Sequence data of ring-necked pheasant and blue peafowl were downloaded from GenBank.Accession numbers are shown next to the branch.The hybrid bird is indicated using ★.Bootstrap values(>50% only)are shown next to corresponding nodes
2.4 核基因鉴定
2.4.1 微卫星标记有效性检验
用15个微卫星位点对贵妃鸡和蓝孔雀2个疑似父本的群体进行基因分型。对2个群体个体间遗传差异进行因子相关分析(FCA),结果显示,最主要的2个影响因子共体现了46.67%的遗传差异,11只蓝孔雀被分为2个亚群,可能与不同的祖先来源有关。而贵妃鸡和蓝孔雀群体显著分开(图6),表明根据15个微卫星位点的遗传信息能够可靠地分辩开贵妃鸡和蓝孔雀2个疑似父本物种,可用于该杂交个体父本的鉴定。
2.4.2 遗传距离分析
利用Population 1.2.32软件计算杂交个体、蓝孔雀和贵妃鸡的两两个体间的Nei氏遗传距离,结果显示杂交个体与贵妃鸡的平均遗传距离为0.166,与蓝孔雀的平均遗传距离为0.535。基于Nei氏遗传距离构建的NJ树进一步显示(图7),贵妃鸡和蓝孔雀分别聚为两大分支,且二者之间的距离较远。杂交个体HY01的位置非常靠近贵妃鸡,而远离蓝孔雀。根据以上结果可以判定,杂交个体HY01的父本为贵妃鸡。
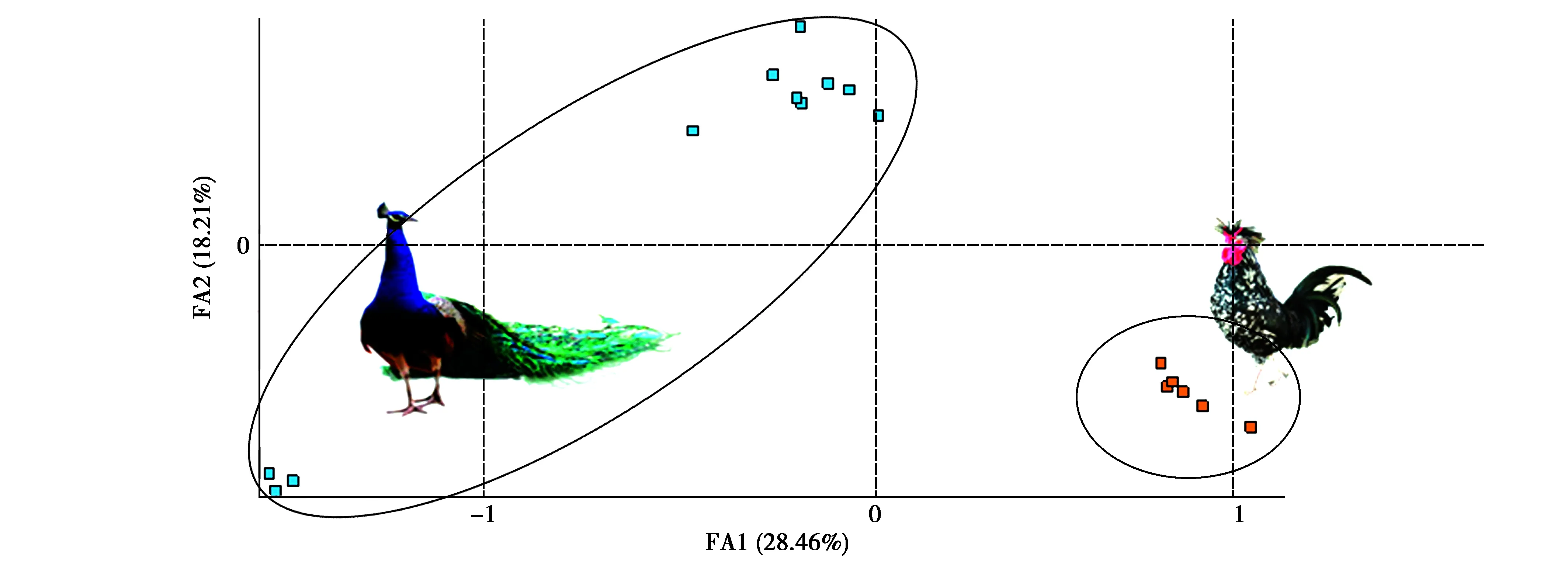
图6 贵妃鸡和蓝孔雀15个微卫星基因型的FCA二维散点图Fig.6 Scatter plot of factorial correspondence analysis(FCA)of royal chicken and blue peafowl based on 15 microsatellite genotypes
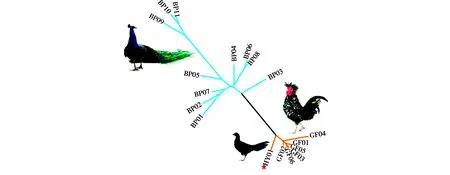
图7 杂交个体、贵妃鸡和蓝孔雀群体的系统发育树Fig.7 Phylogenetic tree of the hybrid bird,royal chicken and blue peafowl 注:该系统树为基于两两个体间遗传距离所构建的NJ树,遗传距离由15个微卫星位点的基因型数据计算而来,★示杂交个体 Note:This phylogenetic tree is the NJ tree constructed based on pairwise genetic distance estimated using 15 microsatellite genotypes.★ indicates the hybrid bird
3 讨论
自然界中,种间生殖隔离主要依靠同种识别/异种不识别、精子免疫排斥、胚胎生命力低下和后代不育等生理机制[23]和繁殖周期差异化、生态位分离等生态机制[24-26]来实现。但在人工饲养条件下,空间隔离被打破,食物充分供应,管理周期一致,使其繁殖周期趋于一致,就有机会打破种间隔离而产生杂交[27]。现今的动物园在展示方式、丰容、管理等方面的能力不断提高[28],导致圈养物种间比以往任何时候都更可能产生种间杂交。
杂交个体的亲本物种可依据杂交个体所具有的亲本形态特征做出判断。但如果后代可以,并与亲本物种进行回交,则表型上会逐步靠近回交亲本,直至难以辨别,最为典型的是绿孔雀×蓝孔雀的杂交。近年来,学者们发现利用分子生物学方法能够鉴定形态上无表现的杂交种,DNA分子标记的广泛应用为鉴定杂交个体及其亲本物种提供了有效的手段[29-30],但实际管理中需一套鉴定流程来解决此类问题。
本案例中的杂交个体具有典型性,首先,是多个物种共同散养在一个环境中,管理方式相同,有机会通过自然交配产生后代。与大多数杂交不同,本例属于跨属的远缘杂交,发生几率和后代成活几率更低,亲本鉴定相对容易。因此,本研究先从形态学角度解决这一问题。鉴于鸡形目物种普遍具有二型性,首先对其进行了性别鉴定,根据性别,与同性别亲本物种进行比较。结果显示,体长、尾长、翅长、喙长、口裂长、跗蹠长、爪长和趾长等常规量度都可准确地鉴定2个亲本的物种。通过欧几里得距离进行聚类,可直观地显示杂交个体与疑似亲本物种的关系,进而做出认定和排除的结论。该方法虽简单、易行,几乎不需要分析成本,但也存在局限性:第一,必须清楚杂交个体的性别;第二,不能把亲本物种具体明确到父本或母本;第三,测量活体时需要捕捉和保定动物,造成应激,对于高度敏感的物种应该慎用。
DNA鉴定亲本主要依据物种鉴定的原理。首先通过线粒体DNA(mtDNA)的序列分析,鉴别出母本物种,然后再通过核基因的分析鉴别父本物种。本案例中首先采用Cytb基因的序列确定了其母系物种为环颈雉,然后从疑似父本的物种中排除环颈雉,减少父本鉴定的工作量和成本。本实验采用15个微卫星位点,通过计算杂交个体分别与疑似父本贵妃鸡和蓝孔雀的遗传距离,确定了其父本物种为贵妃鸡。
相比形态学方法,DNA鉴定方法的优势在于其非损伤性采样避免应激反应,并且结果有更高的可靠性。线粒体存在于细胞质中,受精过程中,精子把细胞核注入卵子的过程中,要么细胞质连同线粒体被留在外面,要么注入卵子后通过被降解,使合子乃至胚胎的mtDNA仅来源于卵子,故此mtNDA遵从母系遗传[31]。mtDNA上的Cytb基因的进化速率与物种分化速率大体相同,是最为灵敏可靠的物种鉴定分子标记[32-33]。父本物种的鉴别比母本复杂得多。鸟类W染色体为雌性所特有,雌鸟的性染色体核型为ZW型,雄鸟为ZZ型。故此没有父本专属的染色体,无法通过mtDNA这样的遗传标记鉴别父本物种。微卫星是共显性遗传标记,分辨率高,可以显示双亲的遗传信息,因而在杂交个体鉴定中比较常用[34-35]。微卫星侧翼序列在近缘种之间具有保守性,可以设计近缘种通用引物进行PCR扩增和分型[36]。但通用性并不完全,在不同物种之间互用时,会出现一定频率的等位基因丢失、无效等位基因等问题,甚至扩增失败[37],影响鉴定的可靠性。本研究中的微卫星位点均经过对3个物种的有效性验证(另文发表)。因此,寻找合适的微卫星位点用于物种间的扩增鉴定将是今后解决此类杂交问题不可避免的工作。
总之,今后对于雉科鸟类杂交亲本的物种鉴定,可根据需要,选择形态学方法或分子生物学方法,也可以二者结合,提高鉴定的可靠性。
