免疫检查点抑制剂耐药机制分析
2020-10-24
刘小军,甘肃省人民医院放疗二科 甘肃省兰州市 730000
关泉林,兰州大学第一医院肿瘤外科 甘肃省兰州市 730000
0 引言
免疫检查点抑制剂(immune checkpoint inhibitor,ICI)已成为恶性肿瘤非常重要的治疗手段.T细胞介导的免疫反应包含一系列事件的组合反应,涉及多条兴奋性信号通路和抑制剂信号通路的相互作用,前者引发针对外来抗原的适应性免疫,后者避免了自身免疫的发生.抗原特异性T细胞识别抗原递呈细胞递呈的抗原和主要组织相容性复合物(major histocompatibility complex,MHC)之后,相继经历初始的克隆选择阶段、启动阶段和激活阶段.另外,对于T细胞的完全激活效应,T细胞和抗原递呈细胞两者协同刺激分子的相互作用必不可少.T细胞激活和增殖之后,可以顺着化学因子介导的浓度梯度到达特定部位.效应T细胞在识别相同抗原之后,可释放γ-干扰素(γ-interferons,IFN-γ)和其它细胞因子,引发细胞毒效应和抗肿瘤效应.肿瘤细胞被清除后,记忆性T细胞得以形成,并保持静默状态,直至相同抗原重新暴露.在生理状态下,免疫检查点在T细胞激活引发的炎症反应中发挥负性调控作用.很多恶性肿瘤通过上述机制避免免疫杀伤,而免疫检查点的抗体则可以阻断这种负性效应,发挥抗肿瘤效应.
当前,共有七个ICI经过美国批准上市,包括一个细胞毒性T淋巴细胞相关蛋白-4 (cytotoxic T-lymphocyte associated protein 4,CTLA-4)单抗,即伊匹木单抗,三个程序性死亡分子(programmed death-1,PD-1)单抗,包括纳武利尤单抗、帕博利珠单抗和 Cemiplimab,以及三个程序性死亡配体-1 (programmed death ligand -1,PDL1)单抗,包括阿替利珠单抗、德瓦鲁单抗和Avelumab.肿瘤免疫治疗历史上一个非常重要的里程碑在于肿瘤缓解率的提高往往可以转化为生存期的延长.与之相对应,一些免疫新药临床试验的生长曲线出现了“长拖尾”效应.然而,ICI治疗恶性肿瘤真正能够获得缓解的比例并不高.肿瘤突变负荷、微卫星状态、PD-L1的表达水平及肿瘤浸润淋巴细胞(tumor infiltrating T cells,TIL)的水平均可影响ICI的疗效.如今,肿瘤免疫治疗领域的巨大挑战正是来自于ICI复杂的耐药机制,以及针对不同耐药机制的克服策略.根据ICI耐药发生的时机,可以分为原发性耐药和获得性耐药,前者指使用ICI之后从未出现缓解的情况,后者指初始缓解之后出现的肿瘤进展现象.免疫新药的耐药现象也可以分为内源性耐药和外源性耐药.内源性耐药指源自肿瘤细胞本身的改变引起的耐药,如免疫识别过程改变、细胞信号通路改变、基因表达改变、DNA损伤修复反应等;外源性耐药指外界因素影响了T细胞激活的所有过程.以下分述各种耐药机制的研究进展和克服策略.
2 ICI的耐药机制分析
2.1 肿瘤免疫原性改变 肿瘤能否引起宿主适应性免疫反应,首先取决于宿主对肿瘤细胞作为“外来物”的识别能力.高肿瘤突变负荷(tumor mutation burden,TMB)经常伴随新抗原的释放,在抗肿瘤免疫反应中发挥重要作用[1].随着测序技术的提高,越来越多的非同义突变得以发现,而非同义突变可以引发针对癌细胞的细胞毒性效应.与之相反,癌细胞新抗原表达的表达缺失可以导致针对ICI的获得性耐药.免疫编辑学说揭示了新抗原表达对肿瘤免疫原性的影响,也解释了高TMB肿瘤如何产生耐药的原因.免疫系统和癌细胞的长期相互作用导致肿瘤内部发生克隆选择,最终缺乏新抗原表达和免疫原性低下的癌细胞对ICI出现耐药[2].随着肿瘤内部异质性的不断增加,低免疫原性癌细胞克隆得以不断增加,导致ICI治疗的疗效不断下降[3].研究表明[4],接受了ICIs的非小细胞肺癌患者,出现了多种新抗原的消失,支持免疫编辑介导获得性耐药的理论.另外一个研究表明,IFN-γ的表达通过细胞毒性T细胞(cytotoxic T lymphocyte,CTL)促进免疫编辑过程,导致免疫耐药相关基因拷贝数量改变[5].
DNA修复和复制改变引起的基因组不稳定性可以增加新抗原表达,提高肿瘤突变负荷,继而增加肿瘤的免疫原性.乳腺癌相关基因突变的恶性黑色素瘤患者对ICI治疗具有更好的疗效[6].乳腺癌相关基因突变的卵巢癌具有更高的TMB水平[7].在泌尿道肿瘤,其它DNA损伤修复基因的突变,均显示了TMB水平增高和更佳ICI疗效的相关性[8].在多种肿瘤中,DNA错配修复基因缺失导致高度微卫星不稳定(high level microsatellite instability,MSI-H)和高TMB,ICI对这样的患者往往具有更好的疗效[9].
癌细胞PD-L1的表达是另一个ICI治疗的疗效预测因子.然而,缺乏PD-L1表达的患者,对ICI治疗仍可以产生疗效,这是因为IFN介导的信号同样可以诱导PD-L1的表达.无论PD-L1是否表达,肿瘤组织缺乏TIL的患者则不会对ICI产生良好的治疗反应.一个恶性黑色素瘤的研究表明,肿瘤组织CTL细胞数量可以预测ICI的疗效.因此,TIL也是肿瘤免疫治疗的疗效预测因素[10].
2.2 肿瘤微环境改变 肿瘤微环境包括影响肿瘤细胞的所有外部因素,如各种免疫细胞、间质细胞、血管、细胞外基质,以及各种细胞因子等.免疫抑制细胞和间质中的异质性细胞因子一起,降低了ICI的疗效.调节T细胞(regulatory cell,Treg)是一种非常重要的免疫抑制细胞,可释放抑制性细胞因子,限制炎症反应发生,抑制效应T细胞(effector T cells,Teff)功能.在多种肿瘤中发现了Treg在肿瘤组织中浸润的现象,提示异质性免疫微环境的形成[11].在小鼠模型中,Teff和Treg的比例与ICI疗效相关,Teff数量下降,或者Treg数量增加,都会导致对免疫治疗的耐药现象[11].
骨髓来源巨噬细胞是另外一类免疫抑制细胞,存在于肿瘤间质之中,可以促进免疫逃逸和肿瘤生长.骨髓来源巨噬细胞可以促进肿瘤浸润、转移和血管生成,并和临床不良预后相关.在小鼠横纹肌肉瘤模型中,抑制骨髓来源巨噬细胞向肿瘤间质的浸润,可以增强ICI的抗肿瘤效应[12].
肿瘤相关巨噬细胞,特别是M2型巨噬细胞,可以通过调节肿瘤微环境而促进肿瘤进展.M2型巨噬细胞可以刺激肿瘤细胞运动、血管形成、生长和免疫逃逸[13].在一些肿瘤模型研究中,清除肿瘤相关巨噬细胞可以延缓肿瘤生长.在一个胰腺肿瘤细胞模型中,阻断巨噬细胞的髓细胞生长因子信号通路可以避免ICI耐药.肿瘤微环境中的细胞因子介导免疫细胞的趋化、激活和增殖等过程,发挥免疫促进作用或免疫抑制作用.一些化学因子可以募集骨髓来源巨噬细胞和Treg到达肿瘤组织,促进肿瘤抑制微环境的形成[14].另外一些抑制性化学因子可以减少肿瘤组织中的TIL,促进ICI耐药发生[15].
转化生长因子-β (transforming growth factor-β,TGF-β)信号通路可以通过多个环节影响肿瘤微环境,主要发挥免疫抑制作用,如可以抑制CTL,上调Treg[16].在一个结肠癌小鼠模型中,TGF-β信号通路活性上调和较低的肿瘤免疫原性相关,并可降低ICI的疗效,提示免疫耐受的发生[17].在尿道上皮性肿瘤中,ICI抗肿瘤效应的改善与TGF-β的抑制相关[18].
血管内皮生长因子(vascular endothelial growth factor,VEGF)除可促进血管新生之外,尚可发挥免疫抑制性细胞因子的效应,与ICI耐药发生相关.分析ICI获益和未获益两组患者,发现后者VEGF水平升高[19].VEGF可抑制淋巴细胞前体细胞向T细胞的发育,减少CTL向肿瘤微环境的趋化,促进Treg向肿瘤间质的移动[20].VEGF可上调T细胞抑制性受体表达,促进CTL耗竭发生[21].临床研究表明,阻断VEGF治疗提高了ICI治疗晚期肾癌等肿瘤的疗效[22].
2.3 免疫识别和结合过程的异常改变 T细胞增殖受限,以及不能充分分化,都极有可能演变为对ICI的耐药.树突状细胞(dendritic cells,DC)趋化受阻导致的初始T细胞活化受损,与肿瘤组织TIL缺乏以及ICI耐药相关[23,24].抗原递呈的缺陷在ICI耐药中发挥重要作用.多个研究显示,MHC-I分子表达下调将使癌细胞对免疫监视产生抵抗[25,26].
β2-微球蛋白功能缺失引发MHC-I分子折叠和运输障碍,导致癌细胞的免疫逃逸[27].一个恶性黑色素瘤的临床研究显示,β2-微球蛋白存在截断突变,并导致MHC-I表达缺失和获得性耐药的发生[28].另一个结肠癌的研究发现MHC-I分子T细胞受体结合区域存在突变,致使T细胞的细胞毒效应下降和免疫逃逸发生[29].
免疫细胞中的IFN-γ通过调节下游Janus激酶/信号转导与转录激活子(Janus kinase/signal transducer and activator of transcription,JAK/STAT)分子发挥作用.IFN-γ信号通路可上调MHC-Ⅰ分子表达,增强DC对抗原的递呈功能,发挥正向免疫调节效应.然而,IFN-γ也可通过负性回路上调癌细胞PD-L1分子表达,导致适应性免疫耐受的发生[30].多个研究显示IFN-γ-JAK/STAT通路的缺失可导致MHC-Ⅰ分子和PD-L1表达下降,继而导致ICI耐药发生[31].
当前临床使用的ICI仅针对PD-1、PD-L1和CTLA-4三个靶标.PD-1和CTLA-4之外其它免疫检查点的过度表达也与ICI治疗失败相关.针对多个肿瘤的研究发现,ICI的获得性耐药出现在其它免疫检查点表达上调之后,这些检查点包括T细胞免疫球蛋白黏蛋白-3 (T cell immunoglobulin and mucin domain-3,TIM-3)、淋巴细胞激活基因3 (lymphocyte activation gene-3,LAG-3)等[9,32,33].近年来,一些新的免疫检查点得以不断发现,如B细胞和T细胞衰减蛋白(B and T lymphocyte attenuator,BTLA)、T细胞免疫受体酪氨酸碱基抑制膜序域(T cell immunoglobulin ITIM domain,TIGIT)和T细胞激活Ⅴ型结构域免疫球蛋白抑制因子等[34,35].在非小细胞肺癌,多种免疫检查点的共表达与T细胞的耗竭状态相关[36].T细胞耗竭和PD-1,CTLA-4,TIM-3,LAG-3和BTLA等的表达以及获得性耐药相关[36].这些免疫检查点也是未来免疫治疗的潜在分子靶标.
耗竭性T细胞表现为抑制性受体的过表达和杀伤能力下降等,不利于ICI发挥作用,甚至表现为耐药.相同抗原的长期暴露容易引起T细胞PD-1表达增高,损害T细胞的抗肿瘤效应.PD-1高表达与T细胞耗竭发生相关.表观遗传研究表明,耗竭性T细胞具有独特的染色体形态改变,基因的转录受到明显影响,限制了细胞毒作用的发挥[37].这种特异性染色体改变决定了接受ICI治疗后耗竭T细胞的命运,要么彻底耗竭,要么恢复细胞毒作用[38].
T细胞完成抗肿瘤免疫反应之后,一小部分T细胞分化为记忆T细胞,保持“静默”状态,直至再次遇到相同抗原.抗原长期暴露可损害前体记忆细胞,导致记忆功能减低.考虑到当前ICI疗效的持久性,记忆T细胞在保持疗效过程中必然扮演重要角色.因此可以推测,对ICI疗效不佳的患者,有可能是因为记忆T细胞生成障碍或功能缺失所致[39].
2.4 信号通路的异常激活或缺失 信号通路可通过影响原癌基因和抑癌基因的表达调节宿主免疫反应.信号通路亦通过调节免疫细胞和免疫分子的组成影响肿瘤微环境,使肿瘤细胞对ICI产生耐药.有丝分裂源激活的蛋白激酶(mitogen activated protein kinases,MAPK)信号通路可调节细胞的多种活性,包括增殖、凋亡和运动等.因此,MAPK信号通路的异常改变可促进多种肿瘤发生和发展.MAPK信号通路活性的上调可通过增加VEGF和其它类型抑制性细胞因子的表达,减少TIL向肿瘤组织的趋化,降低TIL的杀伤功能,导致免疫逃逸的发生.小鼠模型研究表明,MAPK抑制剂可以增强TIL活性,上调γ-IFN信号通路活性,增加MHC-I类分子的表达,促进抗肿瘤效应的发生[40].
作为一个非常重要的抑癌分子,磷酸酶和张力蛋白同源蛋白(phosphatase and tensin homolog,PTEN)的缺失促进磷脂酰肌醇-3激酶(phosphatidylinositol 3-hydroxy kinase,PI3K)的组成型激活,导致肿瘤的发生.另外,PTEN的缺失可以促进VEGF表达,促进抑制性免疫细胞如Treg向肿瘤组织的趋化,降低CTL活性,促进肿瘤生长.PTEN缺失和ICI治疗尿道平滑肌肉瘤的耐药相关[41].在动物模型研究中,PI3K-γ抑制剂可以减少肿瘤微环境中的骨髓来源巨噬细胞,提高ICI的疗效[42].
WNT/β-连环素信号通路也是一个非常关键的促癌信号通路,与多种细胞功能活动相关.WNT/β-连环素信号通路的异常在多种类型的恶性肿瘤扮演重要角色,与癌细胞的局部浸润和远处转移能力相关.除了肿瘤形成之外,WNT组成性表达可剔除肿瘤组织中的T细胞,参与ICI耐药.研究表明[23],肿瘤组织β-连环素水平和TIL数量呈负性相关,并且认为这种负性相关是由趋化因子CCL4的下调、无法招募DC所致,后者为T细胞启动免疫反应所必须.
吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)是催化色氨酸生成犬尿氨酸的限速酶,后者可抑制Teff活性,介导ICI耐药.犬尿氨酸的蓄积也可通过抑制T细胞功能和诱导凋亡而引发免疫抑制反应.一个动物研究[43]表明,IDO敲除小鼠接受ICI治疗后拥有更长的生存时间,反映了免疫治疗联合IDO阻断治疗的潜力(图1).
3 免疫耐药的克服策略
当前克服ICI耐药的研究尚处于初始水平,无法达到针对不同机制,一一对应、各自攻破的的高度.联合治疗策略有助于提高肿瘤组织免疫原性,提高DC抗原递呈能力,改善CTL细胞的细胞毒作用,减轻T细胞耗竭发生,降低或延缓耐药发生.以下从临床角度分别叙述克服ICI耐药的研究进展.
3.1 “双免”疗法 两种不同机制ICI的联合使用有助于克服耐药,提高疗效.在恶性黑色素瘤的研究中,“双免”联合优于单一药物[44].抗CTLA-4单抗在T细胞启动阶段发挥作用,而抗PD-1 抗体则在效应阶段的后期重新激活T细胞,发挥作用.两者发挥作用的时相不同.另外,抗CTLA-4 单抗有助于清除肿瘤微环境中的Treg,扩展肿瘤抗原识别范围,增强CTL介导的抗肿瘤效应[45].
3.2 与化放疗联合 传统的抗肿瘤手段化疗和放疗亦具有重要的免疫调节作用.联合化疗和放疗是克服ICI耐药的重要策略.化疗可以杀灭或损伤肿瘤细胞,增加肿瘤抗原释放,有助于提高肿瘤对ICI治疗的敏感性;化疗有助于清除骨髓来源巨噬细胞、Treg和肿瘤相关巨噬细胞,三者是非常重要的免疫抑制细胞[46].如在结肠癌肿瘤模型研究发现,环磷酰胺可以清除Treg,并和ICI产生协同抗肿瘤效应;阿霉素可清除骨髓来源巨噬细胞,增加ICI在乳腺癌的疗效;胶质母细胞瘤的研究也发现,清除免疫微环境之中的免疫抑制细胞,有助于提高ICI的抗肿瘤效应.化疗药物也可促进辅助型T细胞-1/辅助型T细胞-2的转变,增强CTL的活力.在肺癌临床领域,ICI联合化疗取得了不俗的成绩,帕博利珠单抗联合化疗都优于当前的标准治疗方案[47,48].
传统疗法放疗联合免疫治疗也具有广阔的应用前景,是未来抗肿瘤治疗研究热点所在.放射治疗也可促进肿瘤抗原释放,提高肿瘤微环境的炎症反应水平,有利于ICI发挥作用.放疗有助于DC的活化,增加炎性因子的释放,促进TIL向肿瘤组织趋化[49].放疗引起的肿瘤细胞损伤促使局部肿瘤抗原的释放,发挥“原位疫苗”或“个体化疫苗”的功效[24].局部肿瘤回缩引起的全身抗肿瘤免疫反应称为“远隔效应”,具有重要的意义,值得深入研究.放疗与免疫治疗的联合存在多种模式,例如序贯抑或同步,也包括不同的治疗时机和剂量分割方式等[50].一些临床试验正在探索放疗联合ICI治疗晚期恶性肿瘤的疗效[51].
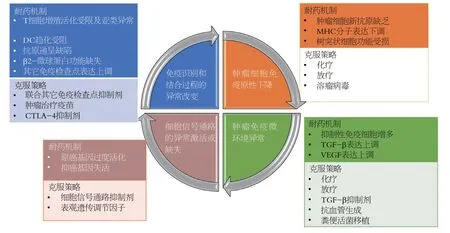
图1 免疫耐药的耐药机制及克服策略.MHC:主要组织相容性复合物;DC:树突状细胞;CTLA-4:细胞毒性T淋巴细胞相关蛋白-4;TGF-β:转化生长因子-β;VEGF:血管内皮生长因子.
3.3 与肿瘤治疗疫苗联合 肿瘤治疗疫苗,如DC疫苗和多肽疫苗,可以促进抗原递呈反应和T细胞免疫反应的启动,有助于将“冷”肿瘤转变为“热”肿瘤,延缓和克服耐药[52].肿瘤治疗疫苗的研发是实现个体化免疫治疗的重要途径.纽约食管鳞状细胞癌-1疫苗在一小部分患者中尚可巩固免疫记忆[53].未来肿瘤治疗疫苗成功研发取决于更多泛肿瘤抗原的发现和鉴定.
3.4 与共刺激分子类似物或拮抗剂联合 T细胞和抗原递呈细胞表明的共刺激分子有促免疫和抑制免疫之分.ICI联合促免疫的共刺激分子类似物,有助于放大抗肿瘤免疫反应,克服ICI耐药发生.这些分子如诱导性T细胞共刺激分子、CD134、CD28及CD137等.一些共刺激分子还可促进CD8+T细胞的增殖和抗肿瘤免疫效应,抑制Treg的抑制效应[54].另外一些共刺激分子,如TIM-3、TIGIT及LAG-3等,可发挥抑制抗肿瘤免疫反应的作用.靶向这些抑制性共刺激分子的新型ICI,有助于避免T细胞耗竭[55].ICI联合共刺激分子类似物或抑制剂具有广阔的转化前景.
3.5 与分子靶向药物联合 ICI联合各种不同作用机制的分子靶向药物,有助于提高疗效,延缓和克服耐药.例如,VEGF不仅介导肿瘤血管新生,也可抑制DC成熟,减弱T细胞的浸润,发挥免疫抑制效应,VEGF抑制剂贝伐珠单抗则具有重要的免疫正向调节作用.ICI和抗血管生成治疗的联合具有坚实的理论基础和广阔的应用前景[56].针对原发性肝癌的研究体现了这种组合的巨大潜力.ICI联合BRAF抑制剂、丝裂原活化蛋白激酶抑制剂及表皮生长因子受体抑制剂也取得了协同抗肿瘤效应.新近研究显示,一些信号通路异常活化与ICI耐药相关,如哺乳动物雷帕霉素靶点通路、缺氧诱导因子通路、JAK/STAT通路和 Wnt/β-连环素信号通路等.表观修饰可以改变免疫调节相关基因的表达水平,影响抗原处理和提呈过程,介导免疫逃逸发生.去甲基化制剂可使一些免疫相关基因重新表达,具有一定的抗肿瘤治疗价值,可能适合用于联合ICI[50].
ICI联合TGF-β抑制剂、IDO抑制剂和巨噬细胞抑制剂,有利于改善抑制性免疫微环境,延缓耐药发生.此外,联合溶瘤病毒、过继性自体细胞回输等,也具有重要的理论意义,部分组合正在进行临床前水平的探索[57].
3.6 粪便细菌移植技术 肠道菌群也可作为辅助手段选择用于和ICI的联合治疗.目前已知饮食可以影响肠道菌群的组成,纤维素的摄取可以提高宿主免疫反应水平,增加ICI的疗效.一些益生菌可以重塑肠道菌群,被用于和ICI的联合治疗.研究表明,粪便细菌移植有望克服裸鼠肿瘤对ICI的耐药[58].一个Ⅰ期临床试验以对ICI耐药的胃肠道肿瘤为研究对象,拟探索粪便活菌移植对再次跨线使用ICI的增效作用(NCT04130763) (图1).
4 结论
本文讨论了ICI引起耐药的可能机制和逆转策略.ICI有可能在小部分患者获得持久的临床疗效.为了减少耐药,多种治疗策略的联合有助于减少或延缓耐药发生.分子标志物检测对于预测ICI的疗效至关重要.当前使用的疗效标志物主要包括PD-L1表达、TMB、TIL及MSI-H等.然而,由于抗肿瘤免疫反应的复杂性,以及肿瘤存在的巨大异质性,疗效的预测和标志物的筛选依旧困难重重,面临较大的挑战性.全基因组测序和表观遗传分析有助于更好地选择优势人群,进行个体化的精准治疗.另外,治疗前后肿瘤组织和外周血的检测有利于发现有价值的靶标.
ICI耐药机制非常复杂.免疫反应的全过程都可以介导抗肿瘤效应的逃逸.影响ICI疗效和耐药的主要因素既包括宿主免疫组分特征,也包括肿瘤本身的特征以及外部因素的影响,如微生物组.免疫新药耐药的发生机制尚不明确.肿瘤免疫原性的改变、免疫微环境的改变、免疫识别和结合过程的异常改变,以及癌细胞信号通路改变等,都不同程度参与ICI耐药的发生.
ICI耐药的逆转研究目前尚处在初级阶段.一些研究表明,增加肿瘤组织免疫原性,促进T细胞启动免疫反应,克服T细胞耗竭,改善肿瘤组织微环境,增加T细胞向肿瘤组织的趋化,调节肠道菌群的组成等,有助于ICI耐药的克服.充分利用不同治疗策略之间的协同效应,进行联合治疗,是当前降低或延缓ICI耐药的可行举措.临床实践中,可以考虑将免疫新药和其它治疗策略进行联合,包括化疗、放疗、各种分子靶向药物、巨噬细胞抑制剂、细胞因子抑制剂、病毒疗法及肿瘤疫苗等.探索肠道菌群对ICI疗效影响的临床研究正在进行当中.相信随着恶性肿瘤的免疫治疗及耐药机制探索的不断深入,未来越来越多的患者将会从免疫治疗中获益.
