超声-Fe2+-K2S2O8/NaHSO3体系降解罗丹明B
2020-10-23张义焕杨宇帆沈佳如刘建才占昌朝
张义焕,杨宇帆,沈佳如,聂 恒,张 雷,刘建才,占昌朝,2
(1. 九江学院 化学与环境工程学院,江西 九江 332005;2. 江西省生态化工工程技术研究中心,江西 九江 332005)
具有难降解、色度大、生物毒性大等特点的大量染料废水被排放至环境中[1-4]。当前,利用热、紫外光(UV)、微波(MW)、超声波(US)及Fe2+等过渡金属离子活化过硫酸盐产生硫酸根自由基(SO4-·)的高级氧化技术,因其具有处理效率高、处理周期短、适用范围广等特点而被广泛应用于难降解有机污染物的处理。范星等[5]利用紫外光增强Fe2+活化过硫酸氢钾降解10 mg/L的罗丹明B(RhB),在pH=3、Fe2+投加量为50 μmol/L的条件下反应10 min,降解率可达 99%,研究表明在该体系中SO4-·对RhB降解起主要作用。张盛汉等[6]采用Fe2+/K2S2O8体系处理印染废水,在pH=6、K2S2O8投加量0.20 g/L、FeSO4投加量0.60 g/L的条件下反应30 min,并沉淀20 min,印染废水的COD去除率可达76.54%。在K2S2O8/NaHSO3氧化还原体系中,通过K2S2O8和NaHSO3间发生电子转移生成SO4-·的温度(0~50 ℃)要低于K2S2O8热活化分解产生SO4-·的温度(50~100 ℃)[7]。此外,超声处理作为一种无二次污染的去除污染物新技术[8-9],被用于非均相体系中辅助活化过硫酸盐,利用超声空化产生的局部高温高压可提高过硫酸盐产生SO4-·的速率,从而提高有机污染物的降解速率。
本工作采用超声促进、Fe2+活化的K2S2O8/NaHSO3联合体系(US-Fe2+-K2S2O8/NaHSO3体系)处理含RhB模拟废水,考察催化氧化效果的影响因素及协同作用,对反应机理进行探讨,以期研究出一种高效的染料废水处理方法。
1 实验部分
1.1 试剂和仪器
K2S2O8、NaHSO3、FeSO4·7H2O、NaOH、HCl溶液、RhB、甲醇、叔丁醇:均为分析纯;去离子水,自制。
BILON-500G型超声波乳化分散器:上海朗比有限公司;DC0506型超级恒温水槽:上海越平科学仪器有限公司;BS224S型电子天平:德国赛多利斯集团;pHS-3C型pH计:上海精密科学仪器有限公司;721型可见分光光度计:上海科学仪器公司;UV-2501 PC型紫外-可见光谱仪:日本岛津公司。
1.2 实验方法
在1 0 0 m L烧杯中加入一定初始p H、质量浓度为20 mg/L的RhB模拟废水50 mL,然后浸入恒温水浴中,依次投加一定体积的浓度为4.91 mmol/L的 K2S2O8溶液、浓度为4.91 mmol/L的NaHSO3溶液和浓度为0.49 mmol/L的FeSO4·7H2O溶液。将超声探头插入烧杯溶液中,在一定功率超声波的作用下,处理一定时间。取出5 mL处理液,用可见分光光度计在RhB最大吸收波长(λ=554 nm)处测定吸光度,用脱色率表征RhB的降解效果。
2 结果与讨论
2.1 初始pH对RhB模拟废水脱色率的影响
在反应温度25 ℃、超声功率250 W、K2S2O8溶液加入量1.2 mL、NaHSO3溶液加入量1.2 mL、n(K2S2O8)∶n(Fe2+)=20、反应时间4 min的条件下,初始pH对RhB模拟废水脱色率的影响见图1。由图1可见:在初始pH酸性至中性(pH=1~7)条件下,RhB模拟废水的脱色率较高,当pH=1时最高,达93.19%;当初始pH为弱碱性和碱性(pH≥9)时,RhB模拟废水的脱色率显著下降。这与文献报道SO4-·氧化有机污染物最适宜的环境为酸性至中性环境[8,10]一致。这是因为存在的H+有利于S2O82-生成氧化性比·OH强的SO4-·,见式(1)~(2);在酸性至中性环境中起主要氧化作用的是SO4-·;中性至弱碱性环境的氧化是SO4-·和·OH共同作用的结果;强碱性环境下主要以·OH 的氧化作用为主(强碱性溶液中产生的SO4-·立即与体系中的OH-反应生成·OH,见式(3))[10]。若选用酸性条件下反应,则在废水排放之前需要多次调节pH,增加处理成本,因而选用初始pH为5.18(自然条件)。


图1 初始pH对RhB模拟废水脱色率的影响
2.2 超声功率对RhB模拟废水脱色率的影响
在反应温度25 ℃、初始pH 5.18、K2S2O8溶液加入量1.2 mL、NaHSO3溶液加入量1.2 mL、n(K2S2O8)∶n(Fe2+)=20、反应时间4 min的条件下,超声功率对模拟废水脱色率的影响见图2。由图2可见:在超声功率小于250 W时,RhB模拟废水脱色率随着超声功率的升高而增加较快(其中在100~200 W时脱色率增加较少,在200~250 W时脱色率增加较多);在超声功率大于250 W时,脱色率随着超声功率的升高而增加趋缓。这是因为超声功率的增加,有利于·OH的生成[11],促进了RhB的降解;但当超声功率过大时,产生的SO4-·来不及转移,将发生副反应[12],见式(4)~(5)。且超声功率越高,能耗越大,从经济效益考虑,选用250 W的超声功率较为合理。
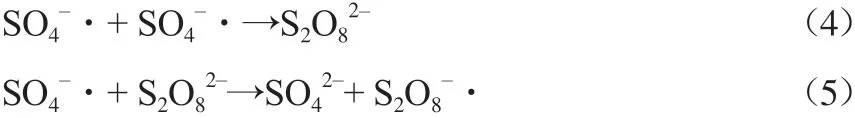

图2 超声功率对RhB模拟废水脱色率的影响
2.3 K2S2O8溶液加入量对RhB模拟废水脱色率的影响
在反应温度25 ℃、初始pH 5.18、超声功率250 W、NaHSO3溶液加入量1.2 mL、n(K2S2O8)∶n(Fe2+)=20、反应时间4 min的条件下,K2S2O8溶液加入量对RhB模拟废水脱色率的影响见图3。
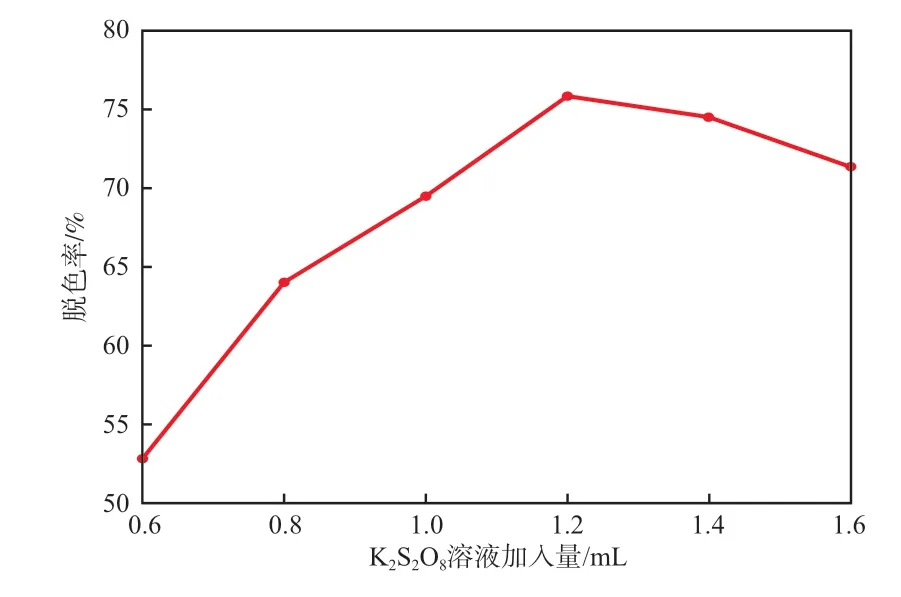
图3 K2S2O8溶液加入量对RhB模拟废水脱色率的影响
由图3可见:当K2S2O8溶液加入量小于1.2 mL时,RhB模拟废水脱色率随着K2S2O8溶液加入量增加而提高;当K2S2O8溶液加入量大于1.2 mL时,RhB模拟废水脱色率随着K2S2O8溶液加入量增加反而降低。这是因为S2O82-能与Fe2+、HSO3-发生电子转移反应生成SO4-·,见式(6)~(7);但SO4-·过量时发生了式(4)~(5)的副反应,氧化效率降低,使得RhB模拟废水脱色率反而降低[12]。故采用K2S2O8溶液加入量为1.2 mL。
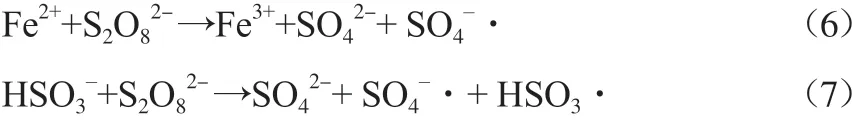
2.4 n(K2S2O8)∶n(Fe2+)对RhB模拟废水脱色率的影响
在反应温度25 ℃、初始pH 5.18、超声功率250 W、K2S2O8溶液加入量1.2 mL、NaHSO3溶液加入量1.2 mL、反应时间4 min的条件下,n(K2S2O8)∶n(Fe2+)对RhB模拟废水脱色率的影响见图4。由图4可见:当n(K2S2O8)∶n(Fe2+)从50减小到10,即Fe2+加入量不断增加时,RhB模拟废水脱色率逐步升高,这与发生了式(6)~(7)的反应有关[13];当n(K2S2O8)∶n(Fe2+)减小到5时,Fe2+加入量进一步增加,RhB模拟废水脱色率反而降低。这是因为Fe2+浓度较高时,活化分解S2O82-位点增多,SO4-·浓度增大,发生了式(4)~(5)的副反应,致RhB降解效果降低,故选用n(K2S2O8)∶n(Fe2+)=10。

图4 n(K2S2O8)∶n(Fe2+)对RhB模拟废水脱色率的影响
2.5 反应时间对RhB模拟废水脱色率的影响
在反应温度25 ℃、初始pH 5.18、超声功率250 W、K2S2O8溶液加入量1.2 mL、NaHSO3溶液加入量1.2 mL、n(K2S2O8)∶n(Fe2+)=10的条件下,反应时间对RhB模拟废水脱色率的影响见图5。由图5可见,反应时间为3~7 min时,脱色率随时间的延长而增加;当反应时间延长至8 min时,脱色率仅略有上升。综合考虑,选用反应时间为7 min,此时脱色率可达89.45%。
为进一步探究US-Fe2+-K2S2O8/NaHSO3体系在较佳处理条件下RhB的降解机理,分别对不同反应时间的RhB模拟废水进行全波长扫描,结果见图6。由图6可见:当反应时间为0 min时,RhB模拟废水在350,554 nm处出现了两个特征吸收峰,分别对应于苯环结构和n→π*的电子跃迁;随着反应时间的延长,554 nm处的峰强明显减弱且发生了位置蓝移,350 nm处的峰强也呈减弱趋势;当反应时间为7 min时,554 nm处的峰强明显减弱,350 nm处的吸收峰近乎消失,表明RhB分子发生了分解[14]。

图5 超声处理时间对RhB模拟废水脱色率的影响
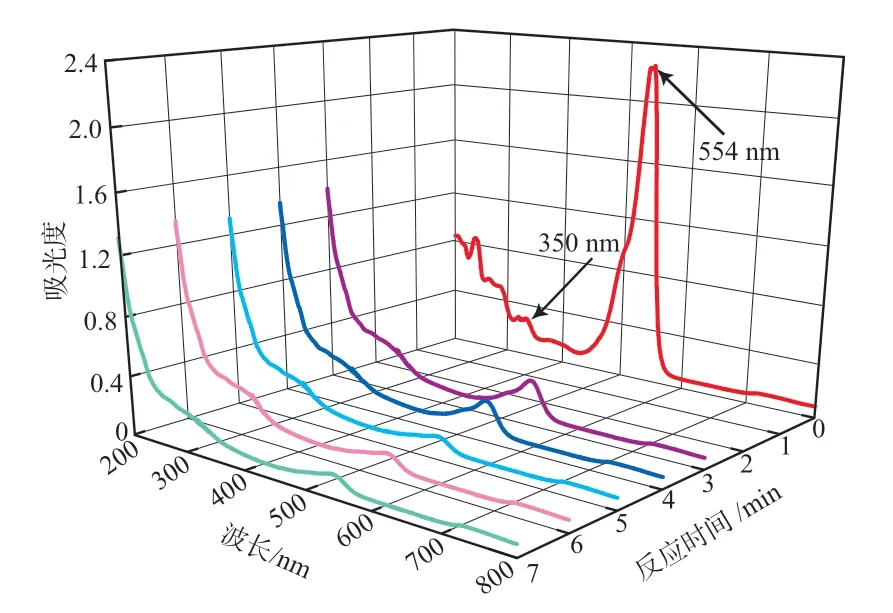
图6 反应过程中RhB模拟废水的紫外-可见吸收光谱谱图
2.6 不同处理方法的比较
在反应温度25 ℃、初始pH 5.18、超声功率250 W、K2S2O8溶液加入量1.2 mL、NaHSO3溶液加入量1.2 mL、n(K2S2O8)∶n(Fe2+)=10的最优条件下,处理方法对RhB模拟废水脱色率的影响见图7。由图7可见:US体系及K2S2O8/NaHSO3体系的脱色率均较小且变化不大,说明单独US体系及K2S2O8/NaHSO3体系对RhB的降解效果不明显;US-K2S2O8/NaHSO3体系的脱色率高于K2S2O8/NaHSO3体系,说明US对K2S2O8/NaHSO3产生了活化作用;Fe2+-K2S2O8/NaHSO3体系的脱色率远高于US-K2S2O8/NaHSO3体系,说明Fe2+的活化作用明显大于US;US- Fe2+-K2S2O8/NaHSO3体系的脱色率远大于任何一种单独处理体系及其组合,说明产生了明显的协同效应。
采用表观一级反应动力学方程ln(ρ0/ρt) =kt(ρ0和ρt分别为初始及t时刻的RhB质量浓度,mg/L;k为表观速率常数,min-1)对图7中的数据进行拟合,结果见表1。

图7 处理方法对RhB模拟废水脱色率的影响

表1 不同反应体系的表观速率常数
US与Fe2+-K2S2O8/NaHSO3反应体系的协同作用可用速率常数增强因子f表示[15],见式(8)。
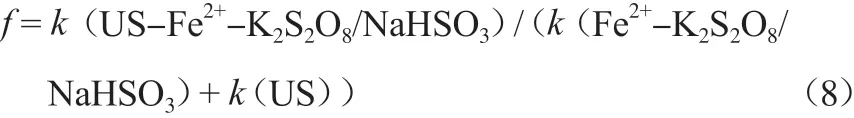
式中,k(US-Fe2+-K2S2O8/NaHSO3),k(Fe2+-K2S2O8/NaHSO3),k(US)分别为3种反应体系的表观速率常数。
由表1数据可计算出f= 13.6,因此可知US与Fe2+-K2S2O8/NaHSO3体系的协同作用是非常明显的。
2.7 机理研究
为进一步研究反应机理,采用甲醇、叔丁醇作为自由基捕获剂进行自由基淬灭实验。因甲醇与SO4-·和·OH的反应速率分别为(1.6~7.7)×107mol-1·s-1和(1.2~2.8)×109mol-1·s-1;而叔丁醇与SO4-·和·OH的反应速率分别为 (4.0~9.1)×105mol-1·s-1和(3.8~7.7)×108mol-1·s-1,所以可通过分别添加甲醇和叔丁醇来间接判定体系中存在的自由基种类[16]。在反应温度25 ℃、初始pH 5.18、超声功率250 W、K2S2O8溶液加入量1.2 mL、NaHSO3溶液加入量1.2 mL、n(K2S2O8)∶n(Fe2+)=10的条件下,自由基捕获剂种类对RhB模拟废水脱色率的影响见图8。
由图8可见,添加甲醇的US-Fe2+-K2S2O8/NaHSO3体系对RhB模拟废水的脱色率远小于未添加自由基清除剂及添加叔丁醇的体系,说明甲醇的抑制作用明显,而叔丁醇的抑制作用较小。以上自由基淬灭实验结果表明:RhB的降解主要归因于SO4-·和·OH的氧化作用;SO4-·是主要氧化活性物质。综上可推测出US- Fe2+-K2S2O8/NaHSO3体系可能的反应机理,见图9。

图8 自由基捕获剂种类对RhB模拟废水脱色率的影响
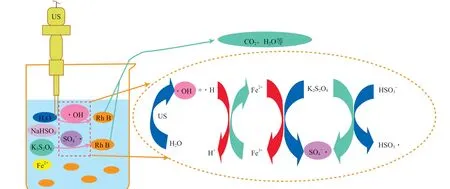
图9 US- Fe2+-K2S2O8/NaHSO3体系可能的反应机理
3 结论
a)US-Fe2+-K2S2O8/NaHSO3体系对RhB降解效果明显并产生了协同效应。在反应温度25 ℃、初始pH 5.18、超声功率250 W、K2S2O8溶液(4.91 mmol/L)加入量1.2 mL、NaHSO3溶液(4.91 mmol/L)加入量1.2 mL、n(K2S2O8)∶n(Fe2+)=10、反应时间7 min的较佳工艺条件下处理50 mL初始质量浓度为20 mg/L的RhB模拟废水,脱色率可达89.45%。
b)US-Fe2+-K2S2O8/NaHSO3体系对RhB的降解反应符合表观一级反应动力学,速率常数增强因子可达13.6。
c)SO4-·和·OH是攻击RhB分子的活性自由基,SO4-·起主要氧化作用。
