Cyr61作为对乙酰氨基酚致急性肝损伤的潜在预后生物学标志物研究
2020-10-22朱景丽黄亚彬何丽娟
朱景丽 黄亚彬 何丽娟
对乙酰氨基酚(N-acetyl-p-aminophenol, paracetamol, APAP)是一种广泛应用于临床的非处方解热镇痛药,过量使用APAP可导致严重的肝损伤[1]。当肝脏发生坏死损伤时,血清酶ALT和AST的升高可作为肝损伤的指标,然而它们对预测肝损伤或急性肝功能衰竭的严重程度并不敏感[2]。因此有必要寻找新型、特异性及灵敏度高的生物学标志物以指导临床诊疗工作。
Cyr61是结缔组织生长因子家族(CCN)的一员,在细胞增殖、黏附、迁移、血管生成和凋亡等方面发挥重要作用[3]。经研究发现Cyr61有希望成为急性心肌损伤及肾损伤的早期标志物[4-5]。在肝脏疾病研究中,Cyr61与促进肝纤维化的消退、肝星状细胞凋亡以及肝癌的发生有关[6]。目前尚无关于APAP诱导的肝损伤患者血浆或肝脏Cyr61水平变化的报道。因此,本研究通过制备APAP化学性急性肝损伤大鼠模型,检测大鼠血浆和肝脏中Cyr61浓度是否发生变化。
资料与方法
一、动物与试剂
健康SPF级雄性Wistar大鼠92只,体质量200~250 g,购自常州卡文斯实验动物有限公司。实验动物自由饮水和进食,饲养环境温度为22~25 ℃,循环光照(12 h亮/12 h暗),适应环境1周后开始实验。APAP处理前禁食12 h。APAP(美国Sigma公司),TRIzol裂解液(美国Invitrogen公司),PrimeScript 1st Strand cDNA Synthesis Kit(日本TAKARA公司),SYBR Premix Ex Taq(日本TAKARA公司),qRT-PCR引物(上海生物化工有限公司);鼠Cyr61 Elisa试剂盒(英国Abcam公司)。
二、实验方法
(一)急性肝损伤模型的制备 大鼠随机分为2组(每组n=10):对照组、APAP处理组。APAP处理组通过胃管给予250 g/kg体质量的APAP(重悬于0.9%生理盐水,加热溶解,终浓度为25 mg/mL),对照组胃管给予0.9%生理盐水[7]。处理24 h后处死大鼠,收集2组大鼠血清和肝组织,常规检测血清ALT和AST表达水平,肝组织检测超氧化物歧化酶(SOD)、丙二醛(MDA)、一氧化氮(NO)和谷胱甘肽(GSH)水平,结果示:与对照组相比,APAP处理组大鼠血清ALT和AST水平显著升高(P<0.05);APAP处理组肝组织中的SOD、GSH水平明显增加(P<0.05),MDA和NO水平显著降低(P<0.05),提示APAP诱导大鼠药物性肝损伤模型成功建立。
(二)动物处理 大鼠随机分为3组(每组n=24):对照组、APAP处理组、APAP+还原型谷胱甘肽(阿拓莫兰, GSH)治疗组(模型建立24 h后尾静脉注射GSH 400 mg/kg)[8]。每组在模型建立后在1 h、2 h、4 h、8 h、12 h、24 h分别取4只大鼠留取血清,常规检测ALT、AST。收集血清后处死大鼠,留取肝组织部分进行实时荧光定量PCR(qRT-PCR)检测。
(三)qRT-PCR测肝组织Cyr61 mRNA相对水平 TRIzol法提取血浆和肝组织的mRNA,260 nm波长测得RNA浓度,经逆转录获得cDNA,使用SYBR Green扩增目的基因,GAPDH作为管家基因,2-△△Ct法计算mRNA表达水平的变化倍数,引物序列如下:Cyr61前引物(5′-3′)CGCGAAGC-AACTCAACGAGG,后引物(5′-3′)GAGACAGTTCTT-GGGGACACA;GAPDH前引物(5′-3′)TGCTGGTGCTGA-GTATGTCG,后引物(5′-3′)AGTTGGTGGTGCAGGATGC。
(四)酶联免疫吸附测定法(Elisa)检测血清Cyr61表达:根据试剂盒说明书进行操作,绘制标准曲线计算Cyr61浓度。
三、统计学分析
结 果
一、大鼠血清ALT、AST表达水平变化
在APAP处理后2 h,血清ALT水平开始升高(P<0.05),2 h~12 h期间随处理时间延长,血清ALT水平越来越高(P<0.05),24 h时趋于平稳(12 h与24 h表达无差异,P>0.05);血清AST变化水平规律与ALT一致。
二、大鼠血清Cyr61表达水平变化
在获得Elisa数据后,绘制标准曲线,根据回归方程y=227.12x+8.96(y值为浓度,x值为OD值,R2=0.998)计算Cyr61浓度水平。如表1所示,与对照组相比,APAP处理组大鼠血清Cyr61水平在1~8 h逐渐升高(P<0.05),8 h和12 h的表达水平无差异(P>0.05),24 h时Cyr61表达水平降低(P<0.05);APAP+GSH治疗组血清的Cyr61水平明显低于APAP处理组(P<0.05),且与APAP处理组一致,Cyr61水平升高于8 h和12 h趋于稳定(P<0.05,8 h与12 h相比无统计学差异,P>0.05),24 h降低(P<0.05)。
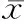
表1 三组大鼠血清Cyr61表达水平变化(±s, pg/mL)
三、大鼠肝脏Cyr61 mRNA表达水平变化
如图1所示,APAP处理组大鼠造模1~8 h的肝脏Cyr61 mRNA水平呈上升趋势,8 h时到达峰值,12和24 h时表达水平下降,组间差异有统计学意义(P<0.05);与APAP处理组相比,APAP+GSH治疗组大鼠的Cyr61转录水平与APAP处理组相比明显降低(P<0.05),差异有统计学意义(P<0.05)。

a表示在APAP处理组间,与1 h比较,P<0.05;b表示APAP处理组与APAP+GSH治疗组比较,P<0.05。图1 三组大鼠肝脏Cyr61 mRNA表达相对水平
讨 论
在过去的几十年里,APAP诱导的急性肝损伤在世界各国中较为常见[9]。临床上通过测定ALT和AST水平以监测和评估APAP诱导的肝损伤情况,但这些指标缺乏特异性。为更好地进行评估患者预后,寻找更特异的急性肝损伤生物学标志物是目前的研究重点。
近年来人们对Cyr61的研究逐渐增多,目前已知其为细胞外基质交联的血管调节因子。有研究通过建立大鼠肾脏急性缺血再灌注(I/R)模型检测Cyr61表达量,发现Cyr61在肾损伤中的变化规律[10]。目前尚无关于Cyr61与急性肝损伤的研究数据,我们通过建立APAP诱导急性肝损伤模型,检测Cyr61 mRNA发现其变化同样具有规律性,在造模后1 h肝组织表达Cyr61水平升高,2~8 h逐渐升高至峰值,12~24 h时逐渐降低;APAP+GSH治疗组Cyr61的表达明显低于APAP处理组,变化规律与其一致。而在血清中,我们检测到在造模后1 h,Cyr61表达水平升高,2~8 h逐渐升高至峰值,12 h趋于平稳,24 h时Cyr61水平降低;APAP+GSH组Cyr61水平显著低于APAP处理组,且Cyr61变化规律与APAP处理组一致。以上结果提示我们,Cyr61在APAP所致急性肝损伤及治疗后损伤减轻情况的评估有一定指导意义。另外,Cyr61在大鼠肝脏发生急性损伤后的表达水平变化均早于ALT及AST,提示Cyr61可能是针对APAP所致急性肝损伤更为敏感和特意的生物学指标,值得在临床研究中进一步证实。
