猪丹毒活疫苗活菌计数参考品的研究
2020-10-22李春雪杨丽萍王秀丽辛凌翔罗玉峰
刘 博,张 媛,袁 璐,曾 雪,李春雪,杨丽萍,王秀丽,辛凌翔,李 建,罗玉峰
(1.中国兽医药品监察所,北京 海淀 100081;2.辽宁益康生物股份有限公司,辽宁 辽阳 111000;3.哈药集团生物疫苗有限公司,黑龙江 哈尔滨 150069)
猪丹毒是由猪红斑丹毒丝菌(Erysipelothrixrhusiopathiae,E.rhusiopathiae)引起猪的一种急性、热性传染病[1]。急性型猪丹毒具有病程短、死亡率高等特点,再加上抗生素药物使用的局限性,采用疫苗免疫接种是防控猪丹毒的首选[2-3]。
二〇一五版《中国兽药典》中收录的猪丹毒活疫苗有猪丹毒活疫苗GC42株、猪丹毒活疫苗G4T10株以及猪瘟、猪丹毒、猪多杀性巴氏杆菌病三联活疫苗[4]。活菌计数是猪丹毒类活疫苗质量标准一个重要的检验参数。本试验制备并标定了一批猪丹毒活疫苗活菌计数参考品[5],以期可以对猪丹毒类活疫苗活菌计数进行质控,以保证疫苗活菌计数检验结果的客观公正,提高检验工作效率。
1 材料与方法
1.1 材料 猪丹毒活疫苗活菌计数参考品由辽宁益康生物股份有限公司制备。活菌计数用马丁琼脂以及马丁肉汤培养基由中海生物科技有限公司提供。活菌计数用马血清、一次性吸管,均购自赛默飞世尔科技(中国)有限公司。培养皿购自青岛金典生化器材公司。
1.2 方法
1.2.1 猪丹毒活疫苗活菌计数参考品的制备 采用猪丹毒杆菌弱毒株GC42制备一批(500瓶)猪丹毒活疫苗活菌计数参考品。按照现行《中国兽药典》三部猪丹毒活疫苗质量标准对参考品的性状、纯粹检验、活菌计数、真空度测定、剩余水分等参数进行检验[6]。检验参数均合格后,随机抽取100瓶,快递至A单位、B单位和C单位,收到样品后及时放入-70 ℃以下冰箱中保存。
1.2.2 培养基的筛选 委托中海生物科技有限公司采购来源不同的6个批次的猪胃。按照《中国兽药典》二〇一五版附录中配方,配制了6批相应的马丁琼脂以及马丁肉汤培养基[7]。随后随机选取3瓶参考品,由2名检验员分别用6批次培养基对参考品进行计数并进行t检验以及稳健统计分析。根据结果选择适宜的培养基,统一换成翻口胶塞后,随机挑选100瓶马丁肉汤和100瓶马丁琼脂,邮寄至B单位和C单位。
1.2.3 均一度检验 由2名检验员随机抽取10瓶参考品进行计数,分析变异系数。
1.2.4 参考品的协作标定 依照《中国兽药典》2015年版三部通则“生物制品国家标准物质制备和标定规定”,协作标定一共有A、B、C三家单位参加,每家单位2名检验员,每名检验员对3瓶参考品进行活菌计数,每瓶参考品进行2次重复试验[8]。统计不同检验员在不同时间、不同实验室活菌计数的结果。根据CNAS-GL02:2006《能力验证结果的统计处理和能力评价指南》中稳健统计方法[9],计算Z比分值,去掉了可疑及不满意的数据,将剩余数据计算出平均值和标准差,并将平均值加减2个标准差作为定值范围。
1.2.5 运输稳定性试验 考虑参考品在实际应用中会存在长距离运输的情况,进行运输过程的模拟,以评估参考品的稳定性。首先由A单位2名检验员随机抽取3瓶参考品进行计数。随后在夏季和冬季分别让B、C两家单位寄3瓶参考品至A单位(运输条件为将样品与生物冰袋放置在隔热泡沫箱内,运输时间48 h左右),再由A单位2名检验员进行计数。
1.2.6 加速热稳定性试验 参考品保存温度为-70 ℃,试验中进行了加速热稳定性试验,以考核参考品在不同存放温度下的稳定性。随机抽取参考品,分别置于2~8 ℃、25 ℃、37 ℃、-20 ℃条件下,每隔7 d随机抽取3瓶进行活菌计数,共监测6周,评估参考品的稳定性。
1.2.7 参考品的保存期试验 考虑到对保存期的延长有助于同批次参考品的应用,参考品的保存期被制定在了-70 ℃。每2个月对参考品进行一次标定,并与协作标定的数据进行比较。每3个月对参考品的剩余水分含量、真空度进行测定。每6个月对参考品的性状、纯粹性进行测定。与初始值进行比较,以探索参考品的保存期。
1.2.8 参考品在检验中的初步应用 在检验工作中对参考品进行了初步应用。同一名检验员在5个批次检品的检验中均同时对参考品进行计数,作为结果判定的标尺。
2 结果
2.1 参考品的制备与检验 猪丹毒活疫苗活菌计数参考品性状为海绵状疏松团块,易与瓶壁脱离,加生理盐水后迅速溶解。纯粹检验结果为5/5纯粹生长。真空度测定结果为5/5紫色辉光。剩余水分测定结果为2.2%、2.4%、2.2%、2.2%,均小于3.0%。活菌计数结果为9.8×108CFU/头份。
2.2 培养基的筛选 a、b两名检验员使用6批培养基对3瓶参考品计数(计数单位为×107CFU/头份),1号培养基计数结果为142、98、98、117、136、114;2号培养基计数结果为100、117、120、114、114、104;3号培养基计数结果为124、98、100、116、118、104;4号培养基计数结果为137、104、116、112、122、100;5号培养基计数结果为127、110、114、106、108、110;6号培养基计数结果为110、117、126、120、113、104。
分别将2、3、4、5、6号培养基的计数结果与1号培养基计数结果进行t检验,结果提示,相互之间没有显著差异,即6个批次的培养基质量无显著差异。将每批次的培养基6个计数结果进行稳健统计分析,比对检验员数据的稳定性。1~6号培养基稳健分析结果(Z值)分别为1.0、-0.8、-1.5、0.5、3.4、2.7;-1.8、0.8、0.4、-0.3、-0.4、0;-0.1、-0.8、-1.3、0.3、0.4、0;0.7、-0.3、0、-1.1、1.1、-1.3;0.1、0.2、-0.1、-3.1、-1.5、1.7;-1.1、0.8、0.9、1.5、-0.5、-0.1。选择检验员数据较为稳定的(Z值绝对值之和最小)3号培养基作为后续试验所用的培养基。
2.3 均一度检验 2名检验员随机抽取10瓶参考品进行计数(计数单位为×107CFU/头份)。检验员a计数平均值为108,标准差为7.8,变异系数7%;检验员b计数平均值为106.5,标准差为6.8,变异系数为6%。2名变异系数均小于10%,说明样品均一度良好。
2.4 协作标定 对3家单位协作标定结果进行稳健统计分析(计数单位为×107CFU/头份)。A单位计数结果/Z值分别为99/-0.4、95/-0.8、103/-0.1、76/-2.3、91/-1.1、83/-1.8、124/1.6、137/2.8、120/1.3、122/1.5、116/1.0、104/0.0;B单位计数结果/Z值分别为101/-0.3、106/0.2、107/0.3、121/1.4、97/-0.6、96/-0.7、111/0.6、117/1.1、112/0.7、117/1.1、102/-0.2、104/0.0;C单位计数结果/Z值分别为96/-0.6、115/0.9、96/-0.6、102/-0.2、112/0.7、94/-0.9、99/-0.4、103/-0.1、109/0.4、102/-0.2、108/0.4、97/-0.6。
去掉2个可疑及不满意的数据(Z绝对值大于等于2),将剩下的34个数据计算出平均值(105)和标准差(10),参考品每头份含活菌数为8.5×108~12.5×108CFU。
2.5 运输稳定性试验 B、C两家单位分别于2017年12月以及2018年7月寄3瓶参考品至A单位,A单位2名检验员对一共12瓶样品进行计数(计数单位为×107CFU/头份)。参考品夏季经过运输后,2名检验员计数结果分别为98、95、89、90、83、89、101、95、106、92、105、97;冬季经过运输后,2名检验员计数结果分别为96、97、90、89、99、101、112、101、95、103、98、95。计数结果均在参考品定值范围内,说明在48 h内的运输过程中参考品计数值可以保持稳定。
2.6 加速热稳定性试验 分别于第7天、第14天、第21天、第28天、第35天、第42天对保存于不同条件下的参考品进行计数,结果见图1。
参考品在37 ℃保存7 d后,计数值降到协作标定的定值范围之外;在25 ℃保存14 d后,计数值降到协作标定的定值范围之外;在2~8 ℃保存参考品35 d后,计数值降到协作标定的定值范围之外;在-20 ℃ 保存42 d后,计数值仍在协作标定的定值范围内。加速稳定性试验结果符合参考品的特性。
2.7 参考品的保存期试验 分别于协作标定后第2、4、6、8、10、12、14、16月和18月由3家企业6名检验员按照对参考品进行计数,在稳健统计剔除不满意数据后,对剩余数据的平均值和中位值进行了分析,结果见图2。
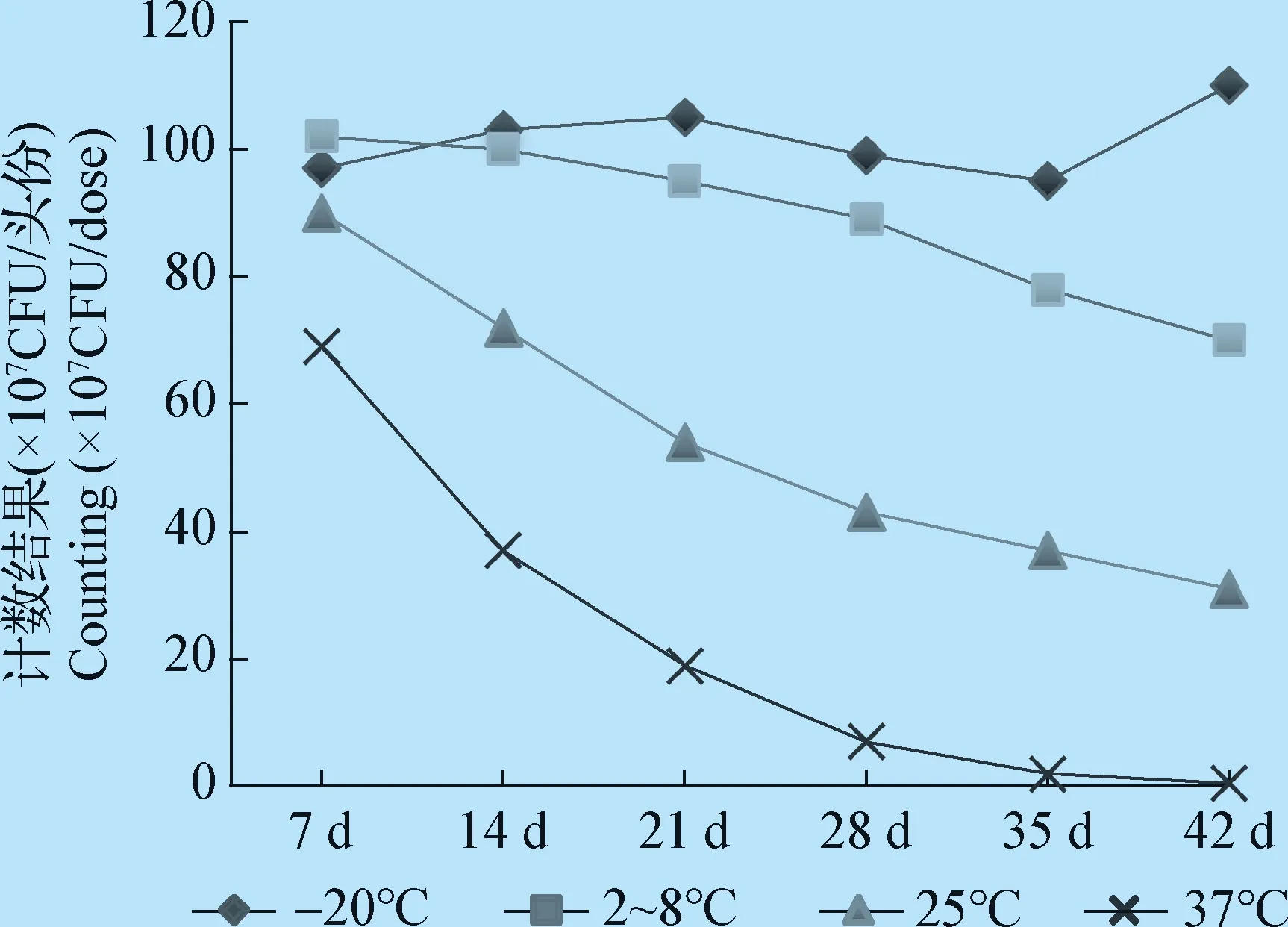
图1 参考品加速热稳定性试验Fig.1 Heat stability test of reference substance
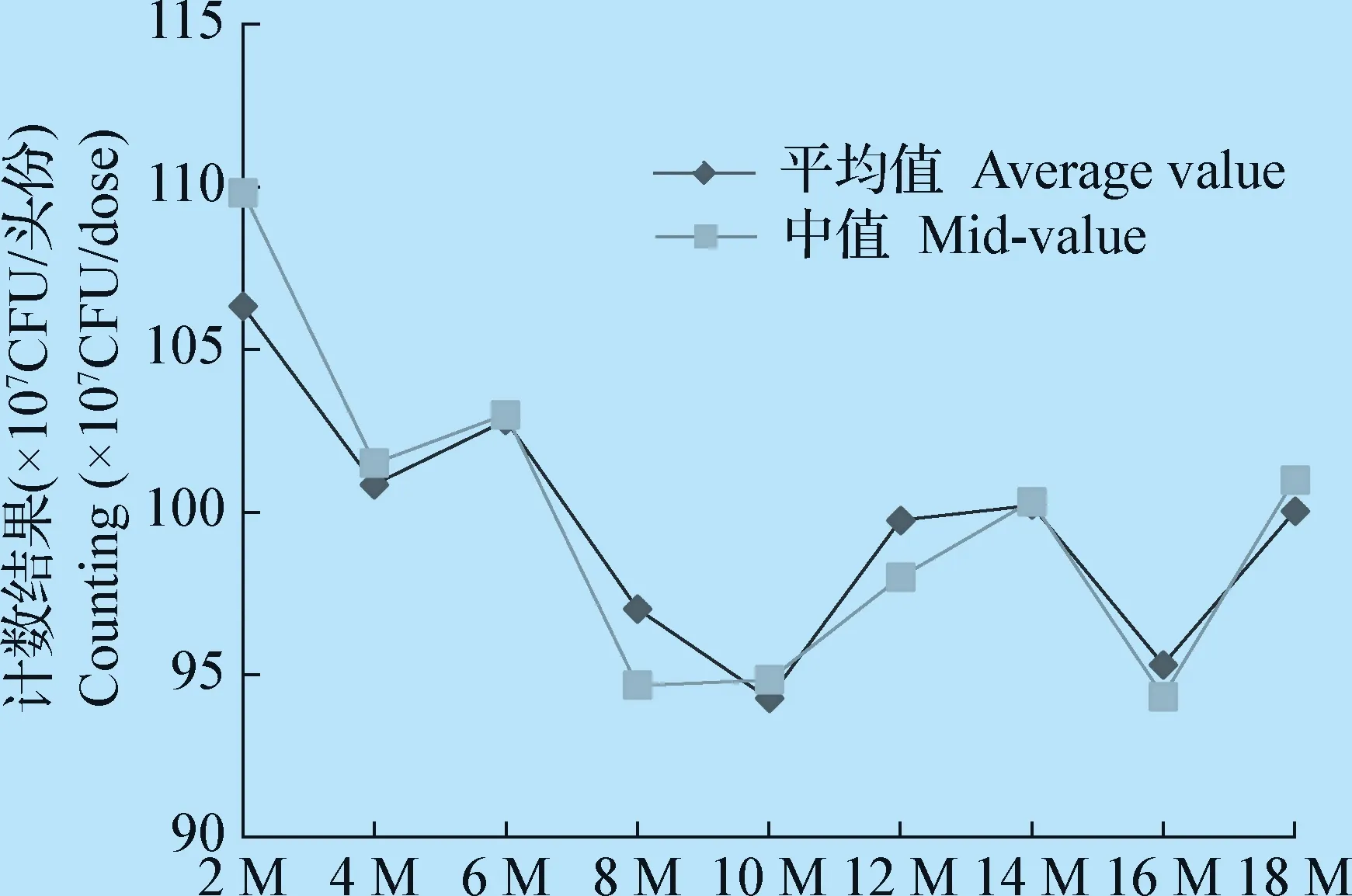
图2 参考品的保存期探索Fig.2 Retention period of reference substance
结果可见,每组数据的平均值和中位值均落在参考品的定值范围内,说明参考品保存在-70 ℃其活菌值可在18月内保持稳定。
于第3、6、9、12、15月和18月对参考品的剩余水分含量、真空度进行测定;于第6、12月和18月对参考品性状、纯粹性进行测定。结果提示,参考品性状、纯粹性、剩余水分含量在-70 ℃保存条件下,在18个月内稳定;真空度在3个月后,出现部分失真空的现象。
2.8 参考品的初步应用 在检验工作中,对参考品进行了初步应用。同一名检验员在5个批次的检验中均用到了参考品。结果见表1。
4次检验结果为参考品以及待检疫苗检验结果均合格。值得注意的是,在第5批次疫苗检验时,出现参考品不在赋值范围内,但待检疫苗合格的情况。出现这种情况,应该直接重检还是判定合格,还值得讨论。
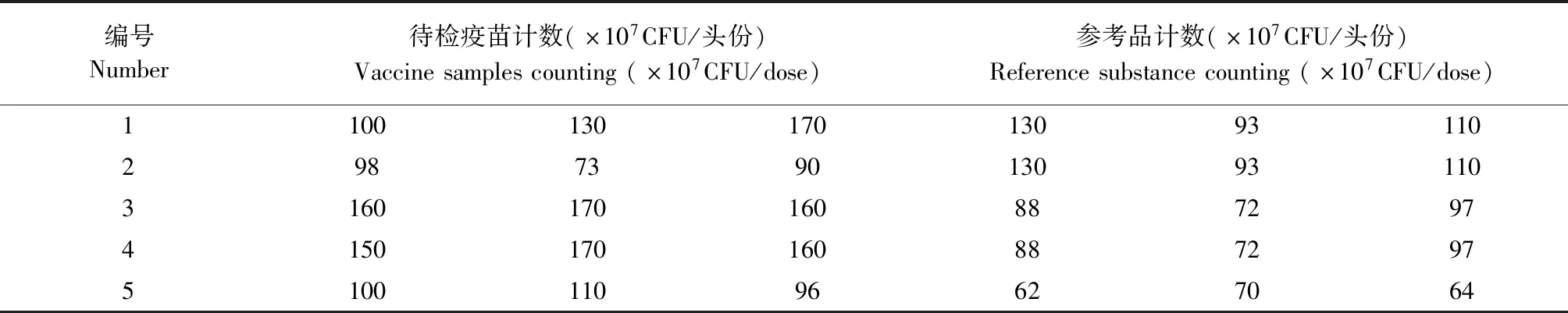
表1 参考品的初步应用Table 1 Initial application of reference substance
3 讨论
农业农村部于2018年5月19日正式启动实施兽用抗菌药使用减量化行动。兽用细菌类疫苗将逐渐取代抗生素,成为细菌类疫病防控的主力。细菌类疫苗的质量控制,是保证其发挥有效防控效果的关键。
在细菌类活疫苗的检验工作中,活菌计数是最基本的一个检验参数,通过对菌数进行测定,不仅能够评价疫苗的免疫效力,还可以在效力检验免疫攻毒法中确定强毒攻毒的剂量。保障活菌计数结果的有效性和准确性,是细菌类生物制品检验工作的一个重点。为排除培养基和人员操作给活菌计数结果带来的不确定性,使用活菌计数参考品,可以对检验过程进行监督,使检验结果更为准确[10]。
根据《中国兽药典》三部通则“兽用生物制品国家标准物质制备和标定规定”、《中华人民共和国药典》三部通则“生物制品国家标准物质制备和标定规程”[11]以及《国家药品标准物质协作标定的技术要求与管理程序》[12]中对生物制品国家标准物质制备及标定的要求,本试验对猪丹毒活疫苗活菌计数参考品进行了制备和标定。参考品的性状、纯粹性、活菌计数、剩余水分含量、真空度均符合《中国兽药典》中猪丹毒活疫苗质量标准。由2名检验员对其均一性进行检测,变异系数分别为7%和6%。通过协作标定,对参考品定值为每头份含活菌数为8.5×108~12.5×108CFU。参考品在夏季和冬季由泡沫盒加冰袋的方式进行运输不超过48 h,数值稳定;其性状、纯粹性、剩余水分含量、参考品菌数均可在18个月内可保持稳定。目前本实验室仍在对本批次参考品的保存期进行监测,以期待可以延长其保存期。
由于本批参考品使用青瓶压橡胶塞及卡铂帽包装,保存于-70 ℃时,出现了包装口不再密闭而导致的失真空现象。然而由于保存条件稳定,失真空并未对剩余水分含量及菌数造成影响。为了确保参考品的真空度,在以后参考品的生产过程中可以考虑用安瓿分装。在对参考品进行试应用时曾出现参考品计数结果不合格,但是待检疫苗计数合格的现象。《美国兽医生物制品法规和技术标准》内补充检验方法一章中规定,如果出现这种情况本次检验判定为无检验结果,采取企业内部质检过程中的检验数据作为计数最终结果[10]。考虑到中国国情,这类判定方法在中国不适用,因此针对本参考品,如果出现这种情况,考虑判定为本次检验无效,应进行重检。
