稳定表达犬瘟热病毒基质蛋白的细胞系Vero-SLAM-M的构建
2020-10-22林佳旭王介淞杨雅明
林佳旭,王介淞,杨雅明,黄 娟,单 虎
(青岛农业大学动物医学院,山东 青岛 266109)
犬瘟热 (Canine distemper,CD) 是一种可导致多种动物共患的高度接触性传染病,在自然条件下,最为易感的动物以犬科、鼬科、猫科等肉食兽为主,感染后的死亡率极高。其病原犬瘟热病毒(Canine distemper virus,CDV)属于副黏病毒科(Paramyxoviridae) 麻疹病毒属(Morbillivirus)[1],为有囊膜的单股负链 RNA 病毒,主要编码有 6 个结构蛋白,其中,基质蛋白(Matrix protein,M)是最小的结构蛋白,约为 37 kD,具有高度保守性[2],在病毒的感染中起到极其重要的作用[3]。
免疫接种是目前防制犬瘟热的主要手段,灭活苗对CDV强毒攻击不能提供完全的保护,因此,弱毒活疫苗被广泛应用于犬和经济动物犬瘟热的防制。商品化犬瘟热弱毒疫苗的疫苗毒株多是通过将分离的强毒株经异种动物(雪貂等)、鸡胚或细胞连续传代以致弱,如CDV/R-20/8株、Onderstepoort株等,但是这种致弱方法获得的弱毒株存在毒力返强的风险,而且疫苗株对野生动物有不同程度的致病性[4];少数商品化犬瘟热弱毒疫苗的疫苗毒株是从自然界分离筛选获得的自然弱毒株,如用于狐狸的CDV-11株,是从体温一过性升高的犬分离获得,对犬、貉、水貂、狐狸均安全[5],但该疫苗株在动物体内可自主复制,在免疫接种时存在散毒风险,对野生动物的安全性也未知。与传统致弱方式相比,以反向遗传学为基础,利用病毒拯救及点突变毒力相关位点的方法获得减毒株,具有病毒致弱方式明确、疫苗更加安全等优点[6-8];将病毒基因组某个复制必须蛋白基因缺失,获得病毒复制缺陷毒株,该毒株只能在提供该蛋白的细胞上复制,在其他细胞或动物体内均无复制性,已经在其他负链病毒,如水泡性口炎病毒获得成功[9]。CDV M蛋白既是复制必须蛋白,也是毒力相关蛋白[10-12],是构建CDV复制缺陷毒株的理想靶蛋白。
本试验旨在建立一种能稳定表达狐狸源犬瘟热病毒 M 蛋白的细胞系,该细胞系可为后续CDV复制缺陷毒株的拯救提供复制许可细胞,也可为CDV M 蛋白功能的进一步研究提供一种过表达细胞。
1 材料与方法
1.1 材料
1.1.1 质粒、细胞、犬瘟热病毒及阳性血清 质粒pCI-neo、质粒pEGFP-N1、Vero-SLAM 细胞、狐狸源犬瘟热病毒分离毒株SD16F、犬源犬瘟热病毒阳性血清均由本实验室保存。
1.1.2 主要试剂和仪器XhoI 和NotI 限制性内切酶、T4 DNA 连接酶和ExTaq酶等,均购自 TaKaRa 公司;无内毒素质粒小量提取试剂盒、DMEM 培养基、G418 硫酸盐溶液,均购自生工生物工程(上海)股份有限公司;转染试剂Lipo2000,购自Invitrogen 公司;兔抗犬 IgG 二抗,购自北京博奥森生物技术有限公司。
1.2 方法
1.2.1 重组质粒 pCI-neo-M 的构建
1.2.1.1 PCR 扩增 根据本实验室保存的犬瘟热流行毒株 SD16F 的核苷酸序列,应用Primer 5.0 软件在保守区设计上、下游引物,SD16F-M-F:5′-CCGCTCGAGGCCACCATGACTGAGGTGTACGACTT-CG-3′;SD16F-M-R:5′-ATAAGAATGCGGCCGCTTAGAGAATTTTGAAAAGACCCTG-3′,序列中有下划线的部分为XhoI 和NotI 酶切位点,有黑色加粗下划线的部分为 Kozak 序列,以犬瘟热流行毒株 SD16F 为模板,进行 PCR 扩增。PCR 反应体系为:dNTP 2 μL、M上游引物 1 μL、M下游引物 1 μL、cDNA 2 μL、ExTaq酶 0.5 μL、10×PCR Buffer 2.5 μL、ddH2O 16 μL。扩增程序为:94 ℃预变性 5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸1 min 30 s,共 30个循环;72 ℃终延伸 10 min。
1.2.1.2 载体的构建与鉴定 PCR 产物进行 1% 琼脂糖凝胶电泳,经胶回收后,胶回收产物与 pCI-neo 载体同时经XhoI 和NotI 限制性内切酶双酶切,T4连接酶连接过夜,连接产物转化大肠杆菌 DH5α 感受态细胞,挑取单个菌落摇菌培养后,进行菌液 PCR 鉴定,鉴定为阳性的菌液提取重组质粒,经酶切鉴定为阳性的重组质粒,经测序验证序列正确。阳性重组菌大量培养后经无内毒素质粒小量提取试剂盒提取质粒使其达到可转染细胞用标准,检测质粒浓度后,标记放置于-80 ℃ 冰箱待用。
1.2.2 细胞瞬时转染及M基因表达鉴定
1.2.2.1 细胞转染 转染前1天,取生长状态良好,细胞密度适宜的 Vero-SLAM 细胞铺 96 孔板,待细胞密度达到 85% 左右,将 pCI-neo-M 重组质粒用无血清 opti-MEM 培养液做适当稀释后,参照转染试剂 Lipo2000 说明书,以0.2 μg/孔剂量转染至 96 孔细胞培养板中,并设置 pEGFP-N1 对照孔、pCI-neo 空质粒对照孔、脂质体对照孔和未转染细胞对照孔。转染后的细胞在 37 ℃、5% CO2培养箱中培养。
1.2.2.2 RT-PCR 鉴定 转染细胞 48 h 后,在倒置显微镜下观察空质粒转染组和脂质体转染组细胞无异常,在倒置荧光显微镜下观察 pEGFP-N1 对照孔有绿色荧光,表明转染试验成功。提取 pCI-neo-M 转染孔、细胞对照组孔细胞总 RNA,经DpnI 酶处理后进行 RT-PCR 试验检测目的蛋白的转录。
1.2.2.3 间接免疫荧光鉴定 以犬瘟热病毒阳性血清为一抗、兔抗狗 IgG 为二抗对 pCI-neo-M 转染组、未转染细胞对照组进行 IFA 试验验证 M 蛋白的表达情况。
1.2.3 Vero-SLAM-M 细胞系的构建
1.2.3.1 细胞 G418 筛选浓度的确定 取传代后生长状态良好、细胞密度适宜的 Vero-SLAM 细胞经胰酶消化后,使用细胞计数板计数,铺满 24 孔板,细胞数为 2×104个/孔,培养过夜后吸去细胞培养液,用PBS清洗细胞2次,每孔加入含有不同浓度梯度 G418 的 DMEM 筛选培养基(浓度依次为 0、100、200、300、400、500、600、700、800、900、1 000 μg/mL和1 100 μg/mL),每个梯度设 2 个重复孔。每 3 d 更换1次筛选培养基,连续培养 10~14 d,每天观察记录细胞的死亡情况,以第 10 天细胞全部死亡的最低 G418 浓度为 Vero-SLAM 的最适筛选浓度。
1.2.3.2 细胞转染及克隆筛选 按“1.2.2.1”步骤以 2 μg/孔的剂量将 pCI-neo-M 重组质粒转染至 6 孔板 Vero-SLAM 细胞中。转染后的 Vero-SLAM 细胞培养 3 d 后更换含最适 G418 筛选浓度的 DMEM 筛选培养基,每 3 d 换新的筛选培养基,连续培养 12 d。每天观察细胞的生长状态,待对照孔细胞达到 90% 以上死亡时,用胰酶消化存活的 Vero-SLAM 细胞,适当稀释后传入 25 cm2细胞培养瓶中。如此连续克隆阳性细胞 3 次,筛选2~3株 可稳定表达M的 Vero-SLAM 细胞 G418 抗性克隆株。将阳性细胞克隆株更换为一半最适 G418 筛选浓度的 DMEM 培养基连续传代 10 次以上,按常规方法冻存、复苏,观察该抗性克隆株传代的稳定性。
1.2.3.3 M 基因转录及蛋白表达水平的检测 选取 1 株 Vero-SLAM-M 细胞克隆株的第 F5、F10 代细胞提取总RNA,按照“1.2.2.2”方法对克隆株进行 mRNA 水平检测;以犬瘟热病毒阳性血清为一抗、兔抗犬 IgG 为二抗对 Vero-SLAM-M 细胞克隆株F10代按“1.2.2.3”方法进行 IFA 试验验证 M 蛋白的表达情况,同时设置未转染重组质粒pCI-neo-M 的 Vero-SLAM 细胞作为阴性对照组。
1.2.3.4 细胞生长曲线测定 取传代后生长状态良好、密度适宜的 Vero-SLAM-M 细胞系经胰酶消化后,使用细胞计数板计数,铺24孔板,细胞数为 2×104个/孔,共18孔。连续培养细胞至 6 d,每培养24 h取3孔细胞计数取平均值。同时设其亲本 Vero-SLAM 细胞对照,根据计数结果绘制细胞一步生长曲线。
2 结果
2.1 pCI-neo-M 表达载体构建 以狐狸源犬瘟热流行毒株 SD16F 为模板,按方法“1.2.1.1”PCR 扩增获得与预期大小(1 008 bp)相符目的片段(图1)。该片段克隆至 pCI-neo 质粒,经XhoI 和NotI 限制性内切酶双酶切后,获得大小约为 1 008 bp和5 427 bp的2个条带(图2),测序结果表明,真核表达载体构建成功,并命名为pCI-neo-M。
2.2M基因的瞬时表达 pCI-neo-M 重组质粒瞬时转染Vero-SLAM细胞后,提取细胞总RNA,RT-PCR扩增获得与预期大小(1 008 bp)相符目的片段(图3)。经 IFA 试验验证,pCI-neo-M转染组细胞在荧光显微镜下观察有特异性绿色荧光(封三彩版图4),表明pCI-neo-M质粒能在Vero-SLAM细胞中表达M蛋白。
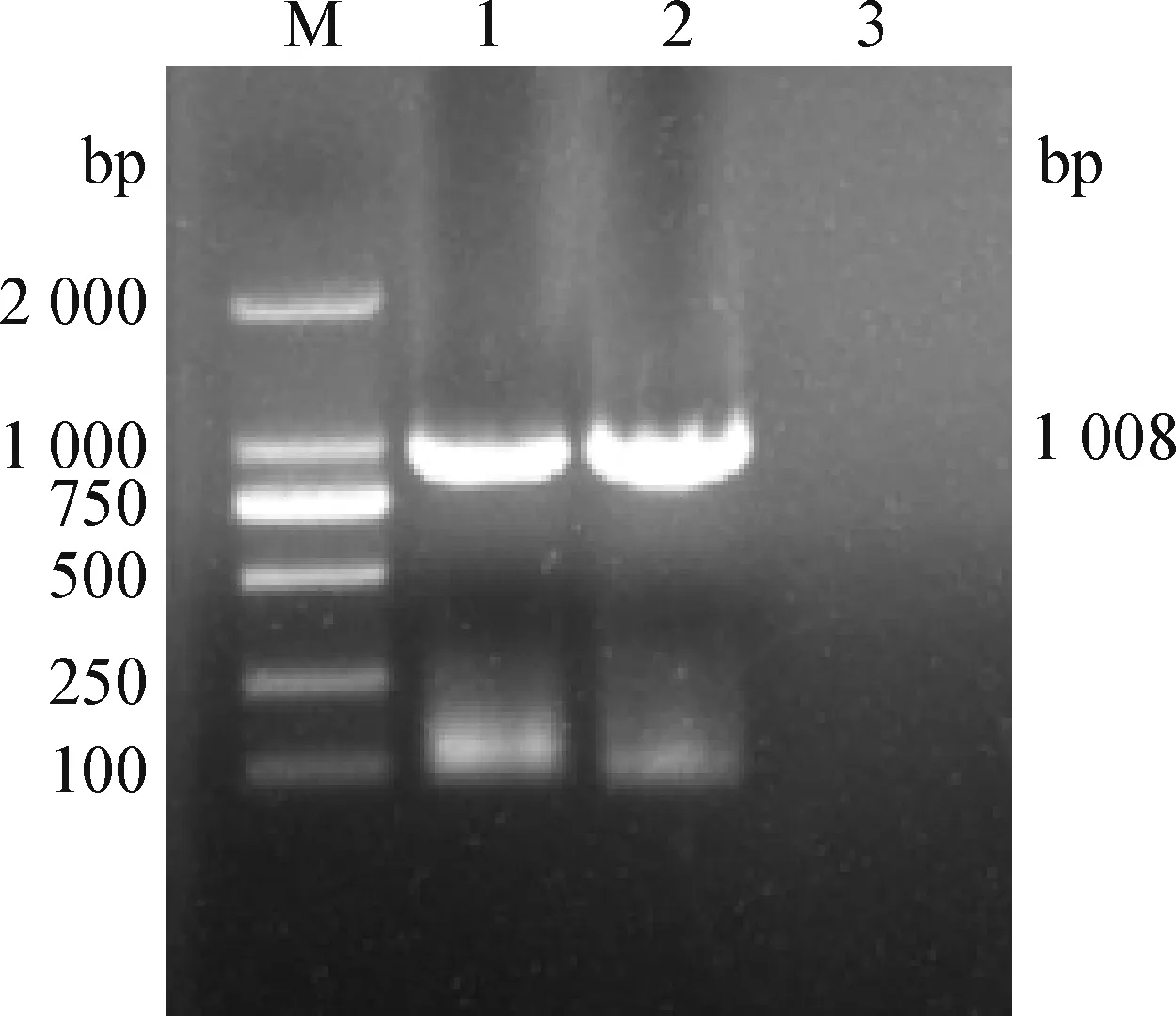
图1 M 基因的扩增结果Fig.1 Amplification results of M geneM:DL-2 000 DNA 分子量标准;1~2:M 基因的PCR 产物;3:阴性对照M:DL-2 000 DNA Marker;1~2:PCR product of M gene;3:Negative control
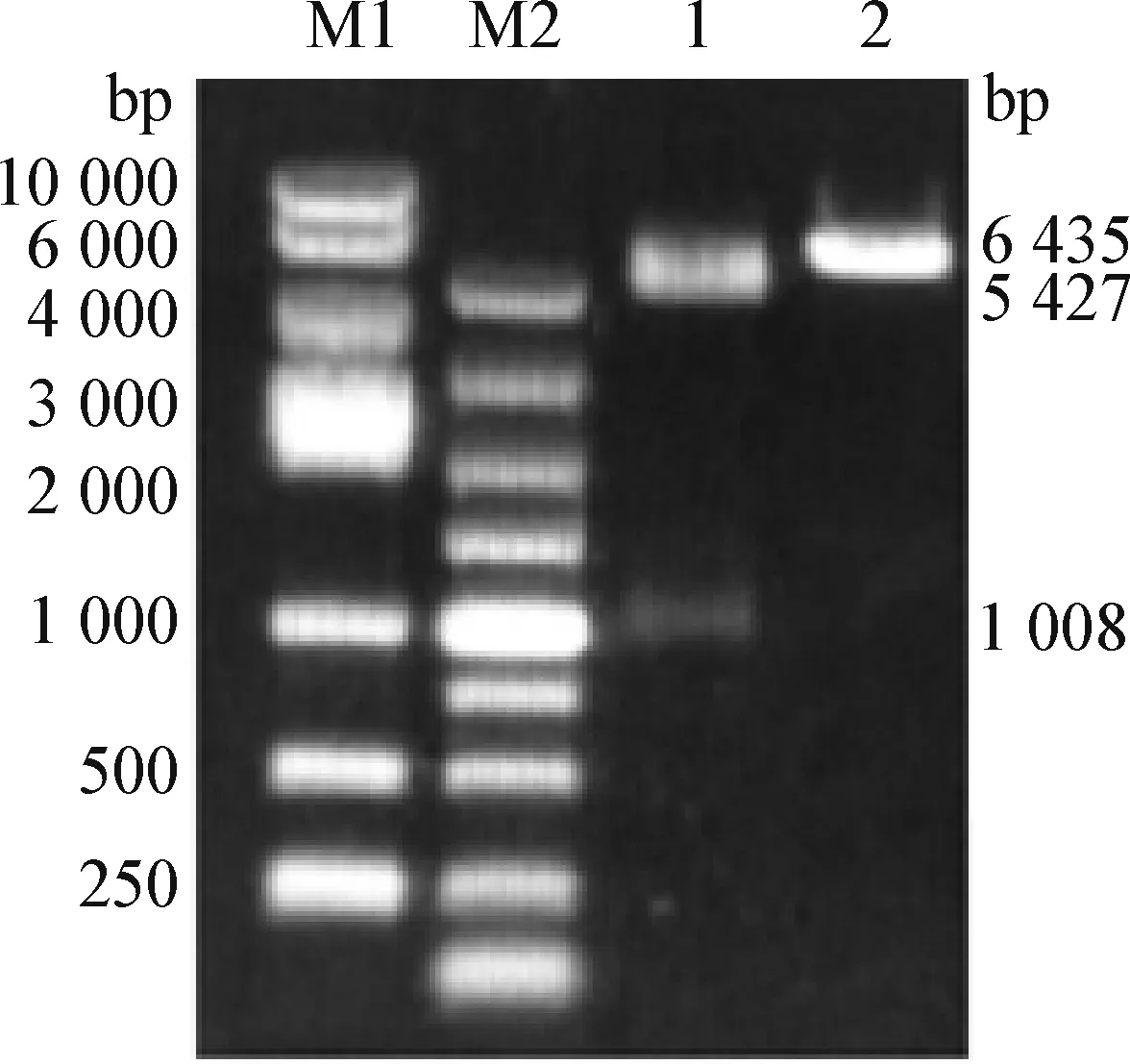
图2 重组质粒酶切鉴定结果Fig.2 Digestion results of recombinant plasmidM1:DL-10 000 DNA 分子量标准;M2:DL-5 000 DNA 分子量标准;1:重组质粒用 Xho I/ Not I 酶双酶切;2:重组质粒用 Xho I 酶单酶切M1:DL-10 000 DNA molecular weight standard;M2:DL-5 000 DNA molecular weight standard;1:Recombinant plasmid digested by Xho I/ Not I;2:Recombinant plasmid digested by Xho I
图3 RT-PCR鉴定M 基因的转录Fig.3 Expression of M gene identified by RT-PCRM:DL-2 000 DNA 分子量标准;1:转染空质粒的Vero-SLAM细胞;2:转染重组质粒的Vero-SLAM细胞M:DL-2 000 DNA Marker;1:Vero-SLAM cells transfected with pCI-neo;2:Vero-SLAM cells transfected with pCI-neo-M
2.3 G418 最适浓度测定结果 Vero-SLAM 细胞加入不同梯段浓度G418培养液后,从第2天起500 μg/mL及以上浓度筛选组均有少量细胞死亡。筛选至10 d,300 μg/mL组达到40%细胞死亡,700 μg/ mL组达到90%细胞死亡,超过900 μg/mL各组细胞均已全部死亡(封三彩版图5),确定Vero-SLAM 细胞对G418最适筛选浓度为 900 μg/mL。
2.4 Vero-SLAM-M 细胞系的构建 对G418筛选细胞克隆株的F5、F10代进行M基因 mRNA 的 RT-PCR 检测,结果显示均扩增得到1 008 bp特异性阳性条带(图6),证明 F5、F10 代均有M基因的转录。以犬瘟热病毒阳性血清为一抗、兔抗犬IgG为二抗的间接免疫荧光试验证明M基因在细胞克隆株的F10 代仍有蛋白水平的表达(封三彩版图7)。将该稳定表达M蛋白的细胞株命名为 Vero-SLAM-M 细胞。
图6 pCI-neo-M稳定转染细胞后的RT-PCR鉴定Fig.6 Identification of pCI-neo-M in stably transfected cells by RT-PCRM:DL-2 000 DNA 分子量标准;1:pCI-neo-M稳定转染Vero-SLAM细胞(F5 代);2:pCI-neo-M稳定转染Vero-SLAM细胞(F10 代)M:DL-2 000 DNA Marker;1:The F5 passage of Vero-SLAM cells transfected stably with pCI-neo-M;2:The F10 passage of Vero-SLAM cells transfected stably with pCI-neo-M
2.5 Vero-SLAM-M 细胞系生长曲线 Vero-SLAM-M 细胞系连续传代 10 代以上,经过冻存、复苏后,该细胞系的生长周期、细胞传代后的状态依然较为稳定。通过细胞培养和细胞生长曲线发现,该细胞系与其亲本 Vero-SLAM 细胞生长特性基本保持一致(图8)。
3 讨论
利用脂质体转染技术和 G418 药物筛选技术,成功构建出了可稳定表达犬瘟热病毒M基因的 Vero-SLAM-M细胞系。为了有效的提高M基因的表达水平,本试验在M基因上游引入了能增强蛋白翻译功能的Kozak序列[13]。本试验选用的载体pCI-neo,为新霉素筛选标记,是不带EGFP荧光蛋白的载体,因此无法借助其表达的强绿色荧光来辅助细胞克隆的挑选纯化。但表达载体与Vero-SLAM细胞基因组完成随机重组后 EGFP 蛋白表达是无法直接反映出M基因表达量的,因此仍需借助IFA试验来完成M基因蛋白表达量的鉴定[14]。因本实验室尚未获得针对M蛋白的特异性单克隆或多克隆抗体,本试验采用犬源犬瘟热病毒阳性血清作为一抗,兔抗犬 IgG 作为二抗,通过间接免疫荧光试验验证了M蛋白的瞬时表达和稳定表达。
图8 Vero-SLAM-M 细胞系和 Vero-SLAM 细胞系一步生长曲线Fig.8 Growth curve of the Vero-SLAM-M cells and Vero-SLAM cells
本试验收集了 Vero-SLAM-M 细胞系 F5、F10代及其亲本Vero-SLAM 细胞,分别提取细胞总 RNA 后进行 RT-PCR 试验,试验结果证明,M基因在该 Vero-SLAM-M 细胞克隆株的 F5、F10 代次中均有转录水平的表达。以犬瘟热病毒阳性血清为一抗、兔抗犬 IgG 为二抗的间接免疫荧光试验证明,M基因在该 Vero-SLAM-M细胞克隆株的 F10 代仍有蛋白水平的表达。绘制 Vero-SLAM-M 细胞系与其亲本 Vero-SLAM 细胞系生长曲线测定结果显示,2种细胞系在生长特性及生长周期等方面基本保持一致,Vero-SLAM-M 细胞系培养到第4天时进入对数生长期,5 d 时进入细胞生长平台期。在培养的1~5 d 中带M基因重组质粒的细胞系生长情况与亲本细胞差异并不大,但在第5天当其达到细胞数量的顶峰后,带有重组质粒的细胞系凋亡速度明显慢于普通亲本细胞,且细胞数量的顶峰值要高于亲本细胞,推测产生此现象的原因可能是 G418 的压力作用导致 Vero-SLAM-M 细胞生长密度增加,且细胞更为耐受。
虽然国内外研究人员陆续研制出不同类型的犬瘟热疫苗[15],但目前仍多依赖于弱毒疫苗对犬瘟热进行预防,但弱毒苗在使用过程中存在着一定的缺陷,例如毒力返祖、极易引起一过性免疫抑制、首免易受母源抗体干扰等情况[16],还会促进CDV野毒的基因进化[17]。因此,近些年更多的研究人员致力于寻求更为安全有效的新型疫苗。随着分子生物学技术和基因工程技术的深入发展与广泛应用,犬瘟热病毒新型疫苗得到广泛的研制与发展,如基因工程亚单位疫苗及重组活载体疫苗等[18-19],新型疫苗的开发极大的克服了常规疫苗的不足。本试验建立的细胞系为后续犬瘟热病毒致病机制的研究带来了极大的方便,也为犬瘟热病毒 M 蛋白的功能测定及新型犬瘟热基因工程疫苗的研制创造了便利条件。
