低盐冰温脱水牡蛎的贮藏性
2020-10-22张毅万金庆杨帆冷争争
张毅,万金庆,2,3*,杨帆,冷争争
1(上海海洋大学 食品学院,上海,201306) 2(上海水产品加工及贮藏工程技术研究中心,上海,201306) 3(农业部水产品贮藏保鲜质量安全风险评估实验室(上海),上海,201306) 4(安徽宜康高新农业科技有限公司,安徽 六安,237200)
牡蛎是一种双壳软体动物,肉质柔软,味道鲜美,销售形式主要为带壳销售或出售去壳肉制品[1]。研究表明,长时间运输和保活过程会使牡蛎的外观、气味和腐败菌含量发生显著变化,有效的贮藏手段是牡蛎品质安全的重要保障[2]。牡蛎常见的贮藏方式有干制、冷藏和冻藏,近年来超高压处理、气调包装、涂膜及轻度热处理等技术在牡蛎贮藏研究中受到广泛关注[3-4]。然而牡蛎干制过程时间较长,干制后营养成分损失严重,冷藏贮藏期短难以满足消费要求,冻藏贮藏期6个月,但冻结过程中冰晶刺破细胞,解冻后营养成分流失严重,品质降低[5]。近年来牡蛎的贮藏研究大都从贮藏的外在环境条件着手,通过优化贮藏条件提升贮藏品质,本研究回归牡蛎本身,以低盐冰温脱水方式降低牡蛎自身水分含量,以期改善其贮藏品质。
牡蛎含水率>80%,是其不耐藏的重要原因,目前低盐(<6%)高水分(>50%)食品符合人们健康饮食需求,市场反响良好[6-7]。20世纪70 年代,冰温技术出现,以其贮藏过程中食品不冻结、贮藏品质高和贮藏周期长受到广泛关注。本实验以质量分数1%NaCl盐水注射,冰温脱水至含水率(60±1)%,得到低盐冰温脱水牡蛎。目前,类似研究还未见报道,本文通过探究其在冷藏和冰温条件下的贮藏特性,为牡蛎高品质流通提供理论支持。
1 材料与方法
1.1 样品处理
质量为(150±10) g的整只太平洋牡蛎(Crassostreagigas),购于南汇新城农贸市场,置于冰盒中快速运回实验室。洗净表面,开壳取肉。称重记录牡蛎肉总质量及单个质量,按牡蛎总质量的1%(质量分数)确定食盐用量并配制成饱和食盐水,通过单个牡蛎质量与牡蛎总质量之比确定单个牡蛎饱和食盐水注射量(例如:某批实验牡蛎肉样品共3 600.0 g,则总食盐用量为36.0 g。室温20 ℃下食盐溶解度为36 g/100 g水,饱和食盐水密度1.33 g/cm3。需要饱和食盐水共136.0 g,约102.3 mL),假设某只牡蛎去壳后质量为25.0 g,按1%(质量分数)计算注射量为:
(1)
用2.5 mL无菌注射器模拟盐水注射机进行注射,注射点选择闭壳肌中心以及沿腮丝方向约5 mm位置的牡蛎组织,注射过程中闭壳肌周围开始均匀渗液,组织缓慢充盈则视为均匀,批量生产可利用盐水注射机实现。
经盐水注射的牡蛎置于冰温干燥装置托盘进行脱水处理(图1),电脑操作界面通过图1中的质量传感器实时监测牡蛎含水率变化,冰温真空脱水至含水率为(60±1)%时,停止脱水过程,取出物料。牡蛎样品低盐冰温脱水后1个/包进行封装,封装好的牡蛎分别置于冷藏条件(4.0±0.5) ℃和冰温条件[(-2.0±0.5) ℃]下进行贮藏,每3 d测定1次。对于实际生产中牡蛎含水率控制,可参照冻干食品的方法,先在实验机上得到工艺参数,再移植到生产机上。
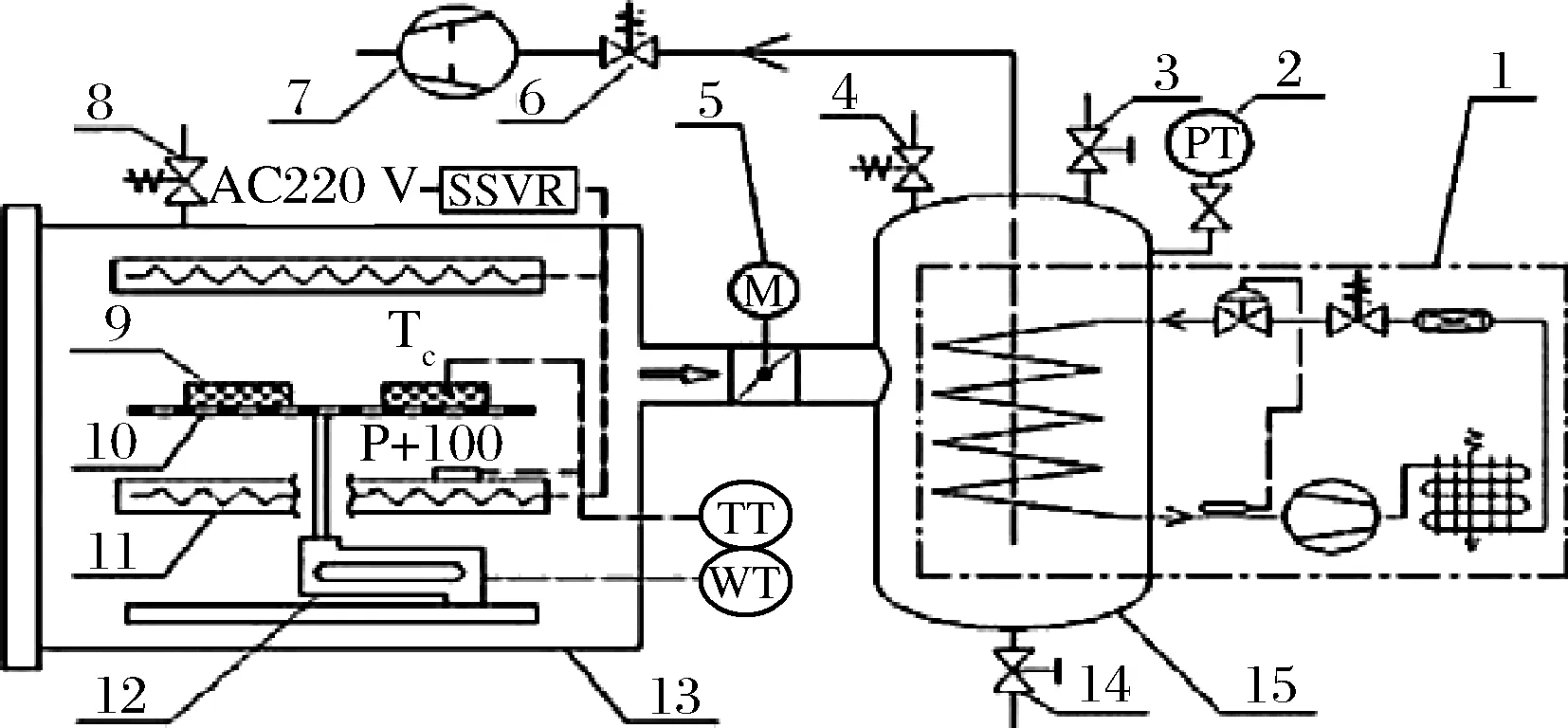
1-冷阱制冷机组;2-真空压力变送器;3-手阀;4-放气阀;5-电动蝶阀;6-止油阀;7-真空泵;8-漏气阀; 9-物料;10-托盘;11-电加热板; 12-质量传感器;13-真空箱;14-排水阀;15-冷阱图1 冰温干燥装置Fig.1 Controlled freezing-point dried device
1.2 实验仪器
VS-1300-SU型超净台,江苏净安泰集团;LHS-150HC恒温恒湿箱,上海一恒科学仪器有限公司;Kjeltec2300 凯氏定氮仪,丹麦福斯公司;H-2050R-1 高速冷冻离心机,湘仪离心机有限公司;PQ 001纽迈台式脉冲核磁共振分析仪,上海纽迈公司;CM1100冷冻切片机,德国徕卡测量系统有限公司;Eclipse E200生物显微镜,日本尼康仪器有限公司;课题组自行研制的冰温干燥装置[8],该装置与现有冻干装置主要不同点在于脱水过程中物料温度始终控制在其冰温带内,避免了冷冻引起的蛋白质变性、组织结构受到破坏等问题。
1.3 实验方法
1.3.1 感官评定
参考HE等[8]和CHEN等[9]方法,略有改动。小组由经过训练的10人组成,每隔3 d分别对冰温贮藏组和冷藏组进行感官评定,感官评价见表1,每组设置3个平行样。分别从牡蛎的气味、组织色泽和闭壳肌色泽、组织质地、外套膜色泽和腮丝形态对牡蛎进行感官评价。感官评分分为4个等级(0、1、2和3分),得分越低代表整体质量越高,评价结果采用质量指数法(quakity index method,QIM)进行分析,当得分>9分时认为品质不可接受。

表1 牡蛎感官评定表Table 1 Sensory evaluation criterion for oyster
1.3.2 菌落总数测定
参考CHEN等[10]方法,略有改动。无菌操作取10 g牡蛎组织于无菌均质袋中,加入90 mL无菌生理盐水,均质1 min。吸取1 mL均质液进行10倍系列稀释,在不同测定时期选取2~3个合适稀释度,每个稀释度3个平行,吸取0.1 mL样品液接种于平板计数琼脂培养基,30 ℃培养48 h进行计数。
1.3.3 挥发性盐基氮测定
依据GB 5009.228—2016《食品中挥发性盐基氮的测定》[11]中的分析方法进行测定分析。
1.3.4 硫代巴比妥酸值测定
依据GB 5009.181—2016《食品中丙二醛的测定》[12]中的分析方法进行。
1.3.5 TCA-可溶性肽测定
参考KUMAR等[13]方法,略有改动。3 g样品加入27 mL 50 mg/mL的三氯乙酸(trichloracetic acid,TCA)溶液,组织匀浆1 min,置于4 ℃冰箱1 h,4 ℃、12 000×g离心10 min。牛血清白蛋白(bovine serum albumin,BSA)作为标准品,采用Lorry法[14]进行含量测定,结果以mg/g牡蛎样品表示。
1.3.6 低场核磁共振
参考李海涛[15]方法,略有改动。为防止水分流失,使用保鲜膜将牡蛎封闭包装。冰温贮藏和冷藏均放置于恒温恒湿箱中,设置2个平行样。每次测试结束后放回用于下一时间点的测试。将待测牡蛎进行低场核磁共振(low field nuclear magnetic resonance,LF-NMR)分析,确定检测参数后使用CPMG (carr-purcell-meiboom-gill)序列采集横向弛豫信号。采用70 mm射频线圈,参数如下:谱仪频率SF=21 MHz,采样频率SW=100 kHz,模拟增益RG1=20,脉冲时间P1=19 μs,脉冲时间P2=37 μs,数字增益DRG1=4,模拟增益RG1=20,前置放大增益PRG=1,采样点数TD=199 958,重复采样间隔时间TW=4 000 ms,累加次数NS=8,回波时间TE=0.4,回波个数NECH=5 000。
1.3.7 核磁成像分析
参考王硕等[16]方法,略有改动。保鲜膜封装牡蛎进行核磁成像(magnetic resonance imaging,MRI)分析,冰温贮藏和冷藏均放置于恒温恒湿箱中,每次测试结束后迅速放回用于下一时间点的测试。重复等待时间TR=550 ms,回波时间TE=20 ms,磁体线圈管直径70 mm,成像后的图片进行映射和伪彩处理。
1.3.8 微观组织结构观察
参考余文晖等[17]方法,选择牡蛎闭壳肌进行微观组织结构观察。
1.3.9 数据分析
采用SPSS Statistics 25、Excel 2013和Origin 8.5分析处理。
2 结果与分析
2.1 感官评价
QIM广泛用于水产品的感官评价,通过评价各个具体指标进行感官打分,每个参评指标的分数≤3分,使得单项得分对总分的影响更加均衡,各项指标得分相加得到最终感官评价分数[9]。感官评价结果见表2,贮藏期间,随着时间延长,牡蛎QIM得分越来越高,品质逐步下降。第0天时,冰温贮藏组和冷藏组在感官评价上无显著差别(P>0.05),但从第3天开始2组间感官评分开始差异显著(P<0.05),同一组别,不同贮藏时间内牡蛎的贮藏品质也显著不同(P<0.05)。冰温贮藏和冷藏过程中以气味、外套膜色泽和腮丝形态变化最为明显,这与CHEN等[10]结论一致。以9分作为品质接受界限,冰温组牡蛎的贮藏24 d,冷藏贮藏12 d后牡蛎品质变得不可接受。
表2 感官评价累计得分Table 2 Cumulative scores for sensory tests
2.2 菌落总数测定
牡蛎贮藏期间菌落总数变化如图2所示。贮藏初期,冷藏和冰温贮藏样品的初始菌落总数分别为4.02 lg CFU/g和3.97 lg CFU/g。依据107CFU/g作为牡蛎品质的不可接受界限[18],冰温条件下低盐冰温脱水牡蛎的贮藏期为24 d,在冷藏的基础上延长了1倍。研究表明低温条件下许多腐败菌仍能生长繁殖,部分腐败菌在0 ℃下也能存活[19]。但与冷藏相比,冰温条件下微生物繁殖速率显著降低,同时冰温脱水使得牡蛎自身水分含量(特别是微生物可直接利用的自由水)下降,微生物生长繁殖受到抑制,因此冰温贮藏条件与自身低含水率的特点是影响低盐冰温脱水牡蛎菌落总数增长速率的重要因素。
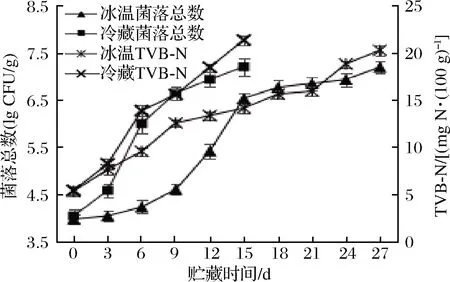
图2 牡蛎菌落总数和TVB-N变化Fig.2 Changes of total bacterial count and TVB-N of oysters
2.3 TVB-N测定
由于微生物和酶的共同作用使得蛋白质不断分解,尤其是对氧化三甲胺以及氨基酸侧链的作用,产生了具有挥发性的氨及胺类物质,使得TVB-N发生积累[20]。郭晓伟等[3]以20 mg N/100 g作为牡蛎品质的劣变界限,得出冷藏贮藏期为6 d,冰温贮藏期为12 d的结论,这是由于冰温抑制了相关酶及微生物作用,与冷藏相比减少了挥发性的氨及胺类物质的产生。如图2所示,冷藏条件第15天TVB-N值为21.32 mg N/100 g,冰温条件下贮藏TVB-N值第27天达到20.24 mg N/100 g,超过该界限值。综合分析表明,牡蛎经低盐冰温脱水处理后贮藏期明显提升。这可能是因为牡蛎冰温脱水后自身低含水率不利于微生物生长繁殖,与冰温条件有效结合形成栅栏效应,延长了牡蛎的贮藏期,弥补了自身因含水率高在传统贮藏过程中的不足。
2.4 TBA值测定
TBA值的大小反映脂质氧化情况,是评价水产品腐败情况的重要指标。图3表明牡蛎TBA值在冰温贮藏过程中增长缓慢,0 d为(0.19±0.01) mg MDA/kg,27 d达到(1.17±0.08) mg MDA/kg,冷藏条件下TBA值第15天上升至(0.70±0.05) mg MDA/kg,远高于冰温贮藏同期。原因可能是脂质氧化主要受到自由基链反应的影响,而冰温条件下脂肪酶活性降低,自由基形成受到抑制,链反应速率下降[21]。因此冰温贮藏有效延缓脂质氧化,与冷藏相比TBA值增加缓慢。
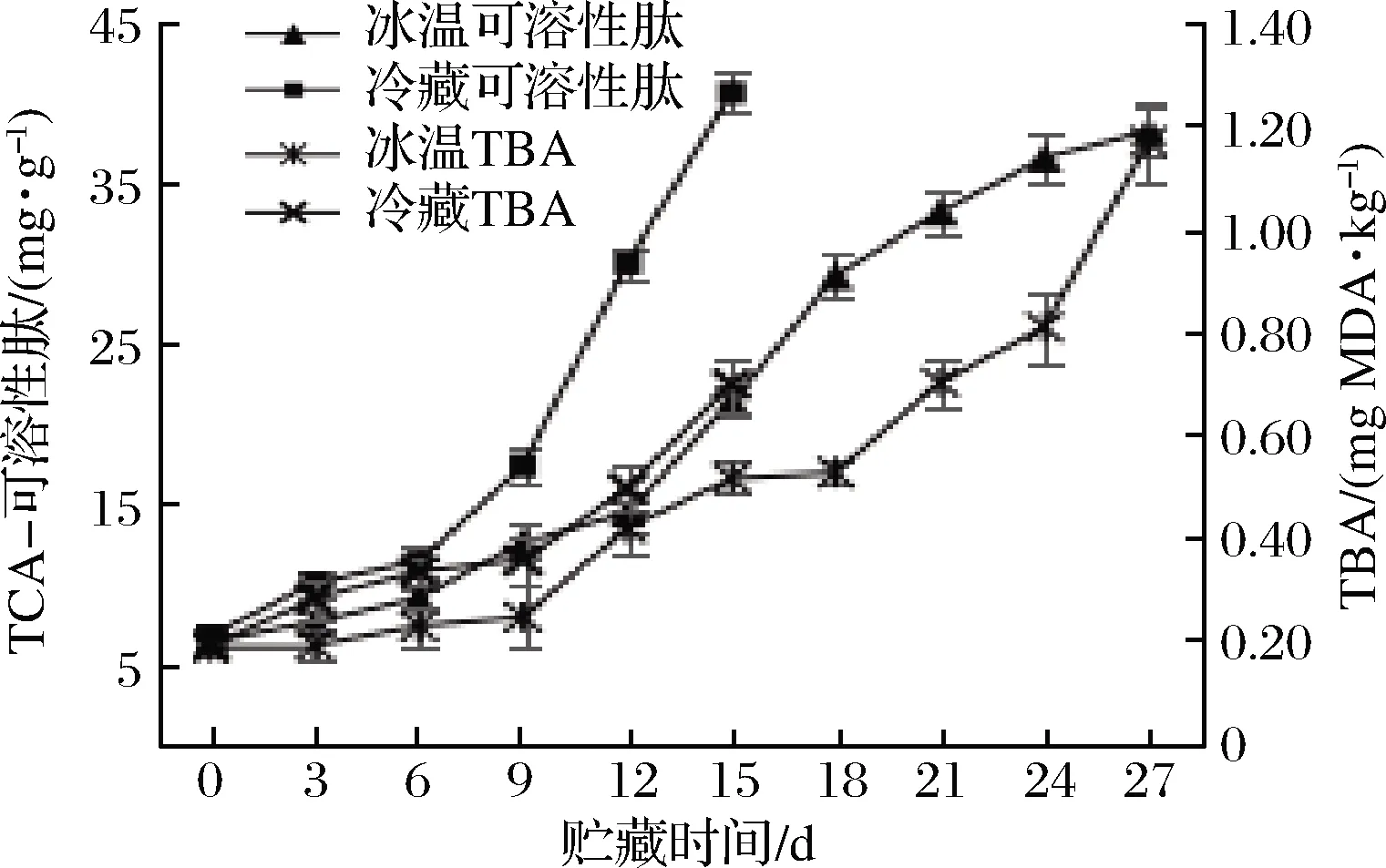
图3 牡蛎TCA-可溶性肽和TBA变化Fig.3 Changes of TCA-soluble peptide and TBA of oysters
2.5 TCA-可溶性肽测定
TCA-可溶性肽含量增加,说明贮藏过程中蛋白质发生变性和降解[22]。图3表明冷藏条件下TCA-可溶性肽含量增加更快,贮藏期内检测到的峰值更高,含量由(6.66±0.75) mg/g增加至(40.64±1.20) mg/g;冰温条件下,0 d TCA-可溶性肽含量为(6.29±0.90) mg/g,第27天达(38.25±1.40) mg/g。JIA等[23]研究表明,肌肉蛋白水解早期主要由内源酶产生作用,同时脂质氧化和非自由基(H2O2、脂质氢过氧化物)的修饰也能导致蛋白质变性和降解。冰温抑制内源酶活性,牡蛎脱水后由于自由水含量下降导致反应底物流动性降低,因此冰温贮藏结合低盐冰温脱水对延缓牡蛎蛋白质降解具有明显优势,贮藏过程中检测到的TCA-可溶性肽峰值低,增速缓慢。
2.6 LF-NMR分析
如图4所示,牡蛎在冰温和冷藏条件下的横向弛豫时间T2反演之后均稳定得到3个峰。峰T21出现在0~10 ms,为结合水,这部分水通常与大分子物质(蛋白质、淀粉)或者肌纤维紧密结合,其性质相对稳定;峰T22出现在10~100 ms,为不易流动水,这部分水通常存在于肌肉纤维内,贮藏过程中变化明显;峰T23>100 ms,为自由水,在贮藏过程中极不稳定[24]。3种不同状态水分的横向弛豫时间T2变化见表4。
如表4所示,在冰温和冷藏条件下,随着贮藏时间增加,3种水分的峰强度呈下降趋势,冷藏过程中下降明显,说明冷藏条件水分更易流失。2种贮藏条件下随着贮藏期延长,横向弛豫时间T22、T23呈明显下降趋势,T21规律性不强。贮藏时间增加,横向弛豫时间T2缩短,这说明在贮藏的过程中不易流动水和自由水的流动性减弱。因此,将横向弛豫时间T22、T23与传统品质指标感官评分、TVB-N和菌落总数进行Pearson 相关性分析,结果见表5。
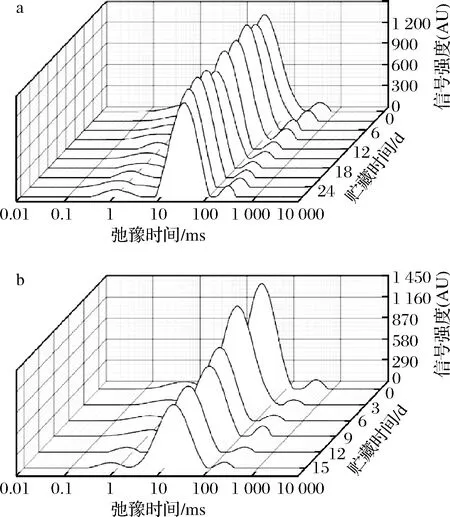
a-冰温贮藏; b-冷藏图4 冰温贮藏和冷藏条件下牡蛎的横向弛豫 时间T2反演图Fig.4 Inversion spectrum of transverse relaxation time T2 of oysters during ice temperature storage and cold storage
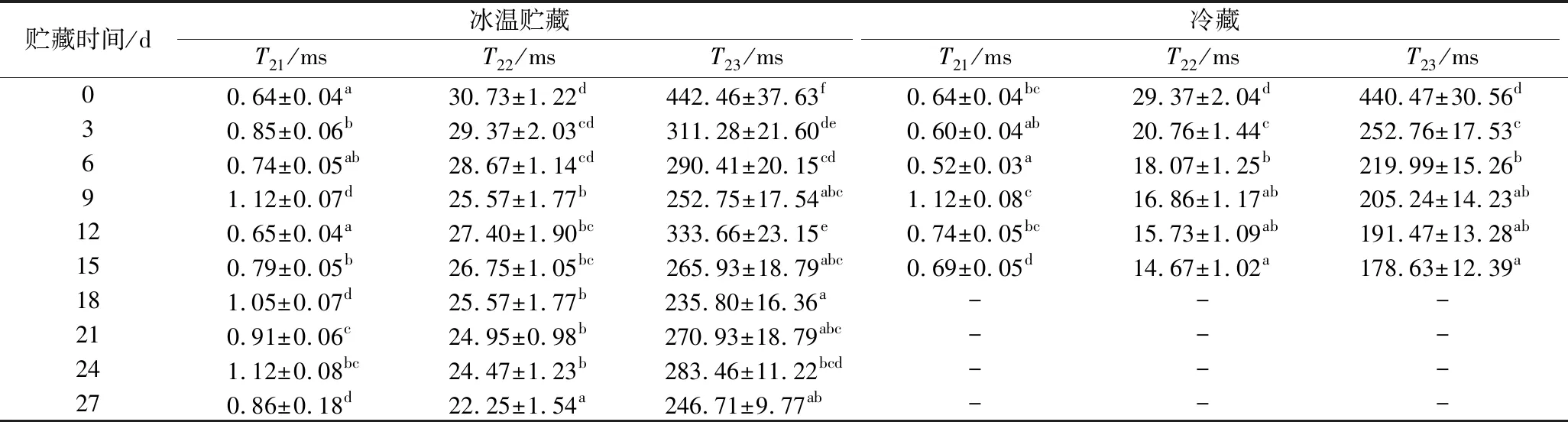
表4 牡蛎贮藏过程中横向弛豫时间T2的变化Table 4 Changes of transverse relaxation time T2 of oysters during storage

表5 牡蛎冰温和冷藏条件下横向弛豫时间T2与TVB-N、 感官评分及菌落之间的相关性分析Table 5 Linear regression analyses between transverse relaxation time T2 and TVB-N, sensory and total bacterial count
Pearson 相关性分析表明横向弛豫时间T22与牡蛎的品质变化显著相关(P<0.05)。横向弛豫时间T23仅与TVB-N相关性显著(P<0.05),这是由于自由水极不稳定,冰温脱水过程中自由水含量发生明显变化,使得贮藏过程中其迁移规律与牡蛎品质变化相关性降低。因此横向弛豫时间T22对该牡蛎样品的品质变化更具有指导意义。
反演峰T21、T22和T23的峰值面积可表示3种不同状态水分的信号幅值,各峰值面积占峰值总面积之比S21、S22和S23可以间接反映3种状态水分的相对含量[25],贮藏过程中其相对含量变化见图5。
蛋白质降解使得部分结合水被释放造成冰温和冷藏条件下S21显著降低2.66%和1.62%(P<0.05)。冰温条件下S23没有显著波动,冷藏条件下S23显著增加1.39%(P<0.05),自由水占比上升,说明水分流失加剧。冷藏条件下S22无显著变化,冰温条件下S22显著增加2.84%(P<0.05),不易流动水含量越高表明其保水性越好[26]。这可能是由于冰温条件下细胞为了防止冻结,细胞中由糖、醇和蛋白质等组成不冻液,使得水分流动性下降,流失减少。而在冷藏条件下水分向流动性更大的自由水迁移,保水性降低,水分流失增加,品质下降。

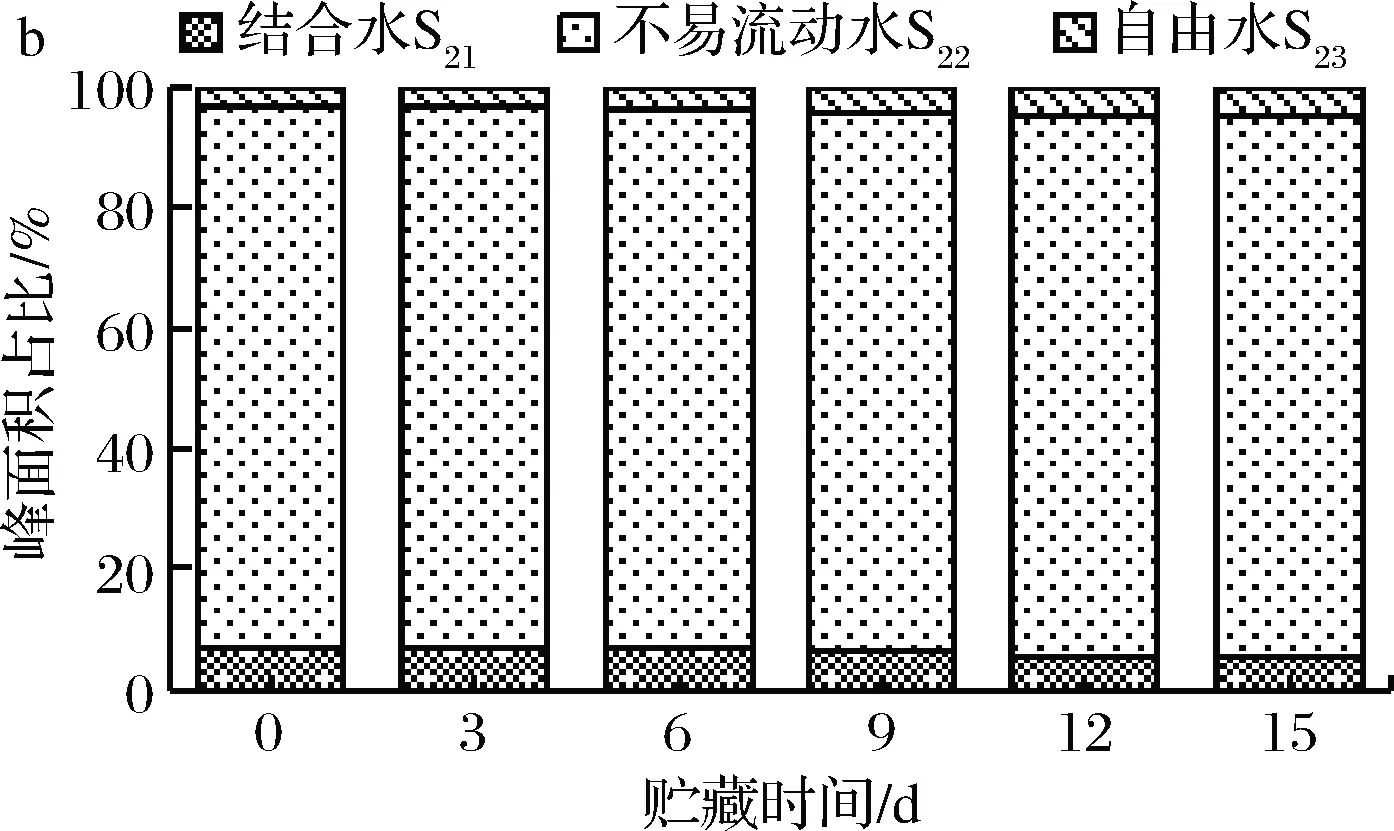
a-冰温贮藏; b-冷藏图5 冰温贮藏和冷藏过程中横向弛豫时间T2峰变化Fig.5 Changes of T2 peak distribution duringice temperature storage and cold storage
2.7 MRI分析
在MRI图中,红色区域对应高质子密度区域,蓝色区域对应低质子密度区域,进行映射和伪彩处理后的图像越趋近红色表明该区域的质子信号越强,水分含量越高[23]。冰温贮藏和冷藏过程中牡蛎MRI图见图6。牡蛎前处理过程中水分散失不均匀,MRI图显示0 d牡蛎质子密度中间强四周弱,随着贮藏时间延长,2种贮藏条件下腮丝部分几乎完全变为蓝色,水分流失明显。冷藏条件下,牡蛎整体质子密度降低,表明水分含量逐渐下降。冰温条件下,牡蛎局部质子信号随着贮藏时间延长逐渐增强,水分逐渐积累。前文分析表明冷藏条件下脂质氧化速率以及蛋白质的变性降解速率均高于冰温贮藏,这使得肌肉纤维之间间隙增加,结合紧密程度降低,加速水分向外扩散流失,这可能是冷藏条件下牡蛎质子密度明显降低的重要原因,而冰温条件下产生的不冻液在贮藏过程中积累造成牡蛎局部质子密度增强,这部分水流动性不强,该结果侧面验证了冰温贮藏过程中S22上升,不冻液与产品贮藏过程中的品质和风味密切相关,表明冰温贮藏与冷藏相比更有效提升牡蛎贮藏品质。
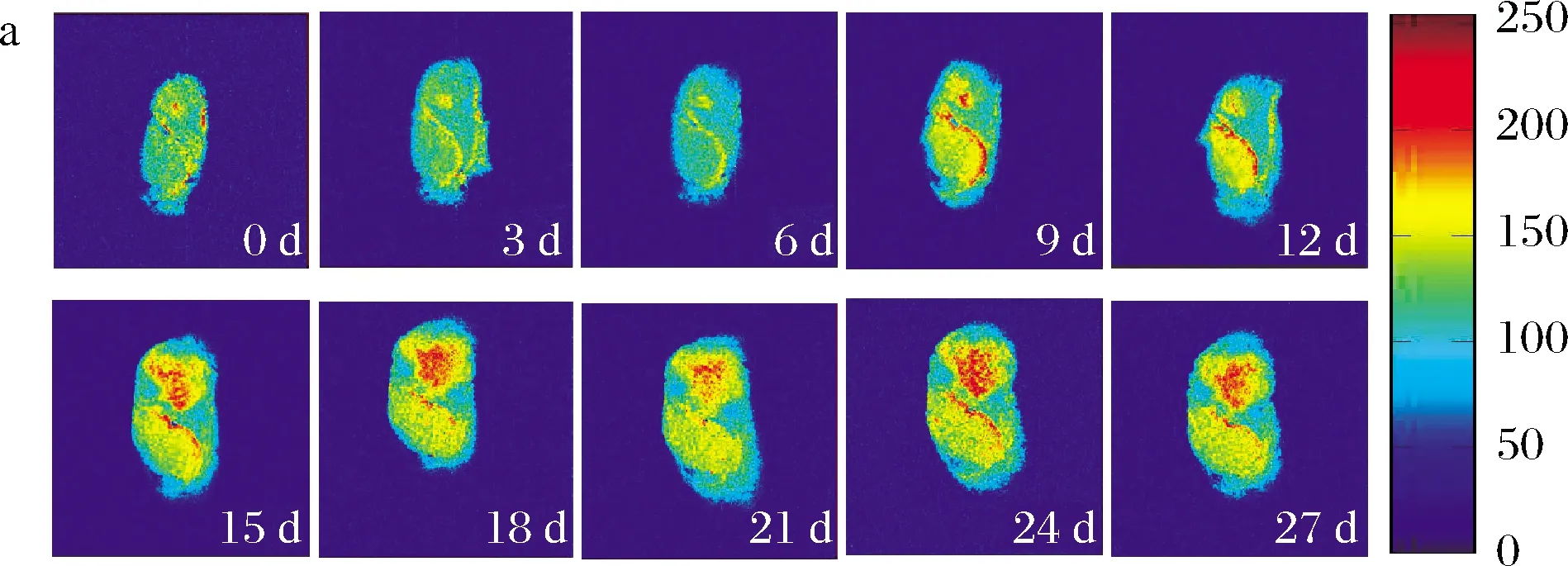
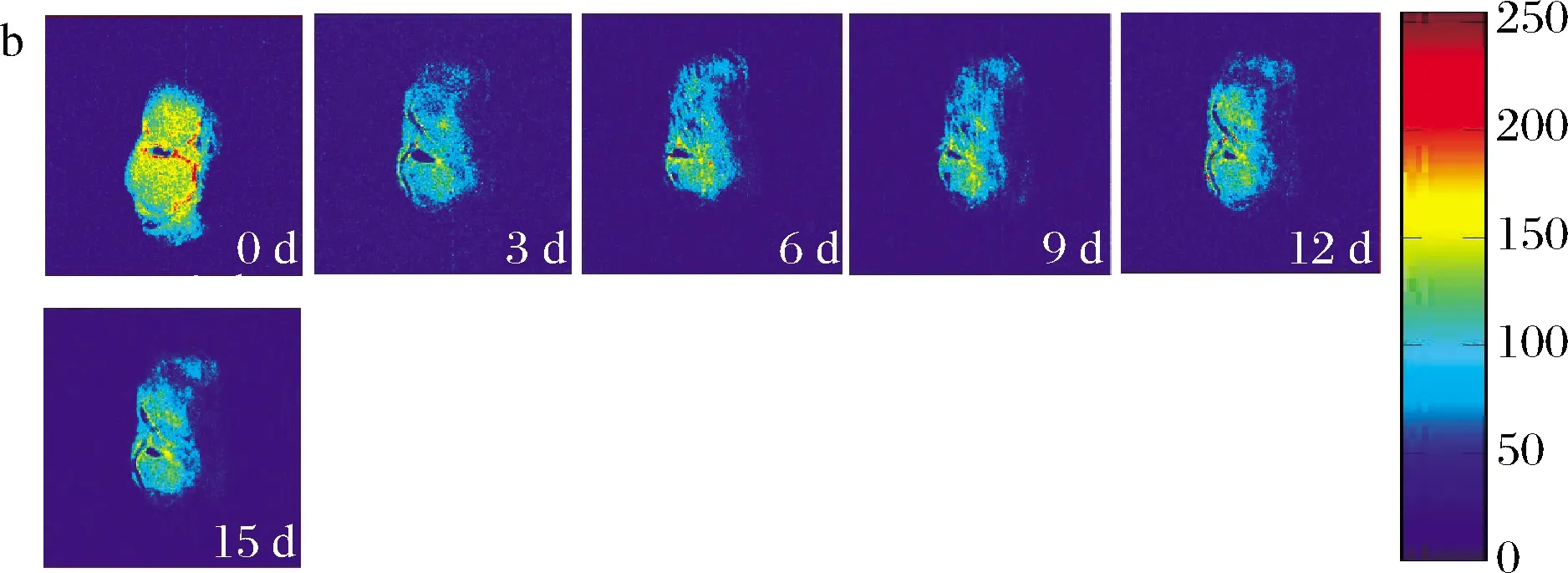
a-冰温贮藏; b-冷藏图6 冰温贮藏和冷藏条件下牡蛎的伪彩图Fig.6 False-colour image of the water proton density in oyster during ice temperature storage and cold storage
2.8 微观组织结构观察
图7-a、7-b分别是低盐真空脱水牡蛎进行冰温贮藏和冷藏过程中微观组织结构变化,贮藏过程中牡蛎肌肉结构变化可以对牡蛎贮藏品质进行评价。贮藏0 d,冰温与冷藏条件下牡蛎肌肉纤维均排列整齐、结合紧密,无明显的断裂、扭曲,结缔组织清晰可见(图7-a与图7-b第0天箭头标记)。冰温贮藏从第21天开始,肌肉纤维间距开始增加,部分开始扭曲、断裂,同时结缔组织发生明显降解(图7-a第21、24和27天箭头标记)。
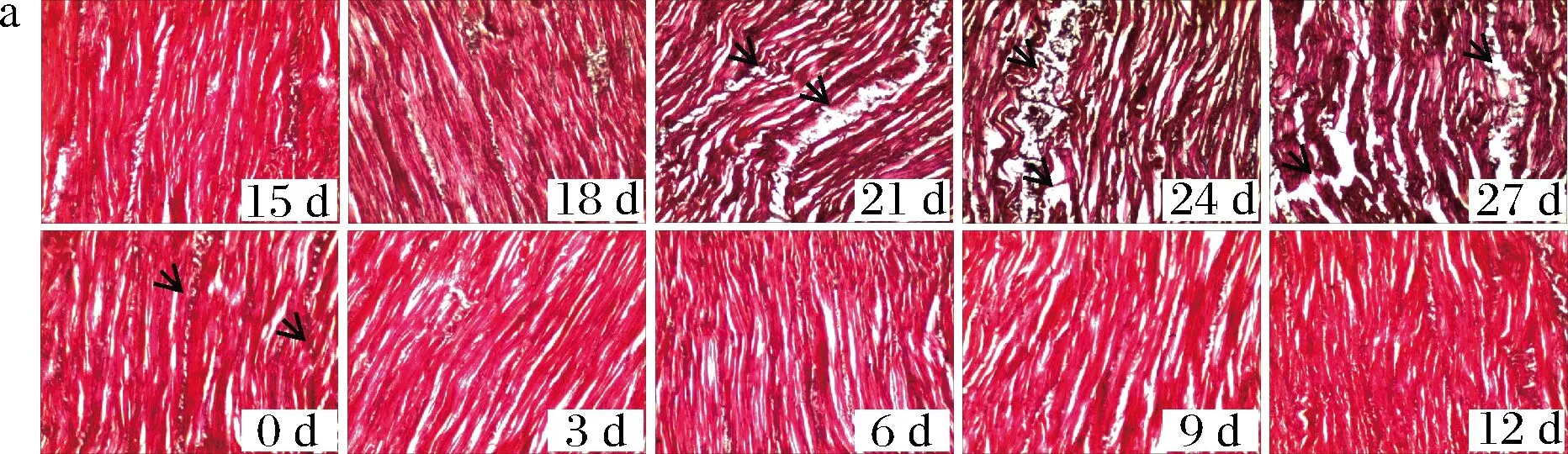
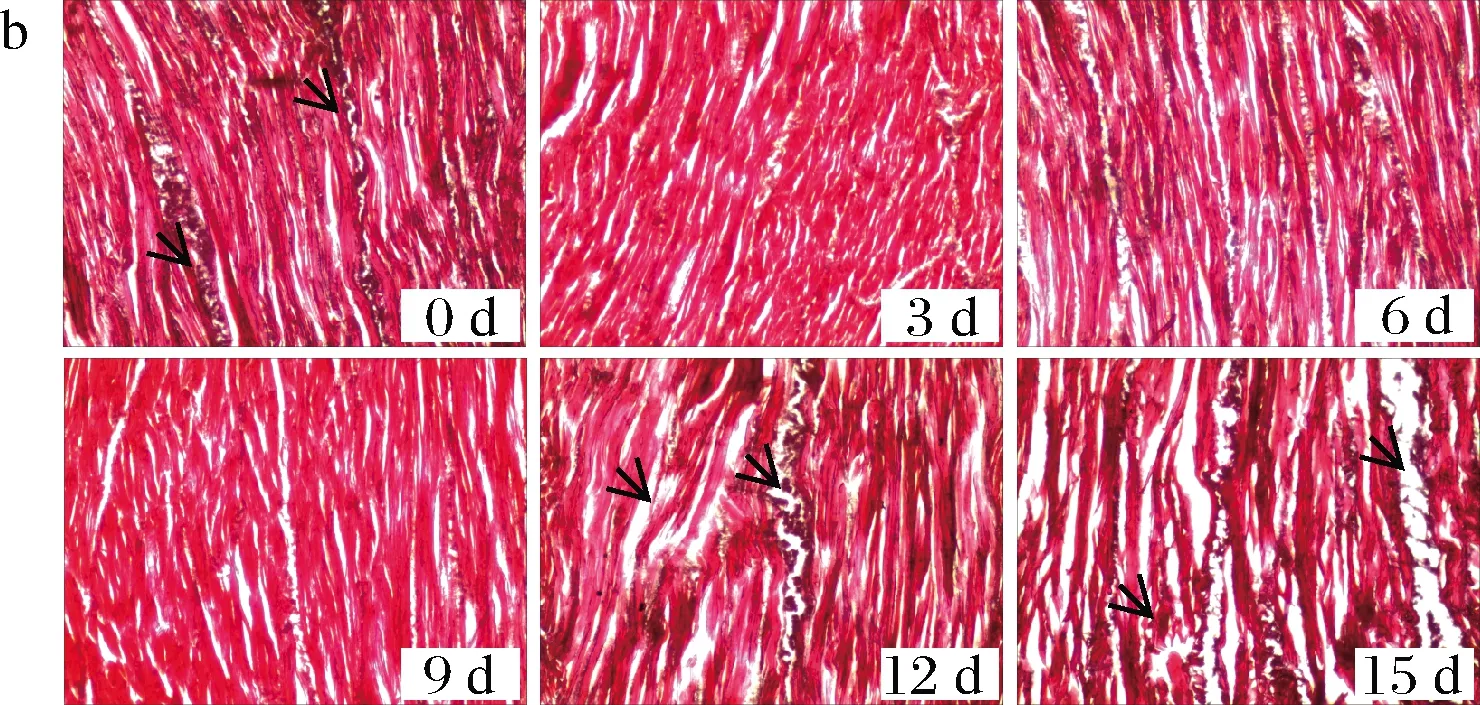
a-冰温贮藏; b-冷藏图7 冰温贮藏冷藏条件下牡蛎的微观组织结构图Fig.7 Microstructure of oyster during ice temperature storage and cold storage
对比图7-a,从图7-b发现,冷藏条件下类似情况出现在第12天(图7-b第12、15天箭头标记),劣变时间明显提前,品质降低。微观组织结构受脂质氧化和蛋白质降解影响明显,因此微生物作用和自身内源酶活性是影响微观组织结构的重要因素[27]。贮藏后期2种贮藏条件下微观组织结构劣变与菌落总数的增加密切相关,肌肉纤维以及结缔组织的降解也是TVB-N值上升、TCA-可溶性肽含量增加以及感官得分降低的主要原因。
3 结论
综合感官评价、菌落总数和TVB-N进行分析,牡蛎经低盐冰温脱水处理能有效延长其贮藏期,冷藏条件下可贮藏12 d,相比而言,冰温贮藏能更好延缓脂质氧化以及蛋白质的降解、变性,使得贮藏期内微观组织结构更加完整有序,贮藏期达到24 d。
LF-NMR结果表明,贮藏过程中横向弛豫时间T22、T23呈明显下降趋势,Pearson 相关性分析表明横向弛豫时间T22与牡蛎的品质变化显著相关(P<0.05)。MRI分析表明冰温条件下牡蛎局部存在质子强度增加、水分积累的现象,表明冰温贮藏保水性更好,而冷藏条件下水分流失明显。与传统冷藏6 d和冰温贮藏12 d的贮藏期相比[3],低盐冰温脱水牡蛎贮藏期明显提高,为牡蛎高品质贮藏运输方式提供了新的理论依据。
