土壤微生物膜对风沙土固沙保水特性的影响
2020-10-22杜宇佳高广磊陈丽华丁国栋曹红雨阿拉萨刘振婷
杜宇佳,高广磊,陈丽华,丁国栋,张 英,曹红雨,阿拉萨,刘振婷
土壤微生物膜对风沙土固沙保水特性的影响
杜宇佳1,2,高广磊1,2※,陈丽华1,丁国栋1,2,张 英1,2,曹红雨1,2,阿拉萨1,2,刘振婷1
(1. 北京林业大学水土保持学院,水土保持国家林业与草原局重点实验室,北京 100083;2. 宁夏盐池毛乌素沙地生态系统国家定位观测研究站,盐池 751500)
土壤微生物膜胞外聚合物具有较强的黏结性,为增强风沙土抗蚀性,提高风沙土保水性提供了新途径。鉴于此,该研究采用室内控制试验设置6个微生物菌剂施用水平(0、1、3、5、7和10 g/kg),以期阐明土壤微生物膜对风沙土特性的影响。研究结果表明:1)施用微生物菌剂可产生土壤微生物膜,并胶结风沙土颗粒。2)试验结束时(第49 d),与对照组相比,不同菌剂施用处理的土壤容重降低0.54%~8.88%,孔隙度提高0.39%~3.91%,含水率显著提高0.11%~0.25%(<0.05),大团聚体质量分数增加5.59%~25.01%,土壤pH值由7.16显著增加至8.32~9.23(<0.05)。3)土壤多糖含量对土壤特性的解释率为47%,是影响土壤特性的关键因素。土壤微生物膜能够有效改善风沙土特性,增强风沙土抗蚀性,提高风沙土保水性,但较高的微生物菌剂施用量会增加土壤pH值,造成土壤盐碱化,建议微生物菌剂施用水平为1~5 g/kg。研究成果有利于深入理解微生物膜固沙保水机制,并可为沙化土地防治新技术研发提供重要理论依据和科技支撑。
土壤;固沙;微生物膜;芽孢杆菌属;胞外聚合物;风沙土;保水
0 引 言
风沙土是更新世时期河湖相沉积物变干后,受风的分选作用而形成的新成土[1],是一种非地带性、半隐域性土壤,广泛分布于中国北方干旱风沙区[2]。风沙土结构松散,抗蚀性差,保水能力弱,对土壤风蚀的发生发展有着重要影响[3]。长期以来,国内外学者始终致力于风沙土的改良研究,以期增强风沙土的抗蚀能力和保水性,防治土地沙化[4]。一般来说,风沙土改良主要依赖于植物措施,但其建设成效较为缓慢;部分学者采用化学措施改良风沙土,建设成效较快,但存在环境污染风险[5]。因此,风沙土改良相关研究仍然是土壤风蚀研究的焦点和难点问题。
土壤微生物种类丰富,数量庞大,是土壤中分布最广泛、最活跃的生命形式,在陆地生态系统中发挥着至关重要的生态功能[6-7]。在自然界中,多数土壤微生物并非以单独的游离态存在,而是定殖于土壤颗粒表面,并分泌胞外聚合物形成微生物聚集体[8]。这种微生物聚集体被称为土壤微生物膜,是土壤微生物生命过程中最典型、最高效的生长模式之一[9]。土壤微生物膜主要由微生物细胞和胞外基质构成。其中,胞外基质的主要成分是由多糖、蛋白质、核酸和脂质等构成的胞外聚合物[10]。与游离态的土壤微生物相比,微生物膜是土壤微生物适应环境变化和环境胁迫的缓冲带[11],还是土壤微生物细胞之间的物质能量交流、获取遗传物质和吸收营养物质的场所[12]。
微生物膜是土壤微生物自我保护和高效生长的一种适应性机制。国内外学者围绕微生物膜的形成、结构和功能等已经开展了大量的研究工作,但主要聚焦生物技术和临床医学相关研究领域[13-14],而忽视了土壤生物膜改良风沙土的重要功能。在荒漠生态系统中,芽孢杆菌属()、金黄色葡萄球菌()和铜绿假单胞菌()等常见土壤微生物均可以形成微生物膜[15-16]。研究发现,将荒漠寡营养细菌()菌液喷洒于风沙土中,可有效增加土壤颗粒黏结性,促进团粒结构形成,增强土壤抗蚀性[17];将胶质类芽孢杆菌(接种于荒漠土壤后,土壤保水性得到提高[18]。因此,土壤微生物膜在风沙土改良领域存在重大的应用潜力和应用价值,可为土地沙化防治技术研发提供了新途径。目前,土壤微生物膜的研究仍处于起步阶段,虽然其固沙保水功能得到研究证实,但相关研究相对零散,且土壤微生物膜的固沙保水机制尚不明确。鉴于此,本研究以中国北方风沙区常见的枯草芽孢杆菌()和短小芽孢杆菌()为试验材料,开展室内控制试验研究揭示土壤微生物膜特征及其对风沙土特性的影响,以期深入理解土壤微生物膜固沙保水机制,并为土地沙化防治技术研发提供理论依据和科技支撑。
1 材料与方法
1.1 试验材料
试验菌种为枯草芽孢杆菌和短小芽孢杆菌。菌剂购自国家微生物肥料技术研究推广中心,活菌数约为5×109CFU/mL,并以木屑为固体培养基(菌株接种量体积分数10%),以矿物质(硅藻页岩)为吸附剂,木屑(含菌株)与矿物质的质量比为1∶1。菌剂配施成本约为1.91~9.56元/m2。风沙土取自内蒙古自治区奈曼旗科尔沁沙地无植被流动沙丘(43°09′N,120°37′E),取样深度0~10 cm。风沙土基本参数为土壤微生物量碳、微生物量氮、多糖、土壤有机质质量分数分别为0.000 78%、0.000 42%、0.044 %、0.021%,pH值为6.22。
1.2 试验设计与试验方法
控制试验于2019年11月—2020年1月在北京林业大学三顷园温室中进行,温室昼夜温度分别为28和18 ℃。试验共设置6个微生物菌剂施用水平,菌剂施用量(菌剂与土壤质量比)分别为0、1、3、5、7和10 g/kg。将微生物菌剂与土壤混合均匀后,置于高15 cm,内径18 cm的花盆中,每组设置3个重复。一次性浇水使其达到饱和田间持水量,并于2019年11月18日开始,每隔7 d取土1次,至次年1月6日结束(即试验开始第0、7、14、21、28、35、42、49 d),带回实验室风干,测定土壤微生物指标、土壤理化性质指标。
采用扫描电子显微镜(Hitachi,S-3000N)观察、拍摄土壤微生物膜形态,验证土壤微生物膜的存在;分别采用氯仿熏蒸浸提法和硫酸-蒽酮法测定土壤微生物量碳氮含量和土壤多糖含量[19-20],研究揭示土壤微生物膜形成过程中微生物和胞外聚合物含量变化。采用干/湿筛法测定土壤团聚体含量[21],烘干法测定土壤容重和土壤含水率,环刀浸透法测定土壤孔隙度,表征土壤微生物膜对风沙土特性的影响。此外,由于土壤微生物膜可能造成土壤环境的盐碱化,采用浸提电位法测定土壤pH值[22],以评估其对土壤环境的影响。
1.3 数据处理
采用SPSS 24.0 软件对获取的试验数据进行统计分析。采用单因素方差分析(One Way ANOVA)对不同微生物菌剂施用水平土壤微生物碳氮含量、多糖、团聚体和pH值进行差异显著性分析,并开展最小显著差异检验(最小显著性差异法LSD)。采用双因素方差分析进行土壤容重、孔隙度、含水率变化值的差异显著性分析。采用Origin 2018软件绘制土壤容重、孔隙度和含水率变化图,采用Excel 2010软件绘制土壤微生物量、团聚体分布柱状图和土壤多糖含量、含水率变化曲线图。采用Canoco for Windows 4.5软件进行土壤微生物膜活性特征因子对土壤特性的影响分析,采用-value绘制单个因子对土壤特性的影响图。
2 结果与分析
2.1 土壤微生物膜特征
2.1.1 土壤微生物膜显微特征
在风沙土中添加微生物菌剂培养后,采用扫描电子显微镜观察土壤微生物膜形态。在1 mm比例尺下,观察发现风沙土颗粒间隙被填充;在200m比例尺下,可明显观察到风沙土颗粒表面被微生物和沙粒碎屑包裹;在30m比例尺下,则可清晰地观察到在土壤微生物膜的胶结作用下,风沙土颗粒被粘结在一起(图1)。显微观察证实,微生物菌剂确可形成土壤微生物膜,并具有胶结风沙土颗粒的重要作用。
2.1.2 土壤微生物量碳氮特征
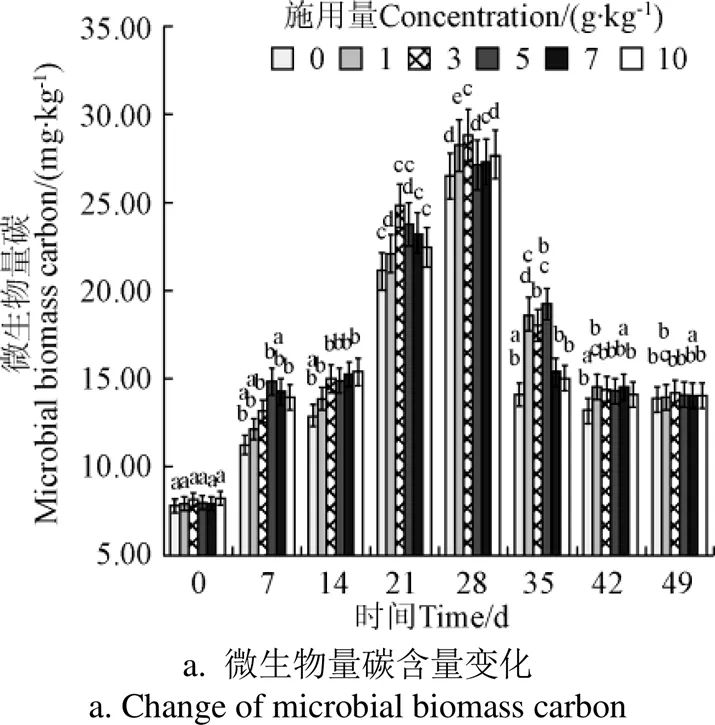
不同处理的土壤微生物量碳氮含量随时间先显著增加,而后显著降低(<0.05),且均在28 d达到峰值(26.52~28.86和31.95~34.69 mg/kg)(图2)。土壤微生物量碳氮含量在第35 d显著下降(14.16~19.29和16.02~17.36 mg/kg)(<0.05)。土壤微生物碳含量相比对照组(菌剂用量为0)提高了2.41%~8.82%。其中,菌剂用量为3 g/kg处理组在第28 d时土壤微生物量碳含量最高,相比对照组提高了8.82%;土壤微生物量氮含量相比对照组提高了0.79%~8.60%,但均未达到显著水平(0.05)。
2.1.3 土壤多糖变化
土壤多糖含量在第0~14 d无显著变化(>0.05),21 d时多糖含量显著上升(<0.05),随后多糖含量显著下降(<0.05),第35 d后变化趋于平缓(>0.05)(图3)。试验结束时,土壤多糖含量相比对照组提高了13.25%~55.13%。第7 d时,3 g/kg处理组土壤多糖含量相比对照组显著增加了22.75%(<0.05);14 d时,菌剂用量为3~10 g/kg处理组相比对照组显著提高了20.22%~31.90%(<0.05);49 d时,菌剂用量为10 g/kg处理组土壤多糖含量相比对照组显著增加了55.13%(<0.05);其他处理未达到显著水平(>0.05)。
2.2 风沙土特性
2.2.1 土壤容重、孔隙度和含水率变化
土壤容重与孔隙度随施用时间变化差异极显著(<0.01),不同处理的土壤容重和孔隙度较对照组分别降低0.55%~0.97%和提高0.39%~3.91%,但未达到显著水平(>0.05)(图4)。菌剂施用量和施用时间对土壤水分保持均有显著影响(<0.05),但施用时间比微生物菌剂用量对水分保持的影响更显著(<0.01)。添加菌剂组土壤含水率相比对照组显著提高0.11%~0.25%(<0.05)。

图1 不同比例尺下风沙土扫描电子显微镜图
注:不同小写字母表示同一处理随时间变化差异显著,下同。
Note: Different lowercase letters indicated significant difference in the same processing over time, the same as below.
图2 不同菌剂施用量条件下土壤微生物量碳氮含量变化
Fig.2 Variations of microbial biomass carbon and nitrogen in soil with different microbial agents concentrations
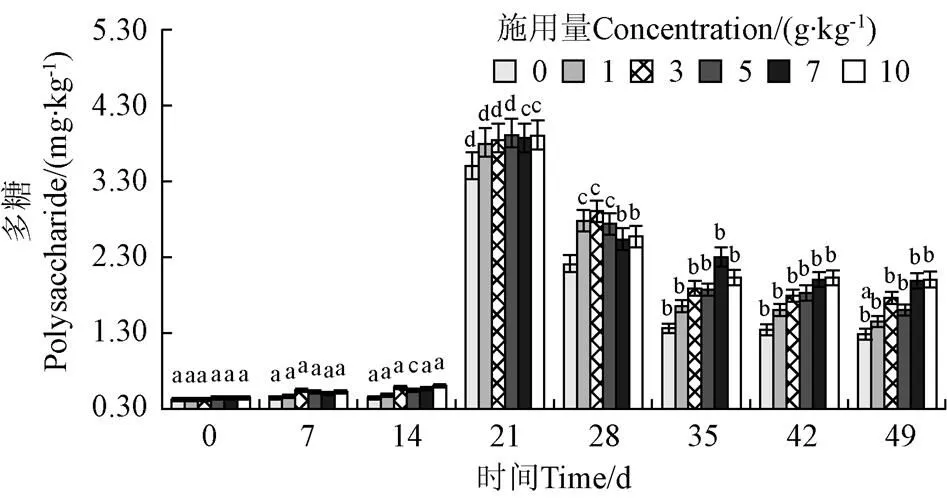
图3 不同菌剂施用量条件下土壤多糖含量变化
2.2.2 土壤团聚体变化
土壤微生物膜作用下土壤团聚体共分为0.25~0.5和<0.25 mm 2种粒级。表1展示了0.25~0.5 mm粒级下土壤团聚体的质量,菌剂用量为0、1、5和10 g/kg处理组土壤大团聚体含量在第14 d时显著增加(<0.05),14 d后所有处理组大团聚体含量均无显著差异(>0.05)。其中,3 g/kg处理组在第21 d及之后,形成的大团聚体含量最高,达12.47~14.61 g。第49 d时,土壤团聚体质量分数增加了5.59%~25.01%。
2.2.3 土壤pH值变化
土壤pH值在35 d之前呈现逐渐增加的趋势,在第35 d后无显著差异(0.05)(表2)。对照组土壤pH值最低,变化范围为6.22~7.64,该组土壤pH值在第14 d及之后,显著低于其他处理组(0.05),表明添加菌剂可显著提高土壤pH值。微生物用量在3 g/kg及以上,在第14 d之后土壤pH值没有显著变化(0.05),土壤pH值范围为8.62~9.32。
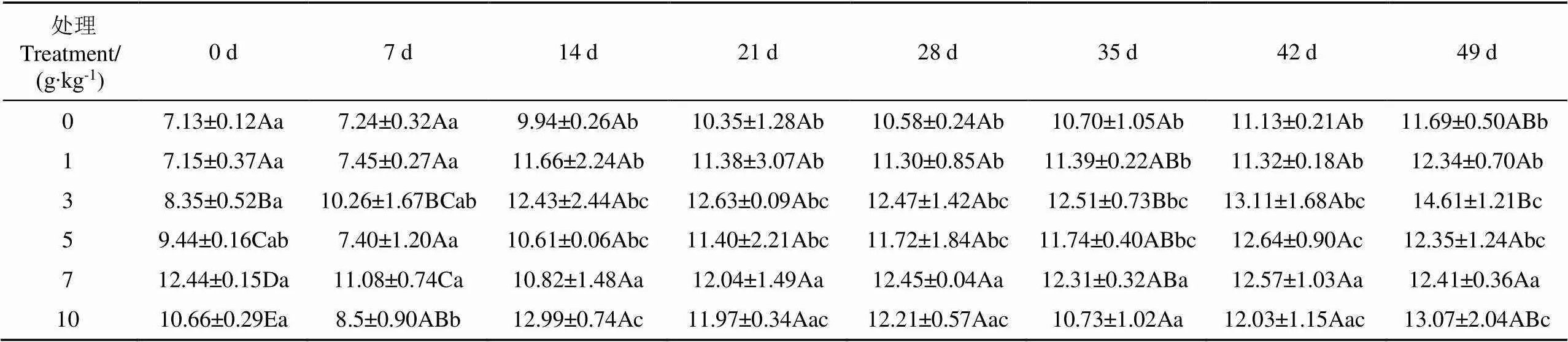
表1 不同菌剂用量施用条件下土壤团聚体变化
注:各处理为不同的菌剂施用量。不同大写字母表示同一时间下不同处理组差异显著。下同。
Note: Treatments represent different microbial agents concentrations. Different uppercase letters indicated significant difference between different treatment groups at the same time. Same as below.
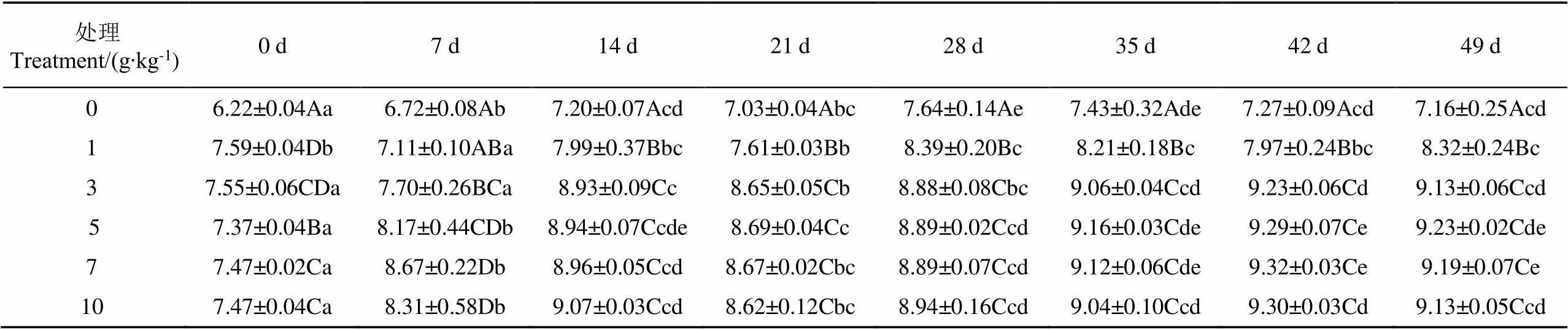
表2 不同菌剂用量施用条件下土壤pH值变化
2.3 土壤微生物膜特征与土壤特性的关系
土壤微生物膜特征对土壤特性的解释率在第一轴和第二轴的解释率分别为58.1%和4.5%(图5),累计解释率为62.6%,且对土壤特性与微生物膜特征之间关系的累计解释率达到了92.8%,表明这两轴能够反映土壤特性与微生物膜特征的绝大部分信息。土壤微生物量碳、土壤微生物量氮、多糖与土壤pH值、含水率、团聚体、孔隙度均呈正相关关系,与土壤容重呈负相关性。
通过对土壤微生物膜特征进行蒙特卡洛检验排序,研究其对土壤特性影响的重要性,结果表明重要性依次为土壤多糖、土壤微生物量氮、土壤微生物量碳(表3)。多糖对土壤特性的影响达到极显著水平(<0.01),对土壤特性影响的解释率为47%;土壤微生物量氮对土壤特性的影响达到显著水平(<0.05),解释率为30%,表明土壤微生物膜特征中多糖是影响土壤特性最关键的因素,土壤微生物量氮次之。
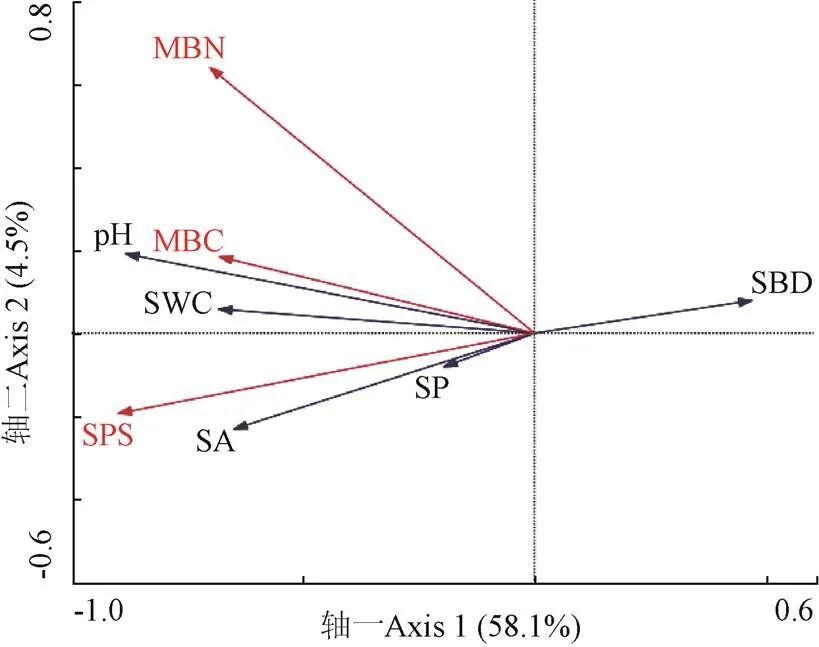
SBD:土壤容重;SP:土壤孔隙度;SA:土壤团聚体;SWC:土壤含水率;SPS:土壤多糖含量;MBC:土壤微生物量碳;MBN:土壤微生物量氮。下同。 SBD: soil bulk density; SP: soil porosity; SA: soil aggregates; SWC: soil water content; SPS: soil polysaccharide; MBC: soil microbial biomass carbon; MBN: soil microbial biomass nitrogen. Same as below.
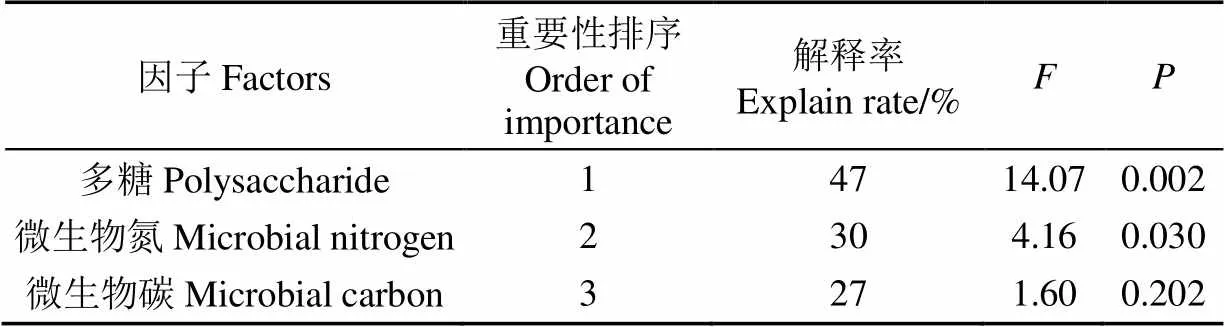
表3 土壤微生物膜特征因子的蒙特卡洛检验
根据-value双序图进一步分析得到单一土壤微生物膜特征对土壤特性的影响。对土壤多糖进行分析(图6a),土壤pH值与土壤团聚体完全落入实线圈内,表明土壤多糖与pH值、团聚体呈显著正相关关系;土壤含水量与土壤孔隙度穿过实线圈,说明土壤多糖与含水率、孔隙度呈正相关性;土壤容重穿过虚线圈,表示土壤多糖与容重呈负相关性。土壤微生物量氮与土壤特性的关系表明(图6b),土壤微生物量氮与pH值,土壤含水率呈正相关性。图 6c表明土壤微生物量碳与pH值呈显著正相关关系,与土壤团聚体、含水率、孔隙度呈正相关性,与土壤容重呈负相关性。
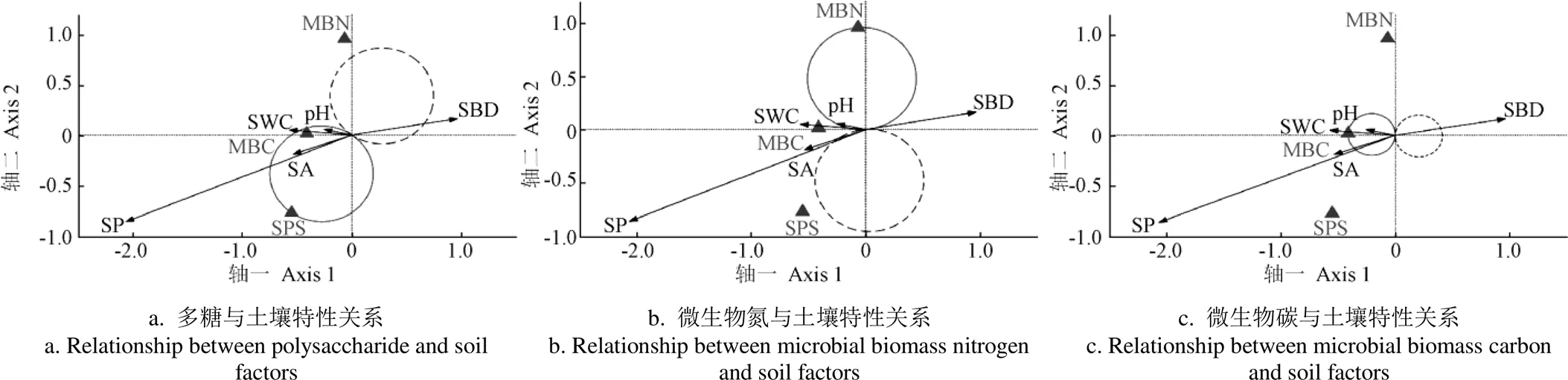
图6 土壤微生物膜单一指标对土壤特性影响的t值检验
3 讨 论
3.1 土壤微生物膜特征变化
土壤微生物膜的生命活动首先通过微生物细胞在土壤表面定殖,进而完成发育并逐渐成熟形成微生物膜,最后分散成为微生物细胞,继续完成下一个周期[23]。本研究观察到微生物细胞首先会聚集在一起,填充沙粒之间的间隙,利用自身产的胞外聚合物从而将沙粒粘结在一起形成微生物膜。在本研究中,采用扫描电子显微镜实现了微生物膜的可视化。由于土壤空间的异质性和微生物膜形成过程的循环性,使得采用扫描电子显微镜观察风沙土中不同剂量微生物菌剂微生物膜十分困难,存在重大的技术制约。另外,本研究采用多糖含量这一指标来间接反应菌剂剂量的差异。微生物膜主要由微生物细胞和微生物膜基质两部分组成。一般来说,细胞干质量仅占微生物膜质量的2%~15%,其余部分为微生物膜基质,其中,微生物膜基质主要包括细胞自身分泌的胞外多糖、蛋白质和核酸等大分子物质[24]。因此,土壤多糖含量的变化也可反映微生物膜的形成变化,不同剂量菌剂所形成的微生物膜作用下土壤多糖的变化反映了微生物膜的形成过程对风沙土特性的影响。
土壤微生物量碳氮含量的动态变化是一个复杂的过程,可综合反映土壤微生物量的大小和土壤微生物的活性强度[25]。本研究中,土壤微生物量碳氮含量变化趋势一致,其值先增加后降低,二者含量的增加表明培养条件适宜微生物的生长,微生物利用土壤中的有机碳源和养分进行大量繁殖,将碳氮固定在自身体内,使得土壤微生物量碳氮含量增加[26]。之后,土壤中的养分随着有机质的分解、水分的减少而减少,使得微生物数量减少,土壤微生物量碳氮含量随之减少[27]。湿润和干旱都会造成土壤微生物数量降低[28],因此土壤微生物量碳氮含量在培养初期和末期均较低。微生物膜可提高土壤微生物量,但相比对照组并未达到显著水平,这与前人研究一致[29]。这是由于虽然添加了外源细菌,增加了土壤微生物的数量,但风沙土中养分较低,微生物无法固定土壤中足够的碳氮来使微生物生物量达到显著水平。微生物膜可显著提高土壤多糖含量,这是由于添加的外源菌剂中枯草芽孢杆菌和短小芽孢杆菌可高产胞外聚合物[30]。
土壤微生物量周转周期短,能够快速地反映环境因子的变化过程[31],且水分是微生物生命活动最为重要的因素之一[32]。土壤微生物膜形成初期,土壤水分呈饱和状态,水分过多不利于微生物的生存。21 d时,土壤微生物量与多糖开始积累,这是由于这时的土壤水分适宜土壤微生物的生长。35 d时,土壤微生物量与多糖含量开始下降,这是由于风沙土水分蒸发较快。当水分蒸发至不能满足微生物的活动,微生物量与多糖含量趋于平稳。
3.2 土壤微生物膜对土壤特性的影响
风沙土具有结构松散,抗蚀性差,保水能力弱的特点。土壤微生物膜可提高风沙土保水能力。一方面,微生物膜形成前期,微生物会分泌大量的胞外聚合物,而分泌的胞外聚合物可与土壤水分形成氢键,使得土壤中保持了更多的水分[33],从而提高土壤的保水能力。土壤微生物膜的生命过程具有周期性,在微生物细胞解散时,胞外聚合物中蛋白质和多糖也会被破坏,从而使土壤中的水分释放出来,水分保持量也随之下降。另一方面,土壤中微生物的数量升高,活性增强,土壤微生物膜可降低土壤容重,增加土壤孔隙度。这也就增加了土壤的透水透气性,促进了水分的下渗,也有利于水分的保持。
随着微生物菌剂用量的增加,大团聚体的质量百分比呈现增加的趋势,这与前人的研究结果一致[34]。土壤团聚体的稳定性主要是由土壤颗粒间胶结物质的生物稳定性决定,土壤微生物膜通过微生物分泌产生胞外聚合物,使土壤颗粒胶结在一起,因其自身较高的稳定性从而形成稳定的大团聚体[35]。同时,微生物可向土壤中提供大量的有机物质,有机物分解及土壤微生物膜的胶结作用可使风沙土颗粒形成稳定的团粒结构,从而改变了土壤的紧实度,使得土壤容重降低,改善了土壤孔隙度的分布状况[36]。因此,土壤微生物膜增加了风沙土团聚体含量,增强了风沙土的抗蚀性。
多糖是影响土壤特性最关键的因素,这主要是因为胞外聚合物在微生物膜结构中起到粘结的作用,不仅提供了微生物膜的框架[37],也与土壤水分和团聚体有着紧密联系。而多糖是胞外聚合物的主要成分,多糖在微生物膜的形成中起着重要的作用。流动沙丘风沙土氮含量严重不足,而土壤微生物量氮是土壤氮素的重要储备库,是土壤有机氮的重要组分,在土壤氮循环中起着重要的作用[38],通过微生物固定的氮来促进土壤氮素含量的增加,微生物量氮是影响土壤特性的显著因素。
土壤微生物量、土壤多糖和土壤特征因子的值并不是随着微生物菌剂用量的增加而增加,反而土壤pH值随着微生物菌剂用量的增加而增加,这表明微生物菌剂用量的增加可能会造成土壤盐碱化。这主要是因为枯草芽孢杆菌可生产碱性蛋白酶[39],具有高产蛋白酶、抗逆性强、耐高碱等特点,且在培养过程中会产生表面活性剂[40],表面活性剂可保护酶的活性,使得碱性蛋白酶的活性增强,从而导致土壤pH值升高。也有研究表明,土壤pH值与芽孢杆菌量呈正相关[41],因此微生物菌剂的用量会影响土壤pH值的变化。除此之外,由于微生物菌剂中含有木屑、矿物质等吸附剂,这些物质可能呈碱性,也会影响土壤pH值。得到这一试验结果后,本研究组与国家微生物肥料研究推广中心进行了深入的探讨,希望可以通过添加偏酸性吸附剂避免或降低对土壤pH值的影响。此外,研究组也在进一步开展土壤微生物筛选工作,以期找到新的功能性土壤微生物。土壤微生物多样性极为丰富,使得对于土壤微生物功能的了解也存在极大的局限。因此,进一步了解土壤微生物群落结构和功能,筛选优化微生物菌剂菌种和吸附剂,进而提高土壤微生物分泌胞外聚合物效率,降低对土壤盐渍化的影响,将是未来土壤微生物膜相关研究的重要内容。
另外,微生物与沙生植物的互馈作用是微生物膜研究另一个重要的方向。微生物膜对植物生长应是有利的。一方面,水分是干旱地区限制植物生长最重要的因素,微生物膜可通过提高土壤水分保持能力来供给植物生长所需的水分;另一方面,枯草芽孢杆菌作为一种根际促生菌[42],可以微生物膜形式存在于根际微生境,通过改善土壤质量和产生植物激素等直接作用促进植物生长,也可以通过提高植物抗逆性间接发挥促生作用[43]。因此,微生物膜在风沙防治应用中对后期植被生长应是有利的。
风沙土结构松散,抗蚀性差,保水性弱,而土壤微生物膜能够有效固沙保水,其成本与常见新型沙障材料和化学、微生物固沙剂基本相当,随着菌剂配施技术的逐渐成熟和规模化生产,菌剂成本必将继续下降。因此,本研究提出的土壤微生物膜改善风沙土固沙保水特性的研究在风沙土改良和沙化土地防治领域具有较好的开发应用潜力。但需指出的是,由于枯草芽孢杆菌属于碱性细菌,菌剂的施用可能会造成土壤pH值增加。因此,进一步筛选功能性土壤微生物和研发菌剂吸附剂是未来重要的研究工作。此外,施用土壤微生物膜菌剂后,其与沙生植物的互馈作用也有待进一步深入研究。
4 结 论
微生物菌剂施用于风沙土可形成土壤微生物膜,提高了土壤微生物量碳氮和多糖含量,并胶结松散的风沙土颗粒。同时,土壤微生物膜的出现降低了土壤容重,增加了土壤孔隙度,提高了风沙土水分保持能力;增加了土壤大团聚体含量,增强了风沙土的抗蚀性;但较高的微生物菌剂施用水平会增加土壤pH值。土壤微生物量碳氮、多糖与土壤pH值、含水率、团聚体、孔隙度均呈正相关关系,与容重呈负相关关系。其中,土壤多糖含量是影响风沙土特性的关键因素。
[1] 赵哈林. 沙漠生态学[M]. 北京:科学出版社,2012.
[2] Gao G L, Ding G D, Zhao Y Y, et al. Characterization of soil particle size distribution with a fractal model in the desertified regions of Northern China[J]. Acta Geophysica, 2016, 64(1): 1-14.
[3] Lang L L, Wang X M, Wang G T, et al. Effects of aeolian processes on nutrient loss from surface soils and their significance for sandy desertification in Mu Us Desert, China: A wind tunnel approach[J]. Journal of Arid Land, 2014, 7: 421-428.
[4] Li X J, Zhou R P, Jian H T, et al. Quantitative analysis of how different checkerboard sand barrier materials influence soil properties: A study from the eastern edge of the Tengger Desert, China[J]. Environmental Earth Sciences, 2018, 77(13): 481-495.
[5] Zhang Z H, Huisingh D. Combating desertification in China: Monitoring, control, management and revegetation[J]. Journal of Cleaner Production, 2018, 182: 765-775.
[6] Nkongolo K K, Narendrula-Kotha R. Advances in monitoring soil microbial community dynamic and function[J]. Journal of Applied Genetics, 2020, 61: 249-263.
[7] 杜宇佳,高广磊,陈丽华,等. 呼伦贝尔沙区土壤细菌群落结构与功能预测[J]. 中国环境科学,2019,39(11):4840-4848. Du Yujia, Gao Guanglei, Chen Lihua, et al. Soil bacteria community structure and function prediction in the Hulun Buir Sandy Area[J]. China Environmental Science, 2019, 39(11): 4840-4848. (in Chinese with English abstract)
[8] Burmølle M, Hansen L H, Sørensen S J. Establishment and early succession of a multispecies biofilm composed of soil bacteria[J]. Microbial Ecology, 2007, 54: 352-362.
[9] Davey M E, O’Toole G A. Microbial Biofilms: From ecology to molecular genetics[J]. Microbiology and Molecular Biology Reviews, 2000, 64(4): 847-867.
[10] Flemming H C, Wingender J. The biofilm matrix[J]. Nature Reviews Microbiology, 2010, 8(9): 623-633.
[11] Sabra W, Haddad A M, Zeng A P. Comparative physiological study of the wild type and the small colony variant ofunder controlled growth conditions[J]. World Journal of Microbiology Biotechnology, 2014, 30: 1027–1036.
[12] Baum M M, Kainović A, O'Keeffe T, et al. Characterization of structures in biofilms formed by aisolated from soil[J]. BMC Microbiology, 2009, 9: 103-116.
[13] Kenny D J, Balskus E P. Engineering chemical interactions in microbial communities[J]. Chemical Society Reviews. 2018, 47: 1705-1729.
[14] Magana M, Sereti C, Ioannidis A, et al. Options and limitations in clinical investigation of bacterial biofilms[J]. Clinical Microbiology Reviews, 2018, 31: e00084-16.
[15] 邱东,程争鸣,张元明,等, 潘惠霞. 寡营养细菌对古尔班通古特沙漠土壤环境的影响[J]. 干旱区研究,2012,29(1):148-154. Qiu Dong, Cheng Zhengming, Zhang Yuanming, et al. Effect of oligotrophic bacteria on soil environment in the Gurbantunggut Desert, Xinjiang, China[J]. Arid Zone Research, 2012, 29(1): 148-154. (in Chinese with English abstract)
[16] Kuzyakov Y, Blagodatskaya E. Microbial hotspots and hot moments in soil: Concept and review[J]. Soil Biology and Biochemistry. 2015, 83: 184-199.
[17] Velmourougane K, Prasanna R. Influence of L-amino acid on aggregation and biofilm formation inand[J]. Journal of Applied Microbiology, 2017, 123(4): 977-991.
[18] Wu N, Pan H X, Qiu D, et al. Feasibility of EPS-producing bacterial inoculation to speed up the sand aggregation in the Gurbantunggut Desert, Northwestern China[J]. Journal of Basic Microbiology, 2014, 54(12): 1378-1386.
[19] Jenkinson D S, Brookes P C, Powlson D S. Mearsuring soil microbial biomass[J]. Soil Biology and Biochemistry, 2004, 36(1): 5-7.
[20] 张弢. 大棚蔬菜连作对土壤多糖影响的研究[J]. 北方园艺,2009(8):165-166. Zhang Tao. Effect of continuous cropping of different vegetables on soil polysaccharides[J]. Northern Horticulture, 2009(8): 165-166. (in Chinese with English abstract)
[21] Limon O A, Govaerts B, Deckers J, et al. Soil aggregrate and microbial biomass in a permanent bed wheat-maize planting system after 12 years[J]. Field Crops Research, 2006, 97(2/3): 302-309.
[22] 查同刚. 土壤理化分析[M]. 北京:中国林业出版社,2017:12-17.
[23] Cai P, Sun X J, Wu Y C, et al. Soil biofilms: microbial interactions, challenges, and advanced techniques forcharacterization[J]. Soil Ecology Letters, 2019, 1(3/4): 85-93.
[24] Aguilera A, Souza-Egipsy V, Martín-Úriz P S, et al. Extracton of extracellular polymeric substances from extreme acidic microbial biofilms[J]. Applied Microbiology and Biotechnology, 2008, 78: 1079-1088.
[25] 井大炜,邢尚军,刘方春,等. 畦灌配施保水剂改善杨树林下土壤物理性状提高微生物活性[J]. 农业工程学报,2015,31(14):116-122.
Jing Dawei, Xing Shangjun, Liu Fangchun, et al. Border irrigation co-applied with super absorbent polymers improving soil physical characteristics and increasing microbial acticity in poplar forest[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(14): 116-122. (in Chinese with English abstract)
[26] 陈安强,付斌,鲁耀,等. 有机物料输入稻田提高土壤微生物碳氮及可溶性有机碳氮[J].农业工程学报,2015,31(21):160-167.
Chen Anqiang, Fu Bin, Lu Yao, et al. Exogenous organic materials applied to paddy field improving soil microbial biomass C, N and dissolved organic C, N[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2015, 31(21): 160-167. (in Chinese with English abstract)
[27] Azeez J O, Van Averbeke W. Nitrogen mineralization potential of three animal manures applied on a sandy clay loam soil[J]. Bioresource Technology, 2010, 101(14): 5645-5651.
[28] 黄科朝,沈育伊,徐广平,等. 垦殖对桂林会仙喀斯特湿地土壤养分与微生物活性的影响[J]. 环境科学,2018,39(4):1813-1823. Huang Kechao, Shen Yuyi, Xu Guangping, et al. Effects of reclamation on soil nutrients and microbial activities in the huixian karst wetland in Guilin[J]. Environmental Science, 2018, 39(4): 1813-1823. (in Chinese with English abstract)
[29] 刘躲,王磊,曹湛波,等. 接种菌根真菌对湿生植物根际土壤硝化反硝化活性的影响及其微生物机制[J]. 环境科学,2020,41(2):932-940. Liu Duo, Wang Lei, Cao Zhanbo, et al. Effects of mycorrhizal fungi on nitrification and denitrification in the rhizospheric soil of aquatic plants and its microbial mechanism[J]. Environmental Science, 2020, 41(2): 932-940. (in Chinese with English abstract)
[30] Ghoneim M A M, Hassan A I, Mahmoud M G, et al. Effect of polysaccharide from. on cardiovascular diseases and atherogenic indices in diabetic rats[J]. BMC Complementary and Alternative Medicine, 2016, 16: 112-123.
[31] 李鹏,李占斌,薛萐,等. 干热河谷地区不同土地利用方式土壤微生物量及其活性分异特征[J]. 应用基础与工程科学学报,2011,19(S1):130-138. Li Peng, Li Zhanbin, Xue Sha, et al. Soil microbial biomass and its differentiation characteristic under different land use in dry-hot valley[J]. Journal of Basic Science and Engineering, 2011, 19(S1): 130-138. (in Chinese with English abstract)
[32] 徐国伟,陆大克,孙会忠,等. 干湿交替灌溉与施氮耦合对水稻根际环境的影响[J]. 农业工程学报,2017,33(4):186-194.
Xu Guowei, Lu Dake, Sun Huizhong, et al. Effect of alternative wetting and drying irrigation and nitrogen coupling on rhizosphere environment of rice[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2017, 33(4): 186-194. (in Chinese with English abstract)
[33] 唐海,沙俊鹏,欧阳龙,等. Fe(Ⅱ)活化过硫酸盐氧化破解剩余污泥[J]. 化工学报,2015,66(2):785-792. Tang Hai, Sha Junpeng, Ouyang Long, et al. Persulfate activated by Fe(II) for oxidation and disintegration of excess sludge[J]. CIESC Journal, 2015, 66(2): 785-792. (in Chinese with English abstract)
[34] Lehmann A, Zheng W S, Rillig M C. Soil biota contributions to soil aggregation[J]. Nature Ecology and Evolution, 2017, 1: 1828-1835.
[35] 孟庆英,邹洪涛,韩艳玉,等. 秸秆还田量对土壤团聚体有机碳和玉米产量的影响[J]. 农业工程学报,2019,35(23):119-125. Meng Qingying, Zou Hongtao, Han Yanyu, et al. Effects of straw application rates on soil aggregates, soil organic carbon content and maize yield[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2019, 35(23): 119-125. (in Chinese with English abstract)
[36] 李荣,侯贤清,吴鹏年,等. 秸秆还田配施氮肥对土壤性状与水分利用效率的影响[J]. 农业机械学报,2019,50(8):289-298. Li Rong, Hou Xianqing, Wu Pengnian, et al. Effect of straw returning with nitrogen application on soil properties and water use efficiency[J]. Transactions of the Chinese Society for Agricultural Machinery, 2019, 50(8): 289-298. (in Chinese with English abstract)
[37] Ul-Haq I, Mukhtar H. Fuzzy logic control of bioreactor for enhanced biosynthesis of alkaline protease by an alkalophilic strain of[J]. Current Microbiology, 2006, 52(2): 149-152.
[38] 纪宏伟,王小敏,庞宏伟,等. 枯草芽孢杆菌与巨大芽孢杆菌对土壤有效态Cd的影响研究[J]. 水土保持学报,2015,29(3):325-329. Ji Hongwei, Wang Xiaomin, Pang Hongwei, et al. Effect ofandon soil available Cd[J]. Journal of Soil and Water Conservation, 2015, 29(3): 325-329. (in Chinese with English abstract)
[39] 高海宁,李彩霞,孙小妹,等. 黑河上游冰沟流域土壤养分与微生物空间异质性研究[J]. 草业学报,2018,27(6):23-33. Gao Haining, Li Caixia, Sun Xiaomei, et al. Study of microorganism abundance and communities in response to soil factors in Binggou Valley, the upper reaches of Heihe[J]. Acta Prataculturae Sinica, 2018, 27(6): 23-33. (in Chinese with English abstract)
[40] Lin H R, Chen G C, Long D Y, et al. Responses of unsaturatedbiofilms to environmental stresses in relation to the EPS composition and surface morphology[J]. World Journal of Microbiology and Biotechnology, 2014, 30: 3081-3090.
[41] 卢虎,姚拓,李建宏,等. 高寒地区不同退化草地植被和土壤微生物特性及其相关性研究[J]. 草业学报,2015,24(5):34-43. Lu Hu, Yao Tuo, Li Jianhong, et al. Vegetation and soil microorganism characteristics of degraded grasslands[J]. Acta Prataculturae Sinica, 2015, 24(5): 34-43. (in Chinese with English abstract)
[42] Dutta S, Podile A R. Plant growth promoting rhizobacteria (PGPR): the bugs to debug the root zone[J]. Critical Reviews in Microbiology, 2010, 36(3): 232-244.
[43] Ongena M, Jacques P.lipopeptides: versatile weapons for plant disease biocontrol[J]. Trends in Microbiology, 2008, 16(3): 115-125.
Effects of soil microbial films on sand fixation and water retention characteristics of aeolian soils
Du Yujia1,2, Gao Guanglei1,2※, Chen Lihua1, Ding Guodong1,2, Zhang Ying1,2, Cao Hongyu1,2, A Lasa1,2, Liu Zhenting1
(1.,,,100083,; 2.,751500,)
In natural environment, soil microorganisms usually exist in the form of microbial aggregates rather than the free single microbial cell by secreting extracellular polymeric substances on the surface of soil particles. These microbial aggregates are widely known as soil microbial films. Soil microbial films are an important adaptive approach for soil microbial self-protection and efficient growth. In addition, more and more people are realizing that soil microbial films potentially contribute to the anti-erodibility and water retention improvement of aeolian soils due to the strong cohesiveness of the extracellular polymeric substances. Therefore, as an emerging research approach, soil microbial films are at the forefront for desertification combating. However, due to the mechanism of this improved process remains unclear, these knowledge gaps have been hindering soil microbial films to be an alternative to the traditional techniques for desertification combating. In this study, the controlled experiment was conducted in a greenhouse using the common aeolian soils and soil bacteria (and). 6 microbial agents (0, 1, 3, 5, 7 and 10 g/kg) were involved to test various soil properties and to identify the ecological function of soil microbial films. The results indicated that 1) Soil microbial films were successfully and largely induced by the microbial agents and clearly detected by the scanning electron microscope at multiple scales. In details, soil microbial cells first gathered, and then filled the space and cement aeolian soil particles using extracellular polymeric substances. In this process, soil microbial biomass carbon and nitrogen as well as soil polysaccharide were all increased, which were 2.41%-8.82%, 0.79%-8.60%, and 13.25%-55.13% higher than the control group, respectively. 2) On the 49thday of the experiment, most of the soil properties were increasing affected by soil microbial films as follow soil porosity (0.39% -3.91%), soil moisture (0.11%-0.25%,<0.05), soil aggregates (5.59%-25.01%), and soil pH value (from 7.16 to 8.32-9.23,<0.05). Soil bulk density was the only index which was in a deceasing tendency (0.54%-8.88%). 3) According to the redundancy analysis, soil polysaccharide was the most critical factor affecting aeolian soils with the highest interpretation rate (47%), followed by soil microbial biomass nitrogen and carbon. This was due to soil polysaccharide was main component of extracellular polymeric substances and played an important role in the formation of soil microbial films, backing up the ecological function of soil microbial films in soil improvement. In conclusion, soil microbial films effectively improve aeolian soils involving anti-erodibility and water retention. However, what is worth noting is that the microbial agents in a high concentration significantly increased soil pH resulting in soil salinization. Therefore, we highly recommended that the suitable microbial agents were 1-5 g/kg. Moreover, the recipe of adsorbent is also can be optimized to alleviate and curb soil salinization. This improved information is expected to provide a better understanding of the mechanism of soil microbial films affecting sand fixation and soil moisture, eventually and substantially contribute to a firm theoretical basis and scientific & technological support for the new technology exploration of desertification combating in a soil microbial approach.
soils; sand consolidation; microbial films;;extracellular polymeric substance; aeolian soil; water retention
杜宇佳,高广磊,陈丽华,等. 土壤微生物膜对风沙土固沙保水特性的影响[J]. 农业工程学报,2020,36(17):98-105.doi:10.11975/j.issn.1002-6819.2020.17.012 http://www.tcsae.org
Du Yujia, Gao Guanglei, Chen Lihua, et al. Effects of soil microbial films on sand fixation and water retention characteristics of aeolian soils[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2020, 36(17): 98-105. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2020.17.012 http://www.tcsae.org
2020-06-01
2020-08-23
国家重点研发计划项目(2018YFC0507101);中央引导地方科技发展项目;内蒙古自治区科技重大专项
杜宇佳,主要从事荒漠生态学研究。Email:duyujia@bjfu.edu.cn
高广磊,博士,副教授,主要从事荒漠化防治、荒漠生态学研究。Email:gaoguanglei@bjfu.edu.cn
10.11975/j.issn.1002-6819.2020.17.012
S157
A
1002-6819(2020)-17-0098-08
