子宫内膜胶原代谢与奶牛不孕症关系的研究
2020-10-21王国卿陈劭天张艺君
王国卿,李 琳,陈劭天,张艺君
(东北大学生命科学与健康学院,辽宁 沈阳 110819)
屡配不孕症是影响奶牛繁殖力的主要原因之一。该病患牛发情周期及发情表现均正常,生殖道也无可见异常,但输精3次以上仍不能受孕[1],其在奶牛养殖中的发病率为5%~36%[2],因产犊间隔延长和产奶量下降导致的经济损失达150~220欧元/头[3]。由于其病理机制尚不明确,至今仍缺乏有效的预防和治疗手段。胚胎着床失败是导致母牛不孕的主要原因[4],着床失败致使奶牛胚胎死亡率高达7.2%~29%[5];而胚胎着床不仅取决于胚胎质量,还与子宫内膜接受胚胎的能力密切相关,奶牛子宫内膜微环境是影响妊娠建立的决定性因素[6]。子宫内膜着床微环境主要由子宫内膜细胞和胶原(Collagen,CL)、层粘连蛋白(Laminin,LN)、纤粘连蛋白(Fibronectin,FN)等细胞外基质(Extracellular matrix,ECM)组分组成,基质金属蛋白酶(Matrix metalloproteinases,MMPs)是ECM降解和重塑的关键酶[7],通过调节ECM组成和分布以形成着床微环境。特别是MMP-2、MMP-9的显著高表达[8],使子宫内膜胶原降解、细胞间连接疏松,为胚泡植入提供必要条件。雌、孕激素水平是奶牛子宫内膜容受性形成的必要条件,而MMP-2、MMP-9对子宫内膜胶原的降解是影响子宫内膜容受性的关键原因之一;孕酮对MMPs具有抑制作用,胚胎着床又需要MMPs对ECM的降解,雌、孕激素是通过其受体发挥作用。因此子宫内膜雌激素受体(Estrogen receptor,ESR)和孕激素受体(Progesterone receptor,PGR)与MMPs间作用关系及其对胶原表达的影响,可能在屡配不孕症中发挥重要作用。为此本研究分析屡配不孕奶牛子宫内膜胶原的表达特点、代谢规律及雌、孕激素受体的调节作用,以探讨子宫内膜胶原酶代谢在奶牛子宫不孕症中的作用机制。
1 材料与方法
1.1 试验动物与分组 胎次为2~6 胎、体重为550~600 kg中国荷斯坦奶牛20头,由哈尔滨市某奶牛小区提供,其中健康奶牛10头,为对照组;发情周期及发情表现均正常,生殖道无可见异常,输精3次以上仍未受孕的屡配不孕症患牛10头,为试验组。
1.2 主要试剂 RNA提取、反转录试剂盒及PCR相关试剂、SYBR PremixExTaqII试剂盒,均购自宝生物工程(大连)有限公司;I、IV型CL抗体,购自北京博奥森生物技术有限公司;SP通用型免疫组化检测试剂盒,购自北京索莱宝科技有限公司。
1.3 主要仪器 荧光定量PCR仪,购自美国ABI公司;凝胶成像系统,购自美国BIO-RAD公司;全自动显微镜,购自德国Leica公司;Simple PCI图像分析系统,购自美国Compix公司。
1.4 样品采集 对照组与试验组奶牛于人工授精前利用子宫内膜活检采样器进行活体采样,以直肠把握法将采样器送入孕角,打开开口,用手经直肠将子宫壁按压到开口上,闭合开口时将子宫内膜切下并取出,按试验要求分别于液氮和-20 ℃保存,或4%多聚甲醛溶液固定。
1.5 子宫内膜胶原表达的测定 子宫内膜样品经4%多聚甲醛固定4~6 h,常规石蜡切片,片厚6~8 μm,脱蜡至水,按照通用型SP试剂盒说明书操作:3% H2O2室温处理5~10 min以灭活内源性酶,蒸馏水洗3次;0.4%胃蛋白酶抗原修复;滴加一抗并孵育,然后滴加二抗孵育后,DAB溶液显色,苏木精复染,梯度酒精脱水干燥,中性树胶封片。Leica全自动显微镜进行观察,选取代表性区域,以4×5序列方式连续取20个高倍视野(400倍),用Simple PCI图像分析系统进行分析,计算积分光密度(iOD)。
1.6 子宫内膜MMPs、PGR、ESR基因的测定 根据GenBank 中牛MMP-2、MMP-9、ESR-1、PGR和β-actin基因序列,应用Primer Premier 5.0 设计并合成5对特异性引物 (见表1)。子宫内膜组织总RNA 的提取、反转录均按相应试剂盒说明书进行操作。引物由上海捷瑞生物技术有限公司合成。

表1 引物序列及目的片段长度Table 1 Primer sequence and amplified fragment length
按照 SYBR PremixExTaqII试剂盒说明书,选用20 μL体系进行荧光定量PCR:ddH2O 5.6 μL,SYBR PremixExTaqII 10 μL,Rox Reference DyeⅡ 0.4 μL,上、下游引物(10 pmol/μL)各1 μL,模板cDNA 2 μL。反应条件:95 ℃ 预变性30 s;95 ℃ 5 s、60 ℃ 34 s、60 ℃ 34 s,40个循环;95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s,每个样品3个重复。应用ABI Step One荧光定量PCR仪进行扩增反应,数据用PCR仪自带软件分析。
1.7 统计方法 采用SPSS 19.0软件对数据进行统计分析,试验数据以“平均值±标准差”表示,采用一维方差对试验结果进行差异显著性分析,P<0.05 表示差异显著,P<0.01 表示差异极显著。
2 结果
2.1 子宫内膜胶原的表达 子宫内膜中Ⅰ型胶原、Ⅳ型胶原免疫组化染色结果见中插彩版图1,利用Simple PCI图像分析系统进行分析得到iOD 结果见表2。试验组子宫内膜中Ⅰ型胶原、Ⅳ型胶原的表达量均高于对照组,且差异极显著(P<0.01)。
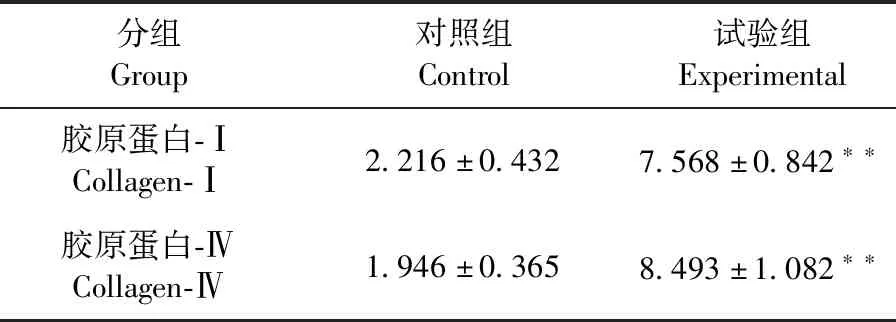
表2 子宫内膜Ⅰ型胶原、Ⅳ型胶原免疫组化染色分析结果Table 2 Immunohistochemical analysis of collagen Ⅰ and collagen Ⅳ in endometrium (iOD,×103,n=10)
2.2 子宫内膜PGR、ESR、MMP-2、MMP-9 mRNA的表达 奶牛子宫内膜PGR、ESR、MMP-2、MMP-9 mRNA表达的荧光定量PCR分析结果见图2,可见试验组MMP-2、MMP-9、PGRmRNA的表达量均显著低于对照组,且差异显著(P<0.05);ESRmRNA表达在试验组与对照组间差异不显著(P>0.05)。
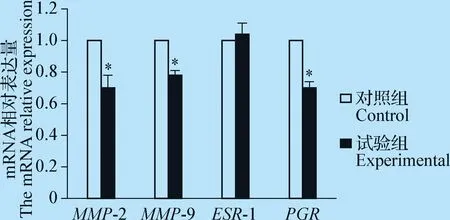
图2 子宫内膜PGR、ESR、MMP-2、MMP-9 mRNA表达的测定结果Fig.2 The expression of PGR,ESR,MMP-2 and MMP-9 mRNA in endometrium*:P<0.05,与对照组相比差异显著*:P<0.05,the difference was significant compared with the control group
3 讨论
受精卵未形成或胚胎着床障碍是屡配不孕的主要原因之一,胚胎着床的关键在于有着床能力的胚胎和有接受胚胎能力的子宫内膜在时间和空间上的同步性[9]。在着床期子宫内膜局部胶原及细胞外基质被降解,以形成利于着床的子宫内膜微环境,但当胶原表达过高时,导致子宫内膜致密,从而阻碍胚胎的着床植入。Ⅳ型胶原主要分布在基底膜,形成网状结构,支持基底膜与细胞间粘附并有滤过功能,Ⅳ型胶原作为胶原纤维具有抑制细胞DNA的合成,限制细胞增殖速度的作用。研究表明,随着Ⅳ型胶原在子宫内膜组织中表达增高,细胞DNA的合成速度受到抑制,也可导致胚泡发育不良和胚胎着床失败[10]。本研究表明,屡配不孕患牛子宫内膜中Ⅰ型胶原、Ⅳ型胶原的表达量均极显著(P<0.01)高于正常对照组,高表达的胶原使子宫内膜致密,阻碍着床,同时还对胚泡发育产生不利影响,导致着床失败。
MMPs是细胞外基质ECM降解和重塑的关键酶,通过降解ECM来调控子宫内膜着床微环境。Ping X 等[11]研究表明,MMP-9 蛋白在子宫内膜腺上皮细胞、腔上皮细胞和基质细胞的表达水平较高,有利于子宫内膜细胞外基质的降解,使细胞间连接疏松,便于绒毛滋养层细胞穿透母体子宫内膜;同时,有些MMPs 可被其他MMPs 家族成员(如MMP-2、MMP-3、MMP-7) 激活后发挥生物学作用[12]。丁峰等[13]研究发现早孕期TIMP-2 与MMP-2 的表达与滋养细胞的侵润活性成正比,可以推测滋养层细胞在浸润时可能也是MMP-2 起主导侵袭和转移的作用。由此可见,胶原酶对胶原的降解是限制和影响胚胎着床的关键因素之一。本研究发现,屡配不孕奶牛子宫内膜MMP-2、MMP-9 mRNA的表达量均显著低于对照组(P<0.05),说明胶原酶MMP-2、MMP-9 mRNA的低表达,使MMP-2、MMP-9对胶原的降解减弱,致使Ⅰ型胶原、Ⅳ型胶原蓄积,是子宫内膜致密,限制胚胎着床。
雌激素和孕酮调控生殖行为不仅取决于激素本身的分泌与代谢,还依赖于其子宫内膜受体的表达。尽管屡配不孕奶牛的生殖激素水平与健康牛相比无显著改变,但其雌激素受体与孕酮受体的改变也会影响到子宫内膜机能。在本研究中,屡配不孕牛子宫内膜孕酮受体的表达显著降低(P<0.05),说明子宫内膜孕酮受体的低表达可能与胚胎着床失败有关,但是否对胶原酶及胶原的表达产生影响,还有待进一步研究。
