MRTF-A参与一氧化氮诱导的乳腺癌迁移相关基因表达
2020-10-21卢玉琳何红鹏
卢玉琳,胡 娟,李 智,何红鹏
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
乳腺癌作为女性重大恶性肿瘤,其发病率有逐年升高趋势,且发病年龄呈年轻化倾向[1].乳腺癌对生命的主要威胁来自肿瘤细胞的转移,包括肺转移、脑转移等.肿瘤转移是一个复杂的、多步骤过程.细胞迁移能力的增强是肿瘤转移的必要条件之一[2].
一氧化氮(NO)是重要的生物活性气体分子,在细胞内主要以 L-精氨酸为底物,由一氧化氮合酶(NO synthase,NOS)催化合成[3].正常情况下,NOS仅在血管内皮细胞和神经细胞中表达,分别被称为神经型 nNOS/NOS1和上皮型 eNOS/NOS3.在炎症发生时,巨噬细胞也能表达 NOS;另外,恶性肿瘤细胞也能高水平表达 NOS,在巨噬细胞和恶性肿瘤细胞表达的是诱导型 NOS,即 iNOS/NOS2.iNOS/NOS2在炎症和恶性肿瘤中通过催化 NO合成发挥促炎和促癌作用[4-5].
在体内,NO主要通过两种方式发挥其作用:一是通过经典的NO-cGMP信号途径;二是通过对蛋白质进行翻译后修饰作用,即蛋白质的硝基化和亚硝基化修饰,继而影响蛋白质活性、细胞内定位以及蛋白质相互作用[6-7].在恶性肿瘤发病中,NO可以诱导肿瘤血管生成,影响肿瘤细胞增殖、凋亡和转移[6-8],但是到目前为止,NO影响乳腺癌转移的分子机制仍不确定.
MRTF-A(myocardin-related transcription factor-A)是血清反应因子(serum response factor,SRF)的转录辅助因子.大量研究证明,MRTF-A能够调节细胞迁移相关基因 MYL9(myosin regulatory light chain 9)、MYH9(non-muscle myosin heavy chain 9)和CYR61(cysteine-rich angiogenic inducer 61)等基因的表达,增强细胞的迁移能力,在肿瘤转移中发挥重要作用[9-11].虽然NO与MRTF-A均促进乳腺癌转移,但是二者之间的关系未见文献报道.
硝普钠(sodium nitroprusside,SNP)是一种硝酸酯类的扩血管药物,常用于高血压的治疗.在体内,SNP转化为NO气体分子并与血管平滑肌受体结合,使血管平滑肌松弛;在实验室中,SNP是一种常用的NO供体,常用于NO功能研究.
在乳腺癌患者中,70%~80%为雌激素受体阳性,故本研究以 SNP作为 NO供体处理雌激素受体阳性的乳腺癌 MCF-7细胞,探究 NO对癌细胞迁移的影响,并在分子水平研究 NO促进 MCF-7细胞迁移的作用机制.
1 材料与方法
1.1 材料
乳腺癌细胞 MCF-7购自中国科学院细胞库.胎牛血清,天津康源生物技术有限公司;细胞完全培养基 F12,HyClone公司;SNP、Hemoglobin(NO 清除剂)、Hoechst、一氧化氮检测试剂盒(S0021),上海碧云天生物技术有限公司;TurboFectTM体外转染试剂,Thermo Fisher公司;Trizol试剂、M-MLV 逆转录试剂盒,美国 Invitrogen 公司;SYBR GREEN染料,德国 DBI 公司;青霉素、链霉素等,北京索莱宝科技有限公司.iNOS/NOS2的小干扰RNA由广州锐博公司设计并合成(siNOS2 1#GUGCGUUACUCCACCAAC AdTdT;siNOS2 2#CGUGCAAACCUUCAAGGCAdT dT;siNOS2 3#CCAGAAGCGCUAUCACGAAdTdT).MRTF-A敲低质粒shMRTF-A由本实验室构建[12].
1.2 方法
1.2.1 细胞培养与转染
F12培养基添加 10%灭活胎牛血清、100U/mL青霉素和 100μg/mL链霉素,细胞置于 37℃、5%CO2培养箱中培养.
转染前 1d用 6孔板进行细胞接种,2d时细胞密度约为70%.用TurboFect转染试剂按说明书步骤转染 siRNA或 shRNA,使 siRNA的终浓度为100nmol/L,shRNA质粒用量为每孔 4μg.将 6孔板转移至 37℃、5% CO2培养箱培养 6h,更换培养基为含有10%胎牛血清的完全培养基继续培养48h.
1.2.2 Griess法检测NO浓度
采用 NO检测试剂盒,按照说明书推荐步骤操作.首先,用细胞培养液稀释试剂盒提供的标准品NaNO2,使对应 NO 浓度范围为 1~100μmol/L.然后,按每孔50μL,在 96孔板中分别加入标准品及样品.再依次加入等体积的 Griess试剂Ⅰ和Ⅱ,在常温下反应 10min.将反应后的产物转移到酶标板内,在酶标仪上检测 540nm处的吸光度.根据标准曲线计算细胞培养基的NO浓度.
1.2.3 MTT法检测细胞活性
对数生长期细胞悬浮并计数,取 100μL接种于96孔板,使细胞密度为 2000个/孔.于 CO2培养箱孵育至细胞密度为70%,加入不同浓度SNP,继续培养 24h.每孔加入 20μL MTT溶液(5mg/mL),继续孵育 4h.吸去培养液,每孔加入 150μL二甲基亚砜(DMSO),避光低速振荡 10min,使结晶物充分溶解.在酶联免疫检测仪测定 490nm处各孔的吸光度,计算细胞活性.
1.2.4 Hoechst法和流式细胞术检测细胞凋亡
MCF-7细胞加药处理24h后,用PBS洗3次;每孔加入 1mL 4%多聚甲醛,室温放置 15min,PBS洗 3次;加适当比例稀释的 Hoechst,37℃避光孵育1h;PBS洗3次,每次5min;在共聚焦显微镜下观察细胞核形态并拍照记录结果.
贴壁生长的细胞经胰酶消化后,用 PBS漂洗吹悬.按PI-Annexin V凋亡检测试剂盒步骤,加入1×binding buffer,800r/min离心10min;加入500μL binding buffer吹悬细胞,使细胞浓度为105~106mL-1;加入5μL Annexin V-FITC和5~10μL PI染色,轻轻混匀,室温避光孵育15min;根据设定好的程序使用C6型流式细胞仪(BD公司)进行检测,并用CFlow Plus软件分析结果.
1.2.5 细胞划痕愈合实验
将细胞按每孔 1×105个细胞接种于 6孔板,37℃、5% CO2培养箱中静置培养24h后在每孔中央用 10μL吸头形成划痕.用 PBS充分洗去漂浮细胞.向各孔细胞中加入含不同浓度的 SNP的无血清培养基培养.划痕完成后每隔 12h在显微镜下观察划痕宽度变化情况,拍照并计算细胞迁移率.

1.2.6 Transwell细胞迁移实验
将状态良好的 MCF-7细胞按照每孔约 5×105个细胞铺在 24孔 Transwell上层小室;下室加含10% FBS的培养液,培养24h后,用棉签将上室中未迁移的细胞擦掉,用4%多聚甲醛溶液固定,DAPI染核,通过激光扫描共聚焦显微镜拍照并计数上、下、左、右、中 5个视野下的细胞数,计算相对细胞迁移率.

1.2.7 实时荧光定量PCR(Real-time PCR)
4℃条件下用 Trizol裂解细胞,提取总 RNA,进行逆转录得到cDNA,随后进行Real-time PCR.引物序列为 GAPDH 上游 5′-ATTCAACGGCACAGTCA AGG-3′,下游 5′-GCAGAAGGGGCGGAGATGA-3′;MYL9 上游 5′-ATTCAACGGCACAGTCAAGG-3′,下游 5′-GCAGAAGGGGCGGAGATGA-3′;NOS2 上游5′-AGCGGTAACAAAGGAGATAGA-3′,下游 5′-CTT GGTGGCGAAGATGAG-3′;MRTF-A 上游 5′-ACCG TGACCAATAAGAATGC-3′,下游 5′-CCGCTCTGA ATGAGAATGTC-3′;MYH9 上游 5′-AGCGTTACT ACTCAGGGCTCATC-3′,下游 5′-TCATACTCCTGT AGGCGGTGTCT-3′;CYR61 上游 5′-AGGATAGTAT CAAGGACCCC-3′,下游 5′-TCCATTCCAAAAACA GGGAG-3′.Real-time PCR 反应条件:95℃预变性2min,40个循环,每个循环 95℃变性 10s,60℃退火 30s,95℃延伸 1min,95℃终止反应 10s,以ΔΔCt法对结果进行计算,GAPDH为内参.
1.2.8 免疫印迹(Western blot)检测蛋白表达水平
收集处理组及对照组的细胞,加入SDS裂解液,提取细胞总蛋白,进行SDS-PAGE电泳,通过半干电转移法将蛋白转移至硝酸纤维素膜.用封闭液室温封闭1h,分别用MYH9抗体(Santa Cruz)、MYL9抗体(Santa Cruz)、CYR61 抗体(Santa Cruz)、MRTF-A抗体(Proteintech)、GAPDH 抗体(Santa Cruz)孵育,4℃过夜,洗膜后加入相对应的二抗(山羊抗兔荧光二抗、山羊抗鼠荧光二抗)室温避光孵育 1.5~2h,洗膜3次,用Oddysey成像系统扫膜记录结果.
1.3 统计学分析
实验数据使用 SPSS v13.0软件处理;各组实验数据以“均值±标准差”表示.组间统计学差异分析采用t检验,*表示P<0.05,**表示P<0.01.
2 结果与分析
2.1 不同浓度NO对MCF-7细胞增殖的影响
为了确定 SNP作为细胞外 NO供体的有效性,利用 Griess法检测加 SNP 24h后培养基中 NO含量,结果如图 1所示.与未加药组相比,不同浓度SNP均可以释放 NO,且 NO含量随着加入 SNP浓度升高而增加,确定了 SNP作为 NO供体药物的有效性.
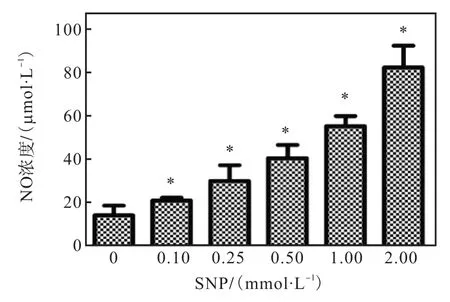
图1 SNP处理后细胞培养基中NO含量测定Fig. 1 Concentrations of NO in culture medium after SNP treatment
为观察 SNP对 MCF-7细胞活性的影响,进行MTT实验,结果如图 2所示.当 SNP浓度低于0.5mmol/L时,对 MCF-7细胞活性无显著抑制;但SNP浓度高于 0.5mmol/L时,活细胞数量明显下降.这表明高浓度NO抑制MCF-7细胞增殖.
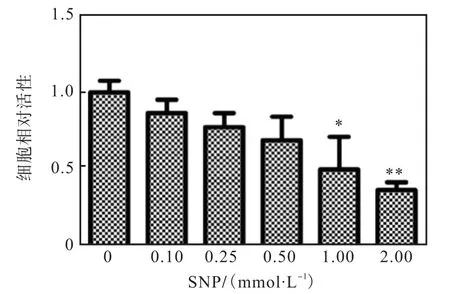
图2 SNP对MCF-7细胞增殖的影响Fig. 2 Effect of SNP on MCF-7 cell proliferation
2.2 高浓度NO对MCF-7细胞凋亡的影响
上述 MTT实验结果显示,当 SNP浓度高于0.5mmol/L时细胞活性降低.在实验中观察到高浓度SNP处理导致细胞漂浮,提示发生了细胞凋亡.为了证明这一猜测,首先,通过流式细胞仪检测细胞的凋亡情况,结果如图 3所示,用 1mmol/L或 2mmol/L SNP处理24h后,凋亡细胞比率明显升高,且与SNP浓度正相关,表明高浓度NO诱导MCF-7细胞凋亡.
为了进一步确定SNP诱导MCF-7细胞凋亡,采用Hoechst染色观察高浓度SNP对细胞核形态的影响,结果如图4所示.
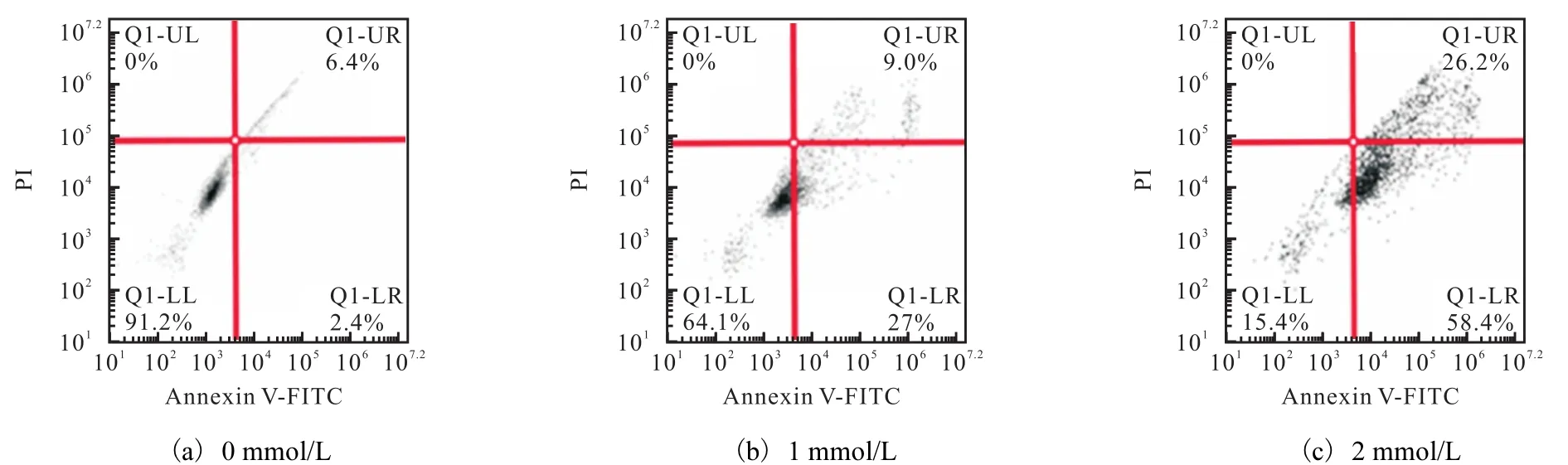
图3 高浓度SNP对MCF-7细胞凋亡的影响Fig. 3 High concentration SNP inducing the apoptosis of MCF7 cells
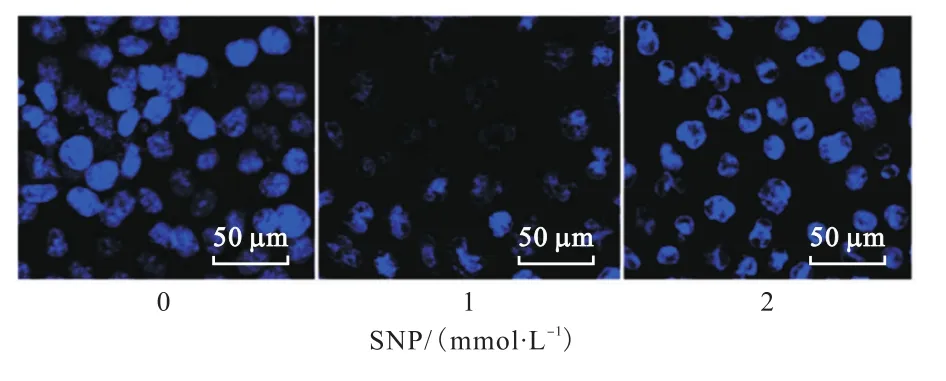
图4 Hoechst染色观察细胞核内DNA聚集状态Fig. 4 DNA aggregation visualized with Hoechst staining
用 1mmol/L或 2mmol/L SNP处理后,MCF-7细胞核明显皱缩,DNA在核膜下聚集并出现“冒状”结构,提示细胞凋亡发生.Hoechst染色结果和 PIAnnexin V检测结果一致,证实NO供体SNP浓度高于0.5mmol/L时诱导乳腺癌MCF-7细胞凋亡.
2.3 低浓度NO对MCF-7细胞迁移的影响
图 2—图 4的结果证明:SNP浓度高于0.5mmol/L时具有细胞毒性,诱导细胞凋亡.为观察NO对 MCF-7细胞迁移能力的影响,选择低浓度SNP处理细胞.首先,进行了划痕愈合实验.结果显示:与对照组相比,当加入的 SNP浓度低于0.5mmol/L时,SNP促进乳腺癌细胞系 MCF-7的迁移(图5).
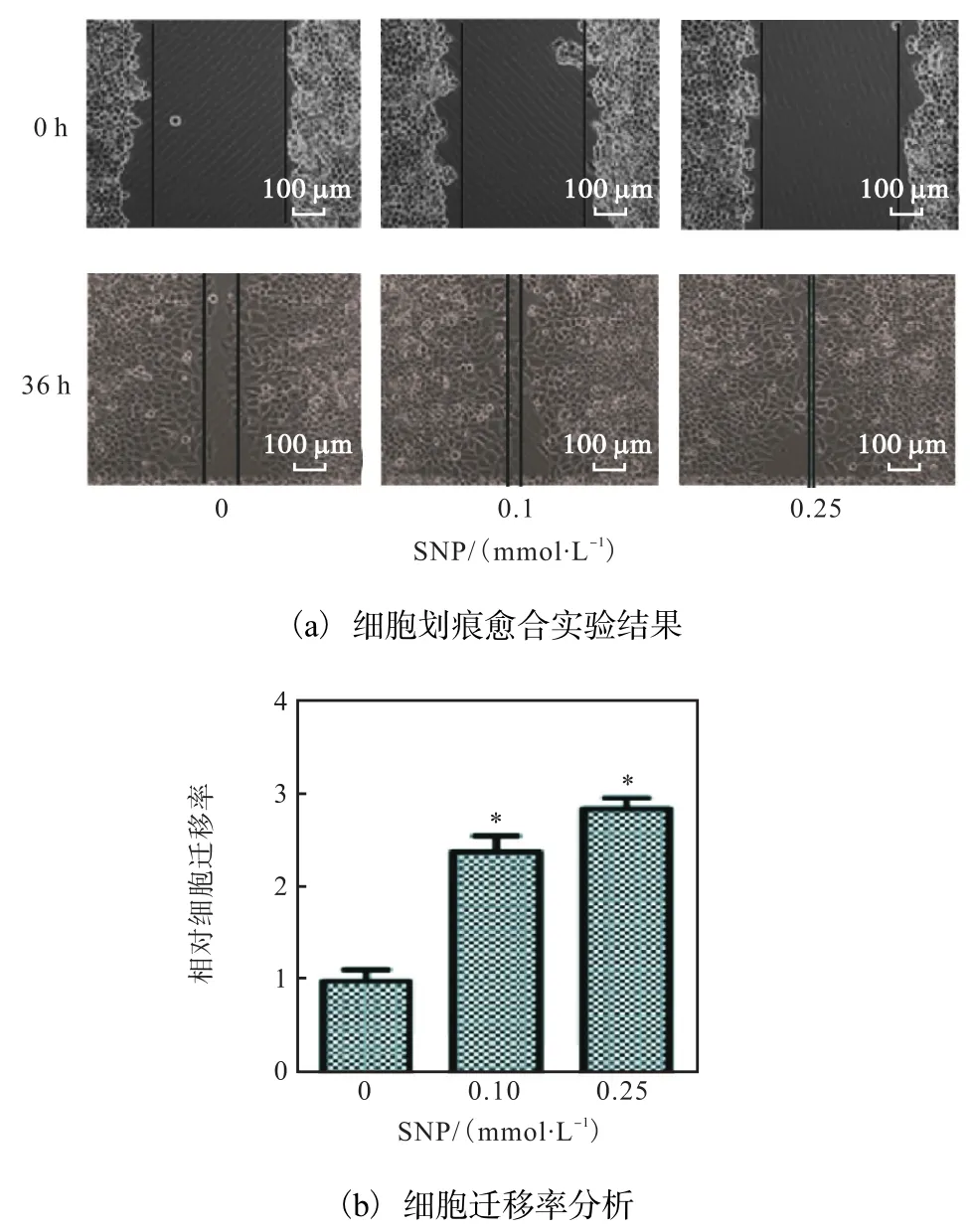
图5 划痕实验观察SNP对MCF-7迁移的影响Fig. 5 Wound-healing assay of SNP-treated MCF-7 cells
为了进一步证明此结果,则进行 Transwell实验,结果如图6所示.SNP浓度为0.25mmol/L时可以明显促进 MCF-7细胞的迁移,细胞迁移率增加至3倍左右,与划痕实验结果一致.以上结果证明 SNP对乳腺癌细胞MCF-7的影响取决于SNP浓度,提示低浓度NO促进MCF-7细胞迁移.
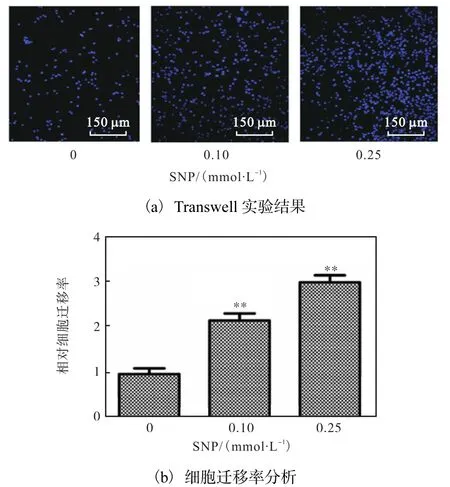
图6 Transwell实验观察SNP对MCF-7迁移的影响Fig. 6 Transwell assay of SNP-treated MCF-7 cells
2.4 低浓度NO对迁移相关基因表达的影响
为了探究低浓度NO影响MCF-7细胞迁移的分子机制,用 0.1mmol/L或 0.25mmol/L SNP处理细胞,提取RNA,利用Real-time PCR方法检测迁移相关基因MYH9、MYL9和CYR61的mRNA水平,结果如图7所示.
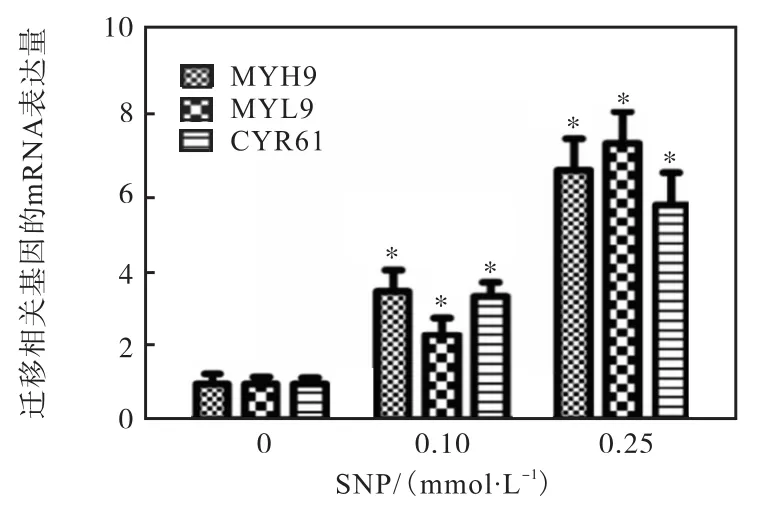
图7 SNP促进细胞迁移相关基因mRNA表达Fig. 7 SNP stimulated the expression of migration-related genes in MCF-7 cells
SNP增强了迁移标志基因的表达.结合图 5和图6所示的细胞迁移率的变化可以推测,低浓度NO可能是通过上调细胞内迁移相关基因表达促进MCF-7的迁移.
2.5 NO清除剂对迁移相关基因表达的影响
血红蛋白(Hemoglobin,HB)是一种常用的 NO清除剂.为了证明 SNP通过产生 NO影响细胞迁移能力,用HB预处理细胞 1h后再加0.25mmol/L的SNP 继续处理 24h,分别检测 mRNA和蛋白表达水平.结果如图 8所示,0.25mmol/L SNP 促进迁移相关基因表达(比较第2组与第1组),但HB处理后,SNP不再促进迁移相关基因表达(比较第3组与第1组),因此推测SNP通过释放NO上调细胞迁移相关基因表达.
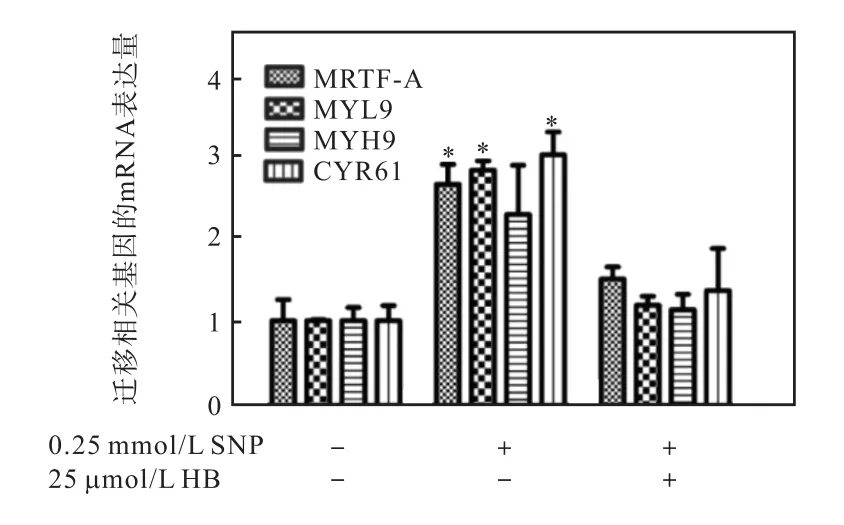
图8HB消减 SNP对迁移相关基因 mRNA表达的上调作用Fig. 8 Effect of HB on SNP-induced upregulation of migration-related genes
前期研究证明 MYH-9、MYL-9和 CYR61基因表达受转录辅助因子 MRTF-A调控[9].本实验也检测了 MRTF-A表达水平,发现 0.25mmol/L的 SNP促进 MRTF-A表达(图 8).此结果提示 MRTF-A可能介导了 NO对迁移相关基因 MYH-9、MYL-9和CYR61表达的促进作用.
2.6 敲低 NOS2对 MRTF-A及其调控的迁移相关基因表达的影响
乳腺癌细胞内源性 NO的产生主要由诱导型一氧化氮合酶,即 iNOS/NOS2催化.为了证明细胞内源性NO在乳腺癌转移中的作用,本研究利用siRNA敲低 iNOS/NOS2,检测 MRTF-A及其下游迁移相关基因的表达变化.首先,检测 siRNA工作效率,结果如图 9(a)所示,NOS2的 3个 siRNA序列的敲低效率分别在 45%~65%.选取敲低效率最高的 1#序列用于后续实验.在此条件下,MRTF-A及其靶基因的mRNA 表达水平不同程度下降(图 9(b)),说明乳腺癌细胞内源性 NO对迁移相关基因表达发挥促进作用.
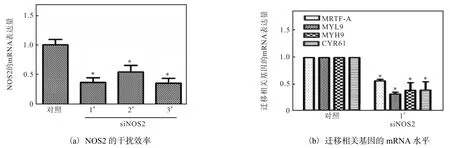
图9 敲低NOS2对迁移相关基因mRNA表达的影响Fig. 9 Effects of NOS2 knockdown on the mRNA expression of migration-related genes
2.7 敲低MRTF-A对NO诱导迁移相关基因表达的影响
MRTF-A 是迁移相关基因 MYH9、MYL-9和CYR61表达的重要调控因子,而且外源性和内源性NO均诱导 MRTF-A表达(图 8和图 9).为了验证NO对迁移相关基因表达的影响是否与 MRTF-A有关,利用 shRNA质粒敲低 MRTF-A,再加入0.25mmol/L SNP处理 12h,检测迁移相关基因表达的变化,结果如图10所示.
转染 shMRTF-A质粒导致 MRTF-A的 mRNA水平下降约 70%(图 10(a)),蛋白水平也显著下降(图 10(c));转染 shMRTF-A 同时加 0.25mmol/L SNP处理后,与对照组相比,MRTF-A的 mRNA水平无明显下降((图 10(a)),蛋白水平无明显变化((图 10(c)),提示 shMRTF-A 抵消 SNP对 MRTF-A表达的促进作用.
同样条件下检测迁移相关基因表达(图 10(b)和(c)),结果显示:敲低 MRTF-A,MYH9、MYL-9和CYR61的mRNA水平和蛋白水平均下降;加SNP共处理组,与对照组相比,MYH9、MYL-9和CYR61的mRNA和蛋白水平均无明显变化.此结果说明:MRTF-A表达水平低时,迁移相关基因表达下降;而在 shMRTF-A和 0.25mmol/L SNP共处理细胞中,MRTF-A蛋白水平不变,此时,SNP不能诱导MYH9、MYL9和CYR61表达,证明MRTF-A对NO促进迁移相关基因表达非常重要.
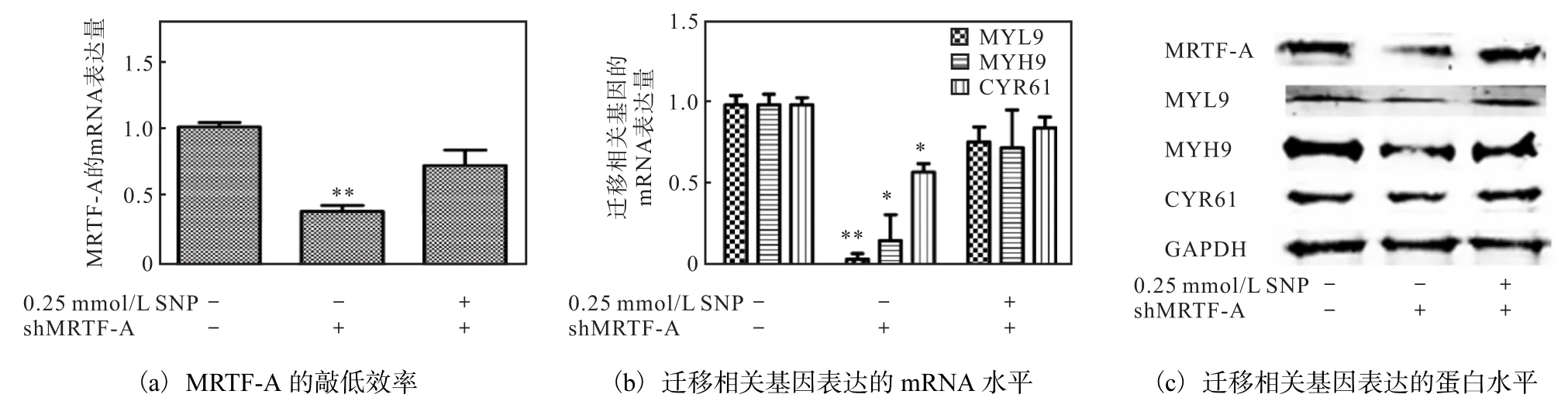
图10 敲低MRTF-A同时加SNP对迁移相关基因表达的影响Fig. 10 Effects of shMRTF-A and SNP co-treatment on the expression of migration-related genes
3 讨 论
一氧化氮是重要的生物活性分子,在生理和病理条件下都有重要作用.在乳腺癌细胞中,内源性 NO主要由iNOS催化产生.由于iNOS在肿瘤细胞中高表达,而且 iNOS表达水平与乳腺癌临床分期相关,在恶性度高的组织中,iNOS表达水平高[10-11],所以一般认为NO是促进癌细胞增殖和转移、促进肿瘤血管增生的促癌因子,使iNOS成为乳腺癌治疗的靶分子[12-16].但是,也有研究[11,17]表明 NO对肿瘤的影响取决于NO的浓度和肿瘤微环境,高浓度NO诱导肿瘤细胞凋亡,低浓度 NO促进肿瘤细胞转移.本研究结果也证实了这一现象.关于低浓度NO促进癌细胞转移的分子机制颇为复杂,目前有几种学说:(1)NO激活肿瘤细胞内多个信号途径,如PI3K/PKB信号途径、MAPK信号途径、EGFR信号途径等促进肿瘤细胞发生上皮-间质表型转化,增强肿瘤细胞转移能力;(2)NO增强缺氧诱导因子HIF蛋白稳定性,促进肿瘤组织血管形成;(3)NO调节细胞外基质金属蛋白酶活性,改变肿瘤微环境,促进肿瘤侵袭和转移;(4)调节肿瘤细胞代谢[16,18].基于低浓度 NO在肿瘤发病中的作用,iNOS被认为是乳腺癌治疗的靶分子[19].
本课题组前期研究证明转录辅助因子 MRTF-A调控的迁移相关基因表达在乳腺癌转移中发挥重要作用[11].为探索 MRTF-A在 NO诱导乳腺癌转移中的作用,检测了 NO对转录调控因子 MRTF-A及其下游的迁移标志基因 MYH9、MYL9和 CYR61表达的影响,发现低浓度 NO促进 MRTF-A及其下游靶基因的表达,而NO对这些基因表达的促进作用依赖于 MRTF-A的存在.此结果提示利用 siRNA敲低MRTF-A表达水平或用小分子化合物抑制 MRTF-A活性可能对iNOS高表达的乳腺癌转移有抑制作用.
浸润性生长和远距离转移是包括乳腺癌在内恶性肿瘤的病理特征,也是恶性肿瘤致死的主要原因.探究在乳腺癌转移的分子机制对于乳腺癌的预防和治疗具有重要意义.本研究主要在细胞水平和分子水平初步探索了MRTF-A在NO诱导乳腺癌转移中的作用,下一步将进行更深入的分子机制研究和动物水平研究,以期为乳腺癌治疗提供新的思路.
