磷脂酶D在枯草芽胞杆菌中表达及酶法催化合成磷脂酰丝氨酸的研究
2020-10-21毛淑红马晓雨张朝晖王晓蕊路福平刘逸寒
毛淑红,马晓雨,张朝晖,王晓蕊,王 珊,路福平,刘逸寒
(工业发酵微生物教育部重点实验室,天津市工业微生物重点实验室,天津科技大学生物工程学院,天津 300457)
磷脂酰丝氨酸(phosphatidylserine,PS),又称为丝氨酸磷脂、二酰甘油酰磷酸丝氨酸[1],是大脑细胞膜的重要组成成分之一[2],其在激活脑细胞的过程中起着非常重要的作用[3].PS能够显著缓解压力、加速恢复用脑疲劳、平衡情绪[4];还可以与 DHA 相互促进吸收,有助于保护中枢神经系统[5],从而促进胎儿智力的发育.此外,PS是一种有效的运动营养补充品,可以对抗运动引起的压力,并通过减缓运动引起的皮质醇水平升高来防止生理恶化[6].因此,PS被誉为继胆碱及“脑黄金”DHA 后,又一大新兴的“智能营养素”[7],是一种相对安全、潜在有效的治疗剂[8],可应用于功能食品和制药行业中.
但是,PS在动植物中含量较少,制备困难.传统生产方法是从动物器官中提取(如牛脑等[9]),但由于传染性疾病(如牛海绵状脑病)的存在使之暗含一定的安全隐患[10].目前,主要采用以大豆为原料进行提取,但原料利用率及产率较低[11].因此,利用磷脂酶D(phospholipase D,PLD)催化磷脂酰胆碱(PC)与L-丝氨酸转酯反应,实现酶法合成PS,成为其制备的一个新思路.磷脂酶是在生物体中存在的能水解甘油磷脂的一类酶,其中 PLD可以特异地作用于磷脂分子中的磷酸二酯键,被广泛用于甘油磷脂的改造[12].大多数 PLD的来源菌株为链霉菌属[13],主要由土壤中筛选获得[14].除此之外,棒状杆菌(Corynbacterium)[15]、大肠杆菌(Escherichia coli)[16]、副流感嗜血杆菌(Haemophilus parainfluenza)[17]以及假单胞菌(Pseudomonas)[18]等微生物中也相继发现 PLD 的存在.与动植物来源 PLD相比,微生物尤其是链霉菌来源的 PLD具有较强的底物耐受特性、较好的底物专一性以及较高的催化活性,因而备受关注.
为进一步提高PLD的生产水平,减少纯化步骤,降低生产成本,国内外对链霉菌 PLD的研究主要集中在 PLD的异源表达方面.Hatanaka等[19]获得了来源于间隔链霉菌(Streptomyces septatus)TH-2的PLD,并分析其水解活性,发现水解活性的最适温度为50℃,最适pH为5.0;Nakazawa等[20]分离得到一株链霉菌 10-3,其具有较高的 PLD 水解活性,最适温度及 pH分别为 50℃和 7.5;可见,围绕链霉菌来源 PLD的性能分析主要体现在水解活性上.另外,Tao等[21]将郝氏链霉菌(S. halstedii)来源 PLD 在不同的宿主中进行表达,发现以变铅青链霉菌(S. lividans)为宿主同源表达时,PLD 活性可达69.12U/mL,而在大肠杆菌(Escherichia coli)和毕赤酵母(Pichia pastoris)中 PLD表达活力较低,分别为1.21U/mL和 2.36U/mL;Hou等[22]利用谷氨酸棒杆菌(Corynebacterium glutamicum)异源表达来源于链霉菌属(Streptomyces sp.)的 PLD,经优化表达后使PLD活力达到 1.90U/mL,为初始活力的 7.6倍.但是到目前为止,围绕pld基因在枯草芽胞杆菌中表达的报道仍相对较少.枯草芽胞杆菌作为重要的工业发酵宿主菌株之一,具有食品级安全性[23]、无内毒素、可胞外分泌外源蛋白[24]等优点,以其作为表达宿主实现PLD的分泌表达,对于PS的高效制备具有重要意义.
因此,本研究利用枯草芽胞杆菌表达系统,对实验室前期筛选获得的郝氏链霉菌(Streptomyces halstedii)TCCC21102来源 PLD进行异源表达;在对其转酯活性的酶学性质研究基础上,构建单水相酶法催化合成 PS反应体系,旨在为 PS在食品及制药行业的应用提供基础理论依据.
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
具有枯草芽胞杆菌密码子偏爱性的来源于郝氏链霉菌(Streptomyces halstedii)TCCC21102的pld基因由苏州金维智生物科技有限公司合成.宿主枯草芽胞杆菌(Bacillus subtilis)WB600和表达载体pWB980均保存于本实验室.
1.1.2 主要试剂
限制性内切酶 HindⅢ、限制性内切酶 BamHⅠ、T4DNA 连接酶,宝生物工程(大连)有限公司;卡那霉素抗性,北京索莱宝科技有限公司;磷脂酰丝氨酸,Sigma-Aldrich公司;大豆卵磷脂(PC,≥90%)、L-丝氨酸,上海源叶生物科技有限公司;质粒小量快速提取试剂盒、细菌 DNA提取试剂盒、切胶回收试剂盒,OMEGA Bio-Tek公司;其他试剂均为分析纯.
1.1.3 培养基
枯草芽胞杆菌的培养使用 LB液体培养基(g/L):蛋白胨 10,酵母提取物 5,氯化钠 10,卡那霉素抗性(终质量浓度为100μg/mL),pH 7.0.
1×SP 盐培养基(g/L):K2HPO4·3H2O 18.34,KH2PO46.0,(NH4)2SO42.0,MgSO4·7H2O 0.2,柠檬酸钠1.0.
SPⅠ培养基(100mL):1×SP盐培养基 97.6mL,酪蛋白水解物(0.05g/mL)400μL,酵母汁(0.1g/mL)1mL,葡萄糖(0.5g/mL)1mL.
SPⅡ培养基(100mL):由1×SP盐培养基 99mL,CaCl2·7H2O(0.0147g/mL)500 μL,MgCl2·6H2O(0.1017g/mL)500μL,用于枯草芽胞杆菌WB600菌株感受态的制备以及转化.
1.2 方法
1.2.1 重组质粒的构建
将合成的 pld基因及载体 pWB980均采用限制性内切酶 HindⅢ、BamHⅠ进行双酶切,利用SolutionⅠKit进行连接,得到重组质粒 pWB980-pld并测序比对成功.
1.2.2 重组质粒转化枯草芽胞杆菌
枯草芽胞杆菌 WB600接种单菌落于 LB液体培养基,培养过夜后转入SPⅠ培养基,培养至对数生长末期转入 SPⅡ培养基,37℃、100r/min摇床培养1.5h;10mmol/L EGTA 20μL加入至上述 SPⅡ培养基的菌体中,37℃、100r/min摇床培养 10min;加入上述连接好的重组质粒 pWB980-pld,100r/min培养30min,调节转速至 220r/min,继续培养 1.5h;离心去上清液后涂布于含有100μg/mL卡那霉素(Kan)的LB筛选平板,筛选阳性转化子进行验证,获得枯草芽胞杆菌重组菌株WB600/pWB980-pld.
1.2.3 重组PLD的表达
将构建完成的枯草芽胞杆菌 WB600/pWB980-pld在含有卡那霉素抗性的液体LB培养基中37℃、220r/min进行发酵培养,每 12h进行取样,4℃、4000r/min离心后收集上清液,进行重组 PLD(rPLD)活力检测,每组 3个平行,将最高活力设为100%.同时,选取发酵 24h的上清液进行聚丙烯酰胺凝胶电泳(SDS-PAGE)检测.
1.2.4 转酯酶活力检测
含有 1.3mmol/L PC、3.9mmol/L L-丝氨酸和10mmol/L CaCl2的1mL 0.2mol/L醋酸-醋酸钠缓冲液(pH 5.5)于 40℃保温 10min,加入稀释的发酵上清液(1mL),在40℃下反应30min.
样品检测采用高效液相色谱进行检测,色谱条件:色谱柱为硅胶柱(5μm,2.1mm×150mm),流动相为 V(乙腈)∶V(甲醇)∶V(磷酸)=475∶25∶4,流量 0.30mL/min,紫外检测器检测波长 205nm,柱温箱温度25℃.
转酯酶活力定义:在 1min内可催化 PC生成1μmol PS所需的酶量.PLD活力(U/mL)按照式(1)计算.

式中:mps为PS的产量,μg;n为稀释倍数;Mps为 PS的摩尔质量,792.081g/mol;t为反应时间,min.
1.2.5 重组PLD酶学性质分析
rPLD 经纯化后(纯化方法参考文献[25]),分别进行转酯酶活力的最适温度和最适pH测定.
rPLD 最适温度测定:在 20、30、40、50、60℃下进行酶活力测定.
rPLD 最适 pH 测定:在 pH 为 4.0、5.0、5.5、6.0、7.0、8.0下进行酶活力测定.
每组实验分别进行3个平行,酶活力最高活性设定为100%,测定相对酶活力.
1.2.6 PS合成条件优化
PS合成体系为 6mL,所用缓冲液为 0.2mol/L醋酸-醋酸钠缓冲液(pH 5.5),其中分别含有不同物质的量比的 PC 和 L-丝氨酸(1∶1、1∶2、1∶3、1∶4、1∶5),即PC浓度为1.3mmol/L,L-丝氨酸浓度分别为 1.3、2.6、3.9、5.2、6.5mmol/L,10mmol/L CaCl2,4U/mL的 rPLD,经40℃反应12h后,通过测定PS产率以确定最佳底物物质的量比;在最佳底物物质的量比条件下,于 6mL 0.2mol/L醋酸-醋酸钠缓冲液(pH 5.5)中分别加入不同酶量(1、2、3、4、5、6U/mL)的 rPLD,在 40℃下反应 12h,通过测定 PS产率以确定最佳 rPLD用量;在最佳底物物质的量比和rPLD用量条件、6mL 0.2mol/L醋酸-醋酸钠缓冲液(pH 5.5)的催化体系中,分别在 40℃下反应 6、12、24、36、48、60h,通过测定 PS产率以确定最佳反应时间.
利用PS标准曲线按照式(2)计算PS产率.

2 结果与分析
2.1 重组质粒的构建
根据枯草芽胞杆菌密码子的偏爱性,经密码子优化后的S. halstedii TCCC21102来源的pld基因全长为1542bp,与优化前的原始基因相比,序列有464个碱基发生改变,并且GC含量由71.3%下降到44.3%;载体pWB980全长为4735bp.如图1所示,pld基因及 pWB980质粒经 HindⅢ和 BamHⅠ酶切后,条带大小在1500bp(泳道1)和4700bp(泳道2)左右.
2.2 重组菌株的构建
pld基因与 pWB980经酶切连接后构建获得pWB980-pld,其质粒图谱如图 2(a)所示.经化学转化法转化入枯草芽胞杆菌 WB600中,经过卡那霉素抗性筛选,提取重组质粒pWB980-pld(图 2(b),泳道1),经 HindⅢ和 BamHⅠ双酶切后获得大小约为1500bp和 4700bp的两条片段(图 2(b),泳道 2),说明重组菌株WB600/pWB980-pld构建成功.

图1 pld基因及pWB980载体酶切图Fig. 1 Restriction analysis of pld gene and pWB980 vector
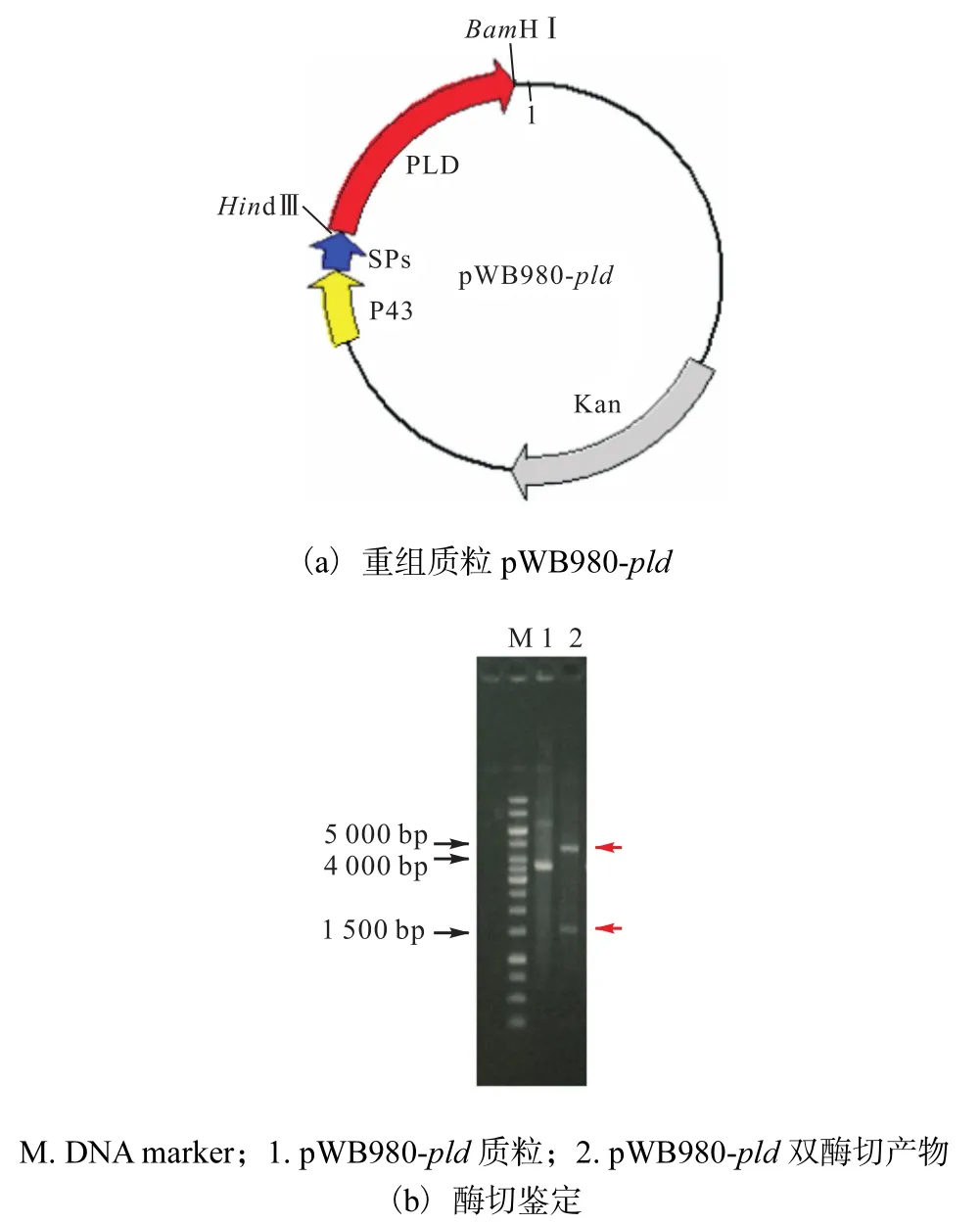
图2 重组质粒pWB980-pld的质粒图谱以及酶切鉴定Fig. 2 DNA map and restriction analysis of the recombinant plasmid pWB980-pld
2.3 重组PLD的表达
2.3.1 重组PLD的表达与纯化及其酶活力测定
收集重组菌株WB600/pWB980-pld的24h发酵上清液,以原始菌株 WB600作为对照,进行 SDSPAGE检测,如图 3所示.rPLD相对分子质量约为5.50×104(泳道 1),而对照菌株未见相应条带(泳道2),表明rPLD成功在枯草芽胞杆菌中分泌表达.
2.3.2 重组PLD最佳表达时间的确定
不同发酵时间的rPLD活力如图4所示.
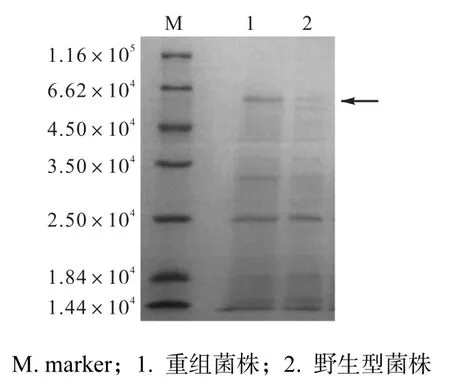
图3 重组菌株分泌表达rPLD电泳分析Fig. 3 SDS-PAGE analysis of extracellular rPLD of the recombinant strain

图4 不同发酵时间的rPLD活力Fig. 4 rPLD activity at different fermentation time
由图 4可知:在 12~60h,随着发酵时间的延长,rPLD活力逐渐增加;当超过 60h后,rPLD活力有所下降.因此,选择重组菌株 WB600/pWB980-pld发酵 60h,以实现对 rPLD 的高效表达分泌,此时酶活力达到 2.53U/mL.已报道的以 Escherichia coli、Pichia pastoris[21]以及Corynebacterium glutamicum[22]作为宿主细胞的 PLD表达水平分别为 1.21U/mL、2.36U/mL以及 1.90U/mL,上述活性主要是水解活性,直接测定转酯活性的报道相对较少,但转酯活性直接体现 PLD催化生产 PS的能力.有研究报道以Pichia pastoris[26]为宿主细胞获得PLD的转酯酶活力可达 2.37U/mL.本研究利用枯草芽胞杆菌作为宿主细胞,其表达链霉菌来源 PLD的转酯活性有一定提高,且其对于 PS的安全生产具有非常重要的意义.因此进一步开发与研究基于枯草芽胞杆菌表达与调控工具,将有助于提高PLD的生产水平.
2.4 pH与温度对重组PLD活性的影响
温度与pH对转酯酶活力的影响如图5所示.由图5可知:rPLD在pH和温度分别为5.5和40℃时其转酯活性最高.与之相近的是 Moon等[27]从土壤中分离得到菌株 Streptomyces sp. p821,其所产 PLD的转酯活性的最适温度为 30℃,最适 pH为 5.0;而Simkhada等[28]对S. olivochromogenes中PLD进行酶学性质研究,发现其转酯活性的最适温度高达75℃,最适pH为8.0.由此可见,不同来源的链霉菌PLD之间的性质存在一定差异,且相同来源的链霉菌 PLD,其转酯活性和水解活性的最适作用条件也并不相同,如 Simkhada等[28]发现来源于 S.olivochromogenes中PLD在55℃、pH为6.0时水解活性最高.因此,对 rPLD的转酯活性条件进行测定,有助于进行其催化 PC和 L-丝氨酸转酯合成 PS的研究.

图5 温度与pH对转酯酶活力的影响Fig. 5 Effects of temperature and pH on transphosphatidyl enzyme activity
2.5 rPLD催化合成PS的工艺优化
底物的物质的量比是可逆反应中使反应平衡向所需产物移动的重要变量[29-30].在PLD催化合成PS的转酯反应过程中,水在作为反应介质的同时还会作为L-丝氨酸的竞争性底物,生成水解产物磷脂酸.因此,可通过过量的 L-丝氨酸使反应平衡向转酯方向转移,以达到提高转酯率和降低水解率的目的,从而提升PS产率.rPLD单水相催化合成PS的条件优化结果如图6所示.
由图 6(a)可知:随着 PC与 L-丝氨酸物质的量比的增加,PS的产率逐渐增加;当物质的量比为 1∶3时,PS的产率达到最高,为 30%;随着底物物质的量比的继续增加,转化率并没有显著提高.因此,选择 PC与 L-丝氨酸底物物质的量比为 1∶3,用于催化反应的进一步优化.
由图 6(b)可知,PS产率与酶的添加量显著相关:当酶量由 1U/mL逐渐增加至 5U/mL时,PS产率随之增加至 35.1%;在酶添加量为 6U/mL时,几乎保持不改变.因此,考虑到反应效率和酶的成本,选择5U/mL为最佳添加量.
在PC与L-丝氨酸物质的量比为1∶3、rPLD为5U/mL、温度为 40℃、pH 为 5.5、0.2mol/L 醋酸-醋酸钠缓冲液 6mL的反应体系中,分析随着时间进程的 PS产量变化.由图 6(c)可知:0~24h,随着时间的增加,PS的产率有所增长,最高可达 42.6%;24h后,PS产率下降.分析其原因可能是由于转酯反应过程中存在着产物被水解及逆向转酯的情况[31].

图6 rPLD单水相催化合成PS的条件优化Fig. 6 Optimization of the transphosphatidyl reaction system
目前,转酯合成 PS的反应体系介质较多,如有机溶剂氯仿[16]、γ-戊内酯[29]、二甲基四氢呋喃[32]、乙醚[33]、正己烷[34]、乙酸乙酯[35]等,在有机相-水相双相催化体系中进行转酯反应后,PS产率基本可达到90%以上,但是由于有机溶剂存在毒性,因此不利于PS的规模制备及其在食品工业中的应用;利用Triton X-100等表面活性剂[36]催化转酯反应,虽然PS的产率能够达到 94.7%,但造成其分离困难.因此,利用单水相进行酶法催化合成PS,尽管产率与使用上述介质相比较低,但该工艺操作简单安全,进一步利用酶的固定化技术[37],提高酶的利用效率,将有利于降低生产成本,实现PS的规模制备.此外,改变催化介质,如加入绿色无毒的新兴溶剂——低共熔溶剂[38]等也可有助于提高产率.
3 结 论
利用枯草芽胞杆菌的表达分泌系统,实现 S.halstedii TCCC21102来源PLD的分泌表达,在摇瓶发酵水平转酯酶活力可达 2.53U/mL;进一步对其PLD的转酯活性酶学性质进行分析,其最适反应温度为 40℃,最适反应 pH为 5.5;经单水相催化反应体系优化,在 40℃、pH 5.5的条件下,Ca2+浓度10mmol/L,大豆 PC与 L-丝氨酸的物质的量比 1∶3,rPLD添加量5U/mL,反应24h,PS产率可以达到42.6%.本研究为 PLD的异源表达及其酶法合成新资源食品 PS提供了技术支撑,为 PS在我国食品及医药工业中的应用提供了基础依据.
