多囊卵巢综合征患者性激素水平和肥胖指标的相关性分析
2020-10-19董斯睿郭广玲龚琴琴邹凡熊玉倩刘晨晨赵淑颖
董斯睿 郭广玲 龚琴琴 邹凡 熊玉倩 刘晨晨 赵淑颖
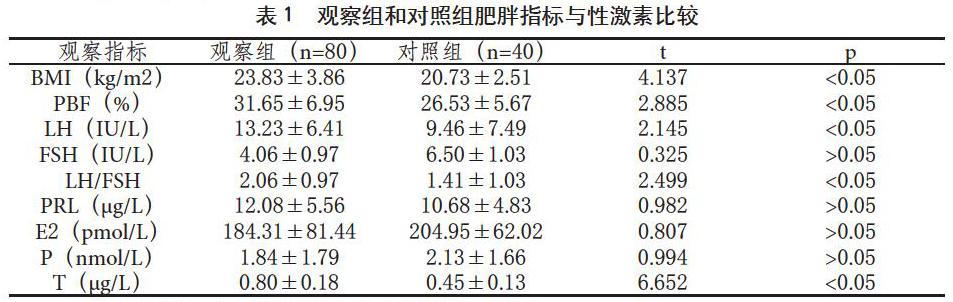


【摘 要】目的:比较不同体质指数(BMI)、体脂率(PBF)的多囊卵巢综合征(PCOS)患者性激素水平的差异,探讨PCOS患者性激素水平与肥胖指标的相关性。方法:选取2018年7月-2019年7月在我院接诊的PCOS患者80例作为观察组,按照BMI将观察组分为正常组46例和超重组34例。选择该时间段在我院体检健康女性40例作为对照组,比较其BMI、PBF、LH、FSH、LH/FSH、睾酮(T)、催乳素(PRL)、孕激素(P)、雌激素(E2)差异,并分析性激素水平与BMI、PBF的相关性。结果:观察组的BMI、PBF、LH、LH/FSH、T明显高于对照组,差异有统计学意义(p<0.05);两组在PRL、P、E2水平上无明显差异(p>0.05)。观察组两亚组组间比较显示,超重组的BMI、PBF、LH、T明显高于正常组,差异有统计学意义(p<0.05),FSH、LH/FSH、PRL、P、E2差异无统计学意义(p>0.05)。PCOS患者的BMI、PBF与LH、T呈正相关(0 【关键词】多囊卵巢综合征;性激素;肥胖;BMI;体脂率 【中图分类号】R711.75【文献标识码】A【文章编号】1005-0019(2020)13--01 多囊卵巢综合征(polycystic ovary syndrome,PCOS)是一种常见的妇科内分泌疾病,病因复杂,好发于青春期及育龄期女性。PCOS总体发病率约为5%~10%,我国汉族19~45岁的育龄女性中发病率约为5.61%[1]。临床特征表现为月经推迟或闭经、雄激素过高、卵巢多囊样改变,常伴有不孕、多毛、痤疮、肥胖、胰岛素抵抗等症状。流行病学研究显示,多囊卵巢综合征患者多伴随代谢综合征,其中肥胖是重要的代谢综合征特征之一[2]。肥胖女性中大约30%患有PCOS,而体质量正常的女性中仅有约5%[3]。肥胖会降低性激素结合球蛋白水平,增加雄激素分泌[4]。这表明肥胖与PCOS的发病密切相关,可能影响性激素水平。本文旨在探究PCOS患者肥胖指标与性激素水平之间的相关性,为 PCOS的治疗提供个体化科学减重方案,以改善PCOS病情。现将结果报道如下。 1 资料与方法 1.1 资料来源 选取2018年7月-2019年7月在湖北省十堰市太和医院确诊的PCOS患者80例为研究组,年龄18~35岁,平均年龄(27.05±4.33)岁。纳入标准:符合2011年中华医学会制定的基于中国人群的PCOS诊断标准[5]:(1)诊断的必要条件为月经稀发、闭经或不规则子宫出血,再符合以下2项中的1项,即可诊断为疑似PCOS:①高雄激素的生化或临床表现;②超声表现为卵巢多囊样改变:一侧或双侧存在≥12个直径为2~9mm的卵泡,和(或)卵巢体积≥10cm;(2)已确定为疑似PCOS后,再排除其他可引起高雄激素的疾病即可诊断为PCOS;2、年龄18~35岁;3、同意参加本次研究。 排除标准:肾上腺或垂体疾病、库欣综合征、甲减患者、高泌乳素血症患者;3个月内服用激素药物者。根据BMI值将观察组80例分为超重组46例和正常组34例,超重组BMI≥25kg/m2,正常组BMI<25kg/m2。选取同期我院体检正常的健康女性40例为对照组,年龄18~35,平均年龄(26.37±3.95)岁。两组入选者一般资料比较,差异均无统计学意义(p>0.05),具有可比性。 1.2 方法与观察指标 1.2.1 人体成分指标检测 采用个体营养检测分析仪,入选者空腹轻便着衣,赤足站立于仪器上,严格按照操作步骤测量受测者BMI和PBF。 1.2.2 性激素指标检测 入选者在月经期第3-5天上午空腹抽取肘静脉血5ml,采用化学发光免疫分析仪检测性激素指标,包括黄体生成素(LH)、卵泡刺激素(FSH)、睾酮(T)、催乳素(PRL)、雌激素(E2)、孕酮(P)水平。 1.3 统计学方法 采用SPSS20.0统计学软件进行数据统计,计量资料以()表示,比较用独立样本t检验,采用直线相关分析Pearson法分析观察指标的相关性,0 2 结果 2.1 观察组和对照组肥胖指标与性激素水平比较 观察组的BMI、PBF、LH、LH/FSH、T明显高于对照组,差异有统计学意义(p<0.05),两组FSH、PRL、P、E2差异无统计学意义。见表1。 2.2 超重组和正常组肥胖指标与性激素水平比较 超重组的BMI、PBF、LH、T明显高于正常组,差异有统计学意义(p<0.05),两組FSH、PRL、P、E2差异无统计学意义。见表2。 2.3 PCOS患者肥胖指标与性激素的相关性 PCOS患者的BMI、PBF与LH、T呈正相关(0 3 讨论 近年来随着生活压力的增加,PCOS患病率也不断上升,严重影响育龄期女性的健康。PCOS的发病机制至今尚未阐明,目前认为多因素共同作用的结果[6]。一项研究显示,PCOS患者体内的脂肪组织功能显著紊乱,脂肪组织可以产生一种脂肪因子的分泌蛋白,在PCOS发生和发展中起重要作用[7]。PCOS患者会出现性激素失衡和代谢紊乱的症状,以雄激素、LH升高、LH/FSH比值增加为特点,肥胖患者症状最为突出[8]。BMI是国际上常用的衡量人体肥胖程度和是否健康的重要标准。近年来世界卫生组织推荐将体脂率(PBF)作为判定肥胖的新标准[9]。PBF能准确反映人体内的脂肪含量和比例,其结果较BMI更为精确。目前多采用的是利用生物电阻抗原理测定的PBF,这种方法无创且便捷,患者易于接受[10]。本研究中PCOS患者与正常人群相比,BMI、PBF升高,有明显肥胖倾向,性激素检测发现LH、LH/FSH、T明显升高。PCOS患者性激素失衡体现在下丘脑-垂体-卵巢轴功能紊乱[11]。下丘脑高频释放GnRH,而高频率的GnRH促进LH表达,同时抑制FSH表达,导致LH和FSH的合成、分泌不协调,LH水平增高,FSH水平下降,LH/FSH比值异常增高。另外,LH高表达水平刺激卵巢产生过量的雄激素,易引起高雄激素血症。超重组与正常组相比,LH和T显著增高,说明肥胖型患者性激素紊乱更为严重。对PCOS患者肥胖指标和性激素进行相关分析发现,BMI、PBF与PCOS患者高LH和高T呈正相关。由此可见,肥胖对PCOS患者性激素紊乱有重要作用。PCOS发病与肥胖密切相关,这为预防及治疗PCOS提供了新思路。针对肥胖型PCOS治疗策略可以科学减重为主,药物调节内分泌为辅。采用合理的营养干预、科学减重方案可以有效改善患者病情,提高临床疗效。有研究表明,PCOS患者减轻5%~10%的体重即可有助于改善内分泌系统,纠正激素水平失调以及降低胰岛素水平,还有助于恢复排卵,提高怀孕的可能性[12]。控制体重、科学减重是预防PCOS病情进展和治疗PCOS的重要环节,PCOS患者应该合理饮食,尽可能选择低能量、低脂肪、高蛋白及富含膳食纤维的食物。每周坚持3-5次,每次30min-1h的有氧运动,通过增加运动量科学减脂,可以有效改善PCOS患者内分泌紊乱情况,恢复月经周期及排卵,提高受孕率。 参考文献 Li R, Zhang Q, Yang D, et al. Prevalence of polycystic ovary syndrome in women in China: a large community -based study[J].Hum Reprod, 2013, 28(9): 2562-2569. Paulson M, Sahlin L, Hirschberg AL. Progesterone receptors and proliferation of the endometrium in obese women with polycystic ovary syndrome-A lifestyle intervention study[J].Journal of Clinical Endocrinology & Metabolism, 2017, 102(4): 1244-1253. Barr S, Hart K, Reeves S, et al. Habitual dietary intake, eating pattern and physical activity of women with polycystic ovary syndrome[J]. European Journal of Clinical Nutrition, 2011, 65(10): 1126-1132. 左莉, 傅亚均. 多囊卵巢综合征病因及治疗进展[J]. 重庆医学, 2018, 47(9): 1247-1250. 崔琳琳, 陈子江. 多囊卵巢综合征诊断标准和诊疗指南介绍[J]. 国际生殖健康/计划生育杂志, 2011, 30(5): 405-408. 赵甲维, 李晓宁, 黄炎清, 等. 多囊卵巢综合征病因学研究进展[J]. 国际生殖健康/计划生育杂志, 2018, 37(5): 414-416. 陆新虹, 罗佐杰. 多囊卵巢综合征与新型脂肪因子关系的研究进展[J]. 中华糖尿病杂志, 2015, 7(4): 269-272. 苑晓微, 张燕萍, 邓继红. 非肥胖型多囊卵巢综合征临床特征分析[J]. 重慶医学, 2014, 43(26): 3525-3527. 董冰莹, 那芷菁, 焦娇. 体质量指数正常的多囊卵巢综合征患者肥胖指标与糖脂代谢的相关性[J]. 中国医科大学学报, 2019, 48(6): 485-488. 栾培培, 肖苏妹, 谷朝臣, 等. 生物电阻抗法测量体脂成分应用分析研究[J]. 中国实用内科杂志, 2017, 37(1): 51-53. Moore A M, Campbell R E. Polycystic ovary syndrome: Understanding the role of the brain[J]. Frontiers in Neuroendocrinology, 2017, 6(46): 1-14. Wu XK, Stener-Victorin E, Kuang H-Y, et al. Effect of Acupuncture and Clomiphene in Chinese Women With Polycystic Ovary Syndrome[J]. Jama, 2017, 317 (24): 2502-2514.
