中美249例原发性食管小细胞癌的临床病理特征对比、治疗方式及预后分析
2020-10-19焦笑笑彭孝倩张连峰
周 琳,焦笑笑,刘 璐,彭孝倩,张连峰
郑州大学第一附属医院消化内科 郑州 450052
小细胞癌恶性程度高,预后差,最常见于肺部,仅2.5%~4.1%发生在肺外器官(其中以消化道多见)[1]。原发性食管小细胞癌(primary esophageal small cell carcinoma,PESC)是最常见的肺外小细胞癌,约占消化道小细胞癌的53.3%[2]。作为罕见的食管恶性肿瘤,PESC占同期食管癌的0.4%~2.8%,占全身神经内分泌肿瘤的1%[3]。由于其发病率低,自Mckeown[4]于1952年首次报道后,目前仍缺乏大样本多中心的研究。本研究通过回顾性分析郑州大学第一附属医院收治的82例及美国国立癌症研究所“监测、流行病学和结果数据库”(SEER)收录的167例PESC的临床资料,探讨不同人群PESC的临床差异、诊治及预后,以加深对PESC的认识。
1 对象与方法
1.1研究对象收集2010年1月至2018年6月郑州大学第一附属医院收治的经组织病理学检查确诊的82例及2008~2016年美国SEER收录的167例PESC患者的临床资料。排除肺等其他部位来源,共249例PESC患者纳入分析,按患者临床资料来源分为中国患者组及美国患者组。
1.2分期标准根据PESC的生物学行为特征,目前国际上存在2种分期方法:①依据2009年美国癌症联合会(AJCC)制订的恶性肿瘤TNM分期。②参考小细胞肺癌美国退伍军人医院的肺癌研究组(Veterans Administration Lung Cancer Study Group,VALSG)标准分期[5]:局限期指肿瘤局限于食管及食管周围组织,无淋巴结转移;广泛期指肿瘤超过局限期范围,出现肝、肺、骨等远处转移或淋巴结转移。
1.3治疗方法SEER仅记录原发部位肿瘤是否行手术治疗。中国患者组治疗手段包括手术治疗、化学治疗、放射治疗、生物治疗、分子靶向治疗;治疗方式包括手术治疗、联合治疗、系统治疗及保守治疗。系统治疗包括化学治疗、放射治疗、生物治疗、分子靶向治疗及其中2种或多种联合的治疗方式。联合治疗指手术治疗联合系统治疗。
1.4随访对中国患者组患者采用电话随访和影像学检查随访,随访时间自确诊之日开始至2019年6月5日,随访时间为1~74个月,随访中位时间为13个月;82例患者中有73例获长期随访,随访率为89.0%。美国患者组随访时间自首次治疗之日开始至死亡或失访,随访时间为1~93个月,随访中位时间为9个月,随访率为100%。
1.5统计学处理采用SPSS 19.0进行数据分析。应用χ2检验和Fisher确切概率法比较两组患者临床病理特征的差异。应用Kaplan-Meier法绘制生存曲线,预后影响因素的单因素分析应用Log-rank检验,差异有统计学意义的变量纳入Cox回归模型分析。检验水准α=0.05。
2 结果
2.1两组患者临床病理特征比较结果见表1。中国患者组82例患者中,单一型小细胞癌75(91.5%)例,其余7例为混合型小细胞癌(其中2例为小细胞癌与少部分腺癌混合,5例为与鳞癌混合)。美国患者组中有143(85.6%)例单一型小细胞癌,24(14.4%)例混合型小细胞癌,其中包括5例与腺癌混合,6例与鳞癌混合,13例为小细胞癌与少部分鳞癌和(或)腺癌混合。
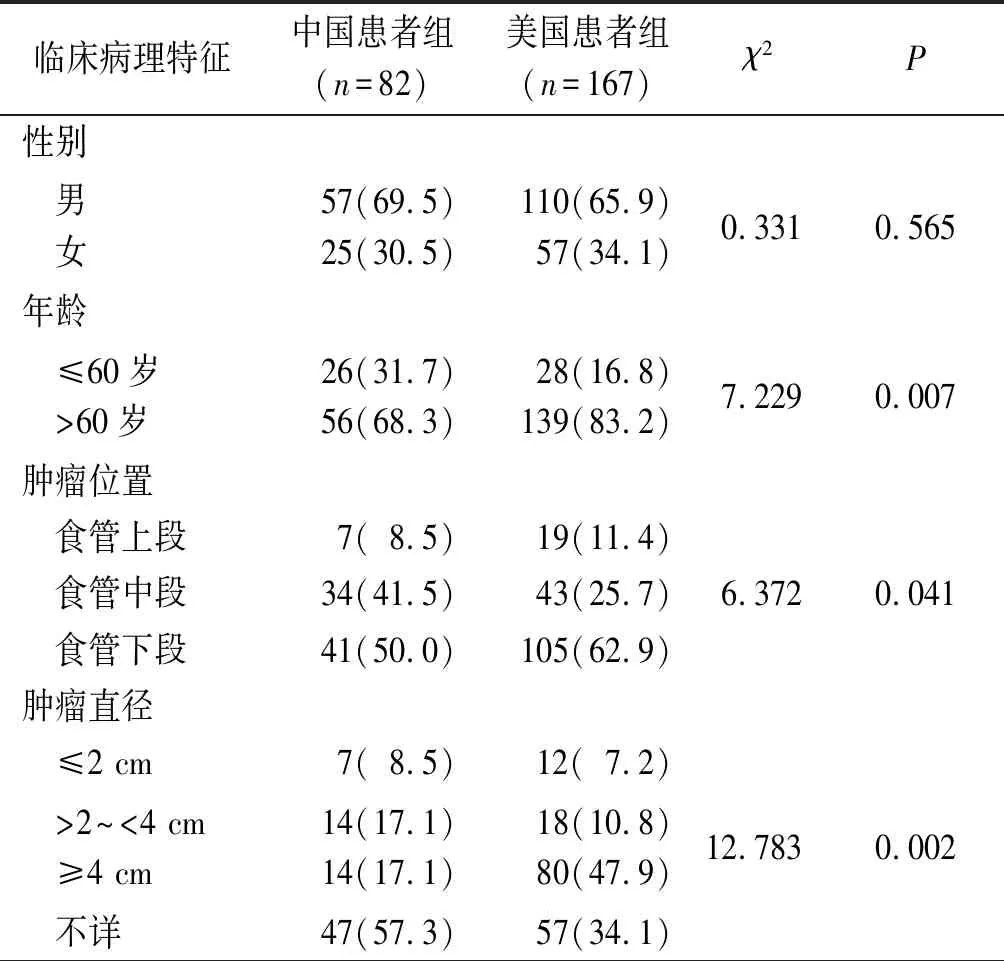
表1 两组患者临床病理特征比较 例(%)
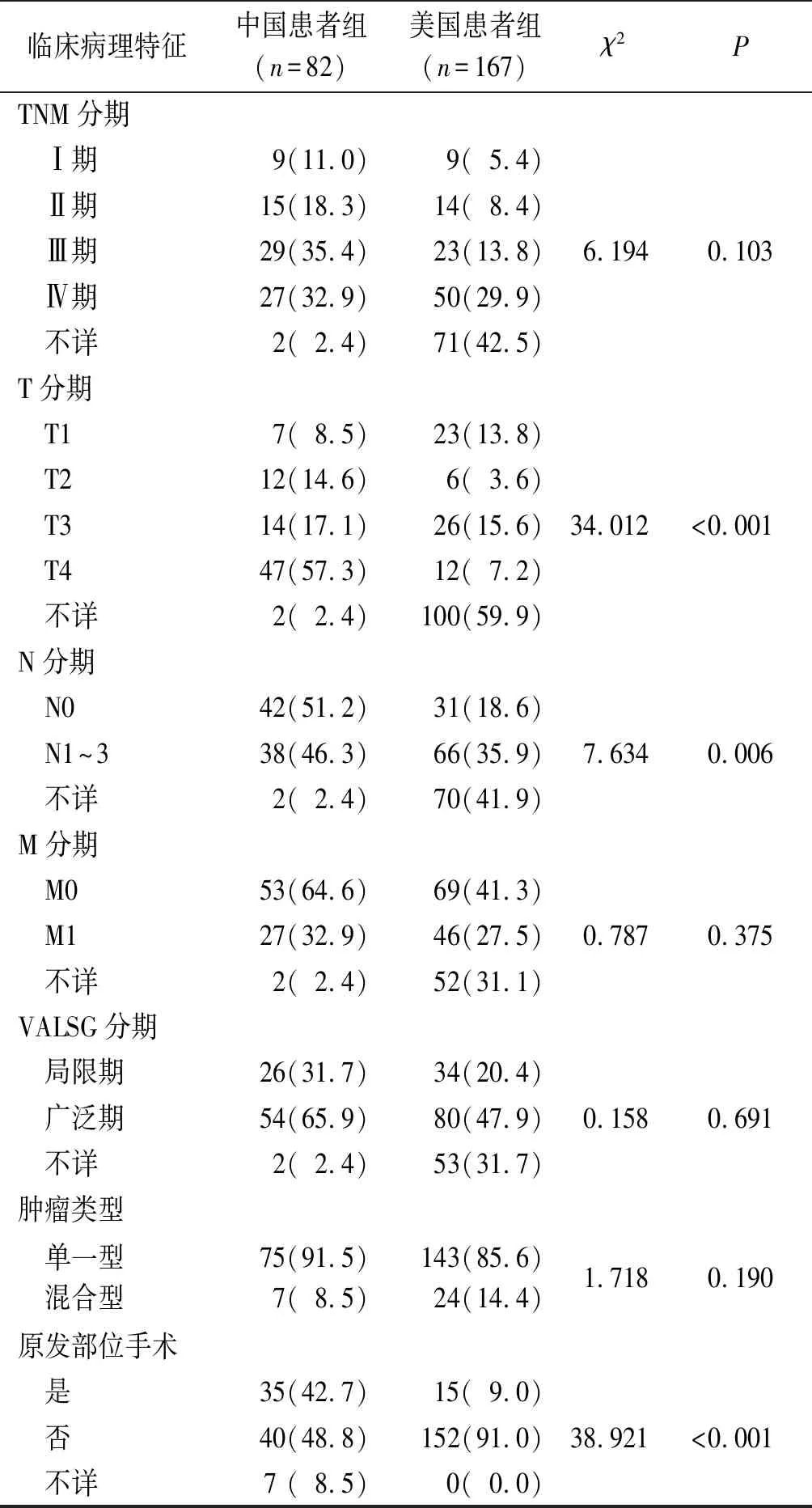
续表1
2.2两组患者肿瘤转移情况根据确诊时影像学检查及病理检查结果记录转移部位。82例中国组患者中,有80例记录了是否发生转移及转移的部位,淋巴结为最常见的转移部位(47.5%,38/80),其次为肝脏(30.0%,24/80)、肺(10.0%,8/80)。167例美国组患者中,97例记录了淋巴结转移情况,其中68.0%(66/97)的美国组患者确诊时已发生淋巴结转移;此外,记录了其他部位转移情况的115例患者中,肝(35.7%,41/115)、肺(12.2%,14/115)、骨(9.7%,11/115)为常见的远处转移部位,仅1.7%(2/115)发生脑转移。
2.3两组患者的治疗方式比较结果中国患者组75例记录治疗方式的患者中,35(46.7%)例行原发部位手术治疗,包括29例根治性切除和6例姑息性切除。其中16例患者单纯行手术治疗;19例患者术后行化学治疗和(或)放射治疗,以术后化疗居多(84.2%,16/19),化疗方案以依托泊苷+顺铂为主(68.6%,11/16),其余包括紫杉醇+奥沙利铂、奥沙利铂+卡培他滨等,有3例为术后化疗联合放疗。27(36.0%)例患者行系统治疗,其中,18(66.7%,18/27)例患者行单纯化学治疗,化疗方案以依托泊苷+顺铂为主(61.1%,11/18);6(22.2%,6/27)例患者行化疗联合放疗;其余患者分别行单纯放射治疗(1例)、生物治疗(1例)和分子靶向治疗(1例)。13(17.3%)例患者行对症支持治疗。167例美国患者中,仅15(9.0%)例行原发部位手术治疗,其余治疗方式未记录在数据库中。
中国患者组24例局限期PESC患者中,18(75.0%)例行原发部位手术治疗(包括10例单纯手术治疗,8例联合治疗);其余行系统治疗(4例)和对症支持治疗(2例)。51例广泛期PESC患者中,17(33.3%)例行原发部位手术治疗(其中6例行单纯手术治疗,11例行联合治疗);23(45.1%)例行系统治疗;11例行对症支持治疗。
2.4两组患者的随访及预后见图1、表2。中国患者组73例获长期随访的患者中,中位生存时间为15.0个月,1、3、5 a生存率分别为61.2%、21.5%、12.0%;美国患者组167例美国患者的中位生存时间为11.0个月,1、3、5 a生存率分别为46.2%、13.5%、9.3%(χ2=5.517,P=0.019)。中国患者组预后的影响因素为肿瘤直径、TNM分期、VALSG分期、原发部位是否行手术治疗和治疗方式的选择;美国患者组预后的影响因素为TNM分期、原发部位是否行手术治疗。
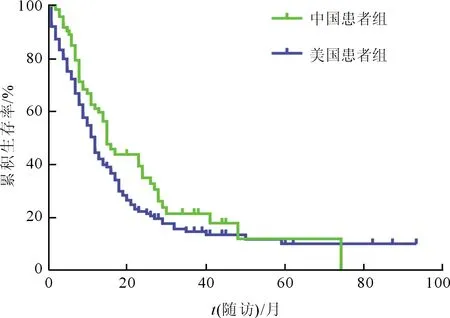
图1 中美PESC癌患者生存曲线的比较
中国患者组局限期患者行手术治疗与未行手术治疗的中位生存时间分别为23.0和10.0个月,行手术治疗患者1、3、5 a生存率均高于未行手术治疗患者(94.7%、34.3%、17.1%vs50.0%、0%、0%)(χ2=4.727,P=0.030);广泛期患者行放疗联合化疗的预后(中位生存时间28.0个月;1、3、5 a生存率 为83.3%、41.7%、41.7%)优于单纯行化学治疗(11.0个月;45.9%、13.8%、0%)及非放化疗(8.0个月;50.0%、0%、0%)(χ2=7.319,P=0.026)。

表2 240例PESC患者的单因素预后分析
3 讨论
PESC发病率低,国内外关于其发病率的报道较少,为0.8%~2.4%[6]。然而,国内有研究[7]显示,近20年PESC男性及女性发病率均呈明显上升趋势。由于其高度侵袭性、早期转移及治疗后易复发的特点,PESC被认为较其他原发部位的小细胞癌预后更差,3 a生存率仅为7%[8-9]。
目前对于PESC的组织来源仍存在争议。有学者[10]认为,PESC来源于食管黏膜内基底层或黏膜下腺体的胺前体摄取和脱羧细胞,属于神经外胚叶源性肿瘤。本研究中,中国与美国患者PESC均多位于食管下段,推测可能与该部位食管黏膜内含有较多神经内分泌细胞有关。另外,Ugra等[11]学者发现了伴随鳞癌或腺癌的混合型PESC的存在,且其所占比例达10%或37%,由此提出PESC可能来源于食管黏膜的多潜能干细胞,在不同致癌因素作用下向上皮和神经内分泌肿瘤双向分化[7]。本研究中混合型PESC的存在,也支持了这一观点。
本研究中,中国与美国PESC均有明显的男性发病优势,两者均以老年患者多见,可能与其生长缓慢,早期缺乏特异性临床表现相关。同时美国患者平均发病年龄高于中国患者。食管癌作为中国发病率较高的恶性肿瘤之一,约90%为鳞状细胞癌[12];而美国食管癌发病率较低,且以食管腺癌为主要的病理类型[13]。既往也有研究[5]表明中国PESC临床特点与鳞癌相似,而美国PESC则更接近食管腺癌。可见种族及环境等因素可能会导致不同地区肿瘤的临床特点存在差异。与鳞癌在食管中上段发生率高于腺癌相似,中国PESC原发于食管中上段的比率明显高于美国。此外,美国PESC患者早期淋巴结转移率高于中国患者,可能与食管腺癌较食管鳞癌能够更加明显的促进新生淋巴管的生存有关[14]。由于PESC的高度恶性及侵袭性,早期易发生淋巴结转移及远处转移,进展迅速且预后不良。本研究中,33.8%~68.0%的PESC患者就诊时已发生转移,与王军等[15]研究结果相符,远处转移尤其以肝、肺、骨等部位多见。
由于PESC较为罕见,缺乏与治疗及预后相关的大样本研究,目前对于PESC的治疗尚无指南可循。因其与小细胞肺癌在组织生物学上的相似性,PESC的治疗多参照小细胞肺癌的治疗方案,采用手术、全身放化疗相结合的多学科治疗模式[16]。手术治疗是目前唯一可能治愈PESC的方法。本研究结果显示,对于中美PESC患者,采用以手术为主的治疗方式,包括单纯手术治疗及手术联合放化疗均可有效改善患者预后。局限期PESC行手术治疗的患者1、3、5 a生存率均高于非手术患者,说明手术治疗可延长局限期PESC患者的总生存期。对于肿瘤分化较差、伴远处转移且无法切除病灶的PESC患者,化疗仍是首选方法,但是标准方案及化疗时限尚无定论[17-18],目前临床应用最广泛的为EP方案(依托泊苷+顺铂/卡铂)。然而本研究结果显示,采用EP方案化疗未能使PESC患者获得明显的生存优势。Chen等[9]研究结果表明,PESC应视为全身性疾病,化疗联合放疗可获得良好的治疗效果。本研究中,广泛期PESC患者采用化疗联合放疗的治疗方式可使患者获得长期生存。由于手术切除对于患者基础条件要求较高,尤其是对于体质较差、合并多种疾病的患者,放化疗可考虑作为重要选择[14]。
本研究中,中国PESC患者中位生存时间长于美国患者且1、3、5 a生存率均高于美国患者,其原因可能与美国PESC患者中肿瘤Ⅳ期所占比例较高且行手术治疗人数较少有关。混合型PESC为食管神经内分泌肿瘤的少见类型,有研究[19]报道其预后优于单一型PESC,与本研究结果存在差异。因本研究病例数较少,故需扩大样本后进一步验证。值得注意的是,尽管单因素分析结果显示肿瘤直径大小、TNM分期、VALSG分期、原发部位是否行手术治疗、治疗方式的选择等与PESC患者的预后有关,但是多因素分析结果并未表明其为影响PESC患者预后的独立危险因素。
本研究尚存在一定的局限性,首先,作为中美PESC的对比分析,中国患者的选取局限于单中心,可能存在一定的偏倚。其次,治疗方式的选择为影响预后的重要因素,而美国PESC患者化疗、放疗等治疗手段的数据缺失,无法准确对不同地区治疗方式的选择对预后的影响进行评估。因此,对于有关结论需扩大样本、完善数据后进一步深入研究。
综上所述,中美PESC患者在临床病理特征、诊治及预后等方面存在差异。作为一种全身性的疾病,其最优治疗模式尚未确立。基于本研究,对于局限期PESC患者,以手术切除为主的综合治疗可有效改善患者预后;对于广泛期PESC患者而言,以化疗联合放疗为主的综合治疗可延长患者的生存时间。