食管鳞状细胞癌组织中MRDI的表达及下调MRDI表达对食管癌细胞侵袭能力的影响
2020-10-19刘宗文刘耀河袁金金
秦 宁,刘宗文,张 艳,杨 瑜,刘耀河,侯 歌,宋 锐,袁金金
1)郑州大学第二附属医院放射治疗科 郑州 450014 2)郑州大学基础医学院药理学教研室 郑州 450001
食管癌是指原发于食管上皮的恶性肿瘤。据2018年世界卫生组织发布的《世界癌症报告》统计,全球食管癌新发病例数约为57.2万,在36种癌症中占3.2%,排第7位;死亡例数约50.8万,在36种癌症中占5.3%,排第6位[1]。在我国,食管癌也是最常见的消化道恶性肿瘤之一,其发病率及死亡率分别占我国恶性肿瘤的第5位和第4位[2]。食管癌在消化系统恶性肿瘤中具有发病率高,诊断率低,且预后不佳的特点。食管癌按组织学分类可分为鳞状细胞癌(简称鳞癌)和腺癌,亚洲主要的组织学类型是食管鳞癌[3],在我国,鳞癌的占比达90%。
近年研究[4-5]表明Ras同源基因家族成员A(Ras homolog gene family member A,RhoA)是Ras超家族中的一种小G蛋白分子,具有GTP酶活性;RhoA对肿瘤的侵袭和转移有促进作用。随着对Rho家族研究的逐步深入,一种名为“依赖RhoA的侵袭媒介”(mediator of RhoA-dependent invasion,MRDI)的基因被发现,它具有促进细胞侵袭和细胞运动的特征,有代谢酶和细胞侵袭媒介两种作用。有研究[6-7]显示,MRDI与转移性黑色素瘤、卵巢癌、乳腺癌、前列腺癌等肿瘤的转移侵袭性相关。本实验采用免疫组化SP法检测食管鳞癌组织及癌旁组织中MRDI蛋白的表达,探讨MRDI蛋白的表达与食管癌患者临床病理参数及术后生存的关系,以及下调MRDI蛋白表达后食管鳞癌细胞株侵袭能力的变化。
1 对象与方法
1.1研究对象郑州大学第二附属医院2014年4月至2015年10月收治的45例食管鳞癌患者的手术切除标本(含癌和癌旁组织),均经病理确诊。45例中男31例,女14例,年龄45~78岁;低分化15例,高中分化30例;Ⅰ、Ⅱ、Ⅲ、Ⅳ期分别有5、15、21、4例; 有淋巴结转移25例。入组条件:术前均未接受过放、化疗以及其他特殊治疗。EC109和EC9706细胞由郑州大学第一附属医院病理科捐赠。
1.2免疫组化染色检测MRDI蛋白的表达将收集到的食管鳞癌及癌旁组织病理切片经烤片、脱蜡、水化、抗原修复、阻断内源性过氧化物酶、山羊血清工作液封闭等步骤后,加MRDI抗体(Gebtex公司,按1∶200稀释),4 ℃孵育过夜,加入适量生物素标记的山羊抗小鼠IgG和辣根过氧化物酶标记的链霉卵白素工作液,经DAB显色、苏木精复染、脱水、透明等步骤,中性树脂封片进行观察。400倍显微镜下选取5个视野,每个视野计数100个细胞。用PBS代替一抗为阴性对照。细胞中出现细小的棕黄色颗粒为阳性。染色结果评分标准[8]:阳性细胞百分比<5%计0分,5%~计1分,26%~50%计2分,>50%计3分;阳性细胞染色淡黄色计1分,深黄色计2分,棕褐色计3分。两项得分乘积>3分为高表达,≤3分为低表达。由病理科的两名专业人员使用双盲法阅片并评分。
1.3入组患者随访对45例食管鳞癌患者进行随访(电话随访及查阅本院相关就诊记录),了解患者确诊食管癌后的治疗、生存及肿瘤侵袭转移情况,进行Kaplan-Meier生存分析。
1.4下调MRDI的表达对食管鳞癌细胞侵袭能力的影响
1.4.1 细胞转染 实验前EC9706和EC109均转染含绿色荧光蛋白的siFAM NCtrl,荧光显微镜下显示两种细胞株生长状态良好,且转染效率均在80%以上。将处于对数生长期的EC109和EC9706细胞按照3.5×105个/孔接种于6孔板中培养过夜,分为5组:空白对照组、siNCtrl组(阴性对照组)、MRDI-siRNA#1组、MRDI-siRNA#2组、MRDI-siRNA#3组。待细胞生长到50%~60%融合时,用上述siRNA和锐博转染试剂转染细胞,并用无双抗培养基培养过夜。
1.4.2 qRT-PCR法检测细胞中MRDI mRNA的表达 取分组处理后且细胞融合度达80%~90%的EC109和EC9706细胞,加入Trizol提取总RNA,反转录为cDNA。以cDNA为模板,上机进行扩增。引物序列(表1)由生工生物工程(上海)股份有限公司设计及合成。50 μL PCR体系:1.5 μL cDNA,5 μL 10×PCR buffer,3 μL 20 mmol/L MgCl2,1 μL 10 mmol/L dNTPs,1 μmol/L的上下游引物 各1 μL,0.8 μL Taq酶,36.7 μL DEPC水。反应条件:50 ℃ 2 min;95 ℃ 10 min;95 ℃ 15 s,35~40个循环;58 ℃ 1 min。用2-ΔΔCt法计算MRDI mRNA的相对表达量。

表1 MRDI及β-actin引物
1.4.3 Western blot法检测细胞中MRDI蛋白的表达 取分组处理后且细胞融合度达80%~90%的EC109和EC9706细胞,加入预冷的细胞裂解液冰上裂解30 min,在EP管中超声裂解2 min,离心后采用BCA蛋白定量试剂盒检测蛋白浓度,加入上样缓冲液后煮沸备用。根据凝胶制备试剂盒说明书制备分离胶与浓缩胶,上样后进行电泳,恒压80 V 120 min后转至恒压120 V,溴酚蓝临近胶底部停止电泳。后续经转膜、封闭、4 ℃一抗(MRDI按1∶1 000稀释)孵育、二抗孵育,用ECL发光剂进行显影。用Image J软件分析,以目的蛋白条带和内参β-tubulin条带灰度值的比值作为目的蛋白的相对表达量。
1.4.4 Transwell法检测细胞的侵袭能力 取处于对数生长期的EC109和EC9706细胞,分别转染siNCtrl和转染效果最佳的MRDI-siRNA#2。用不含血清的RPMI 1640培养基稀释Matrigel胶,上室铺胶后将细胞接种至上室中,在对应的下室加上含体积分数5%胎牛血清的RPMI 1640培养基。培养过夜,用棉签抹去上室中未穿膜的细胞,甲醇固定,结晶紫染色之后,倒置显微镜(×400)下观察并拍照。
1.5统计学处理采用SPSS 21.0处理数据。应用配对χ2检验比较食管鳞癌及癌旁组织中MRDI蛋白表达的差异,应用χ2检验或者校正χ2检验分析MRDI蛋白表达与食管鳞癌患者临床病理参数的关系,生存曲线由Kaplan-Meier法绘制。检验水准α=0.05。
2 结果
2.1食管鳞癌及癌旁组织中MRDI蛋白的表达情况与癌旁组织[33.3%(15/45)]相比,食管鳞癌组织中MRDI蛋白的高表达率[66.7%(30/45)]增加(P<0.05),见表2,图1A、1B。MRDI蛋白主要表达于癌细胞的胞质,细胞核亦有少量表达(图1B);癌旁组织中MRDI蛋白主要定位于细胞核(图1C);部分癌旁组织中MRDI蛋白的分布具有积聚现象,主要富集于细胞质膜的前缘(图1D)。

表2 食管鳞癌及癌旁正常组织中MRDI蛋白的表达 例
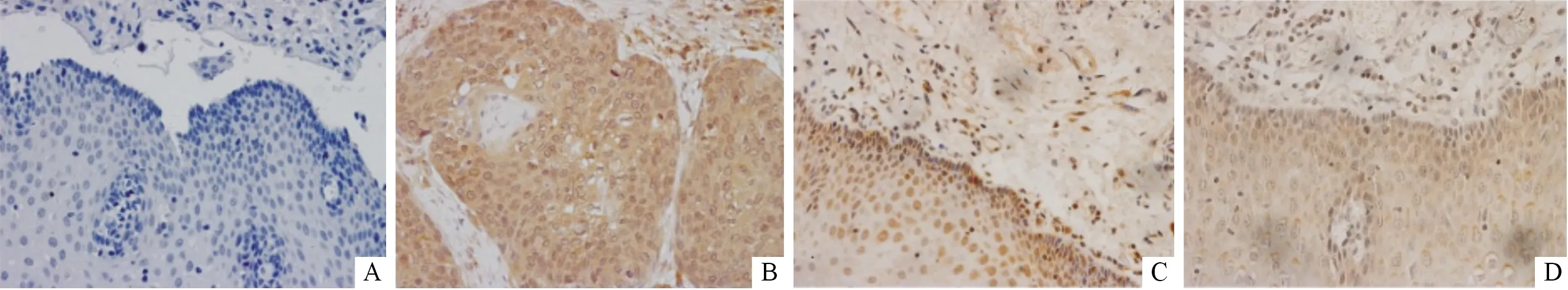
A、C、D:癌旁组织;B:癌组织
2.2食管鳞癌组织中MRDI蛋白的表达与食管鳞癌患者临床病理参数的关系MRDI蛋白在低分化、病理分期T3+T4期及脉管癌栓阳性的食管鳞癌患者中的表达升高(表3)。
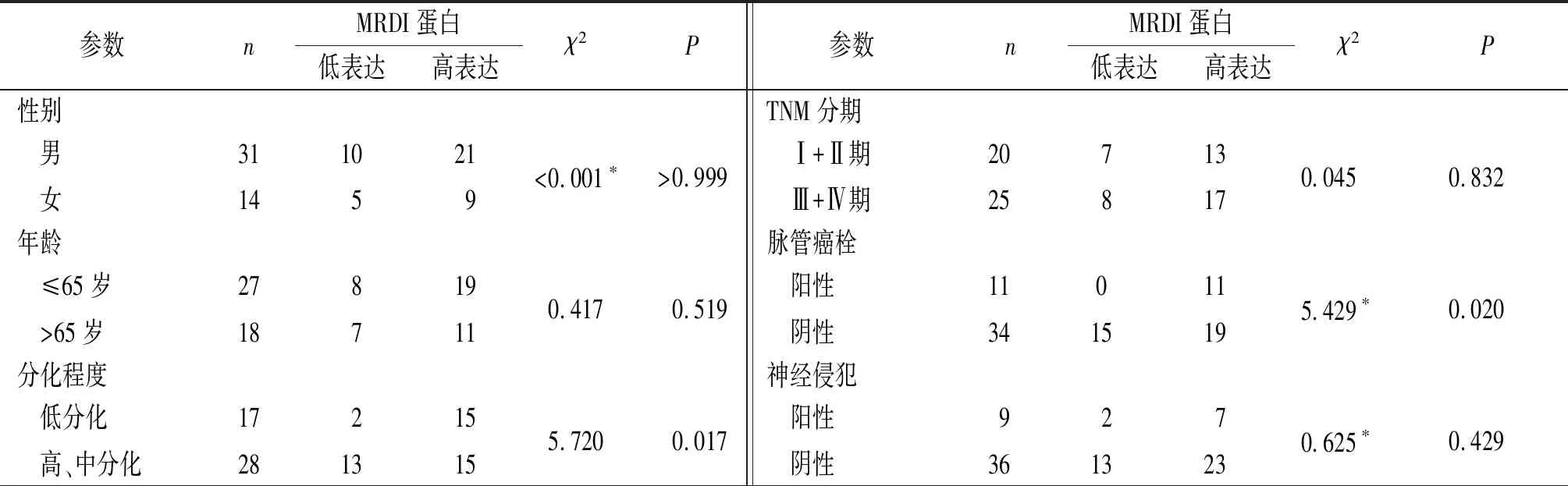
表3 食管鳞癌组织中MRDI蛋白的表达与患者临床病理参数的关系 例

续表3
2.3MRDI蛋白表达与食管鳞癌患者术后生存的关系生存曲线(图2)表明,与MRDI蛋白低表达者相比,MRDI蛋白高表达者预后差(χ2=5.058,P=0.025)。
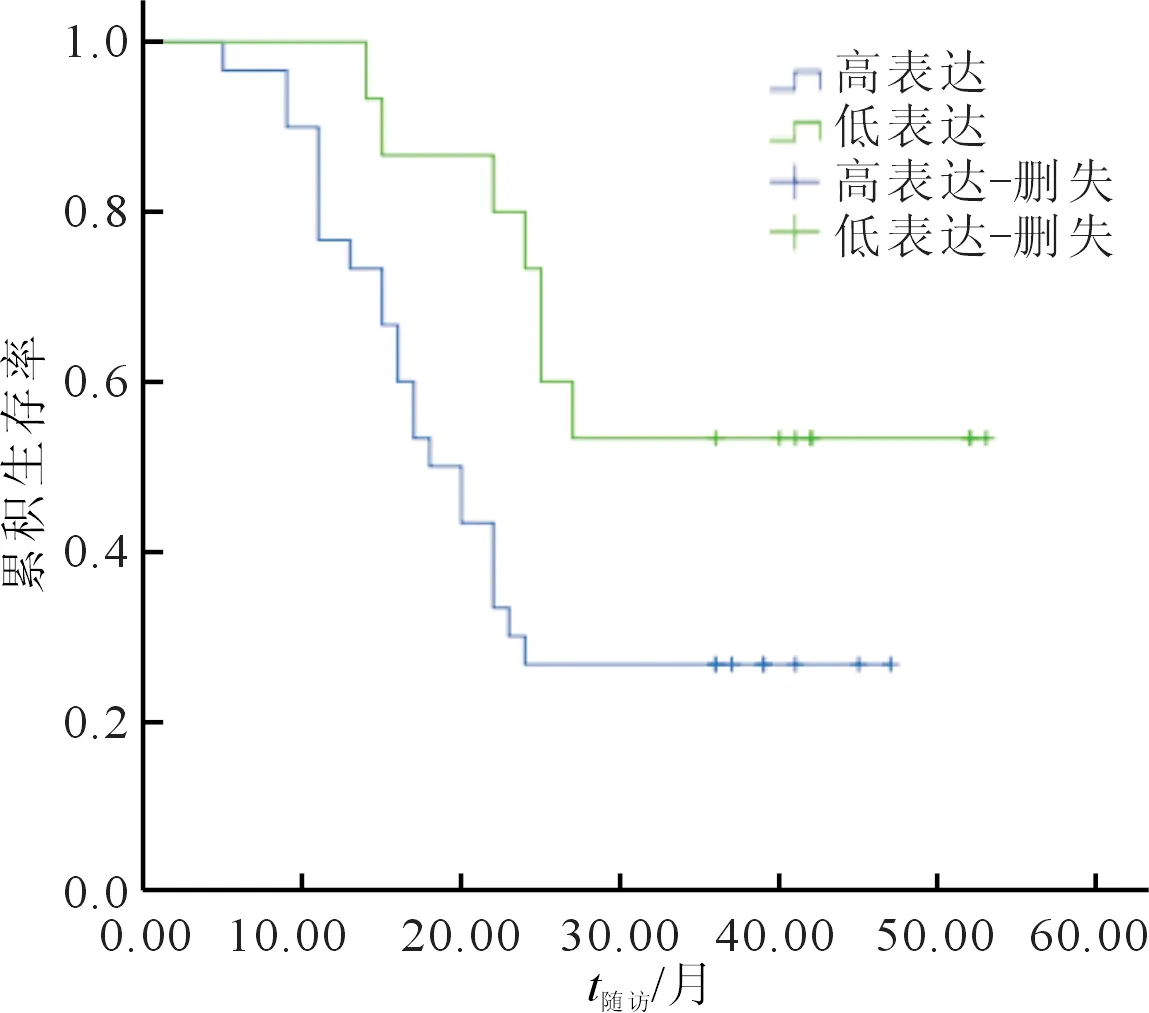
图2 MRDI蛋白表达与食管鳞癌患者术后生存的关系
2.4下调MRDI后EC9706和EC109细胞侵袭能力的变化qRT-PCR和Western blot结果显示,MRDI-siRNA#2转染效果最佳(图3、4)。与siNCtrl组相比,转染MRDI-siRNA#2后,EC109及EC9706侵袭细胞数均减少(图5)。
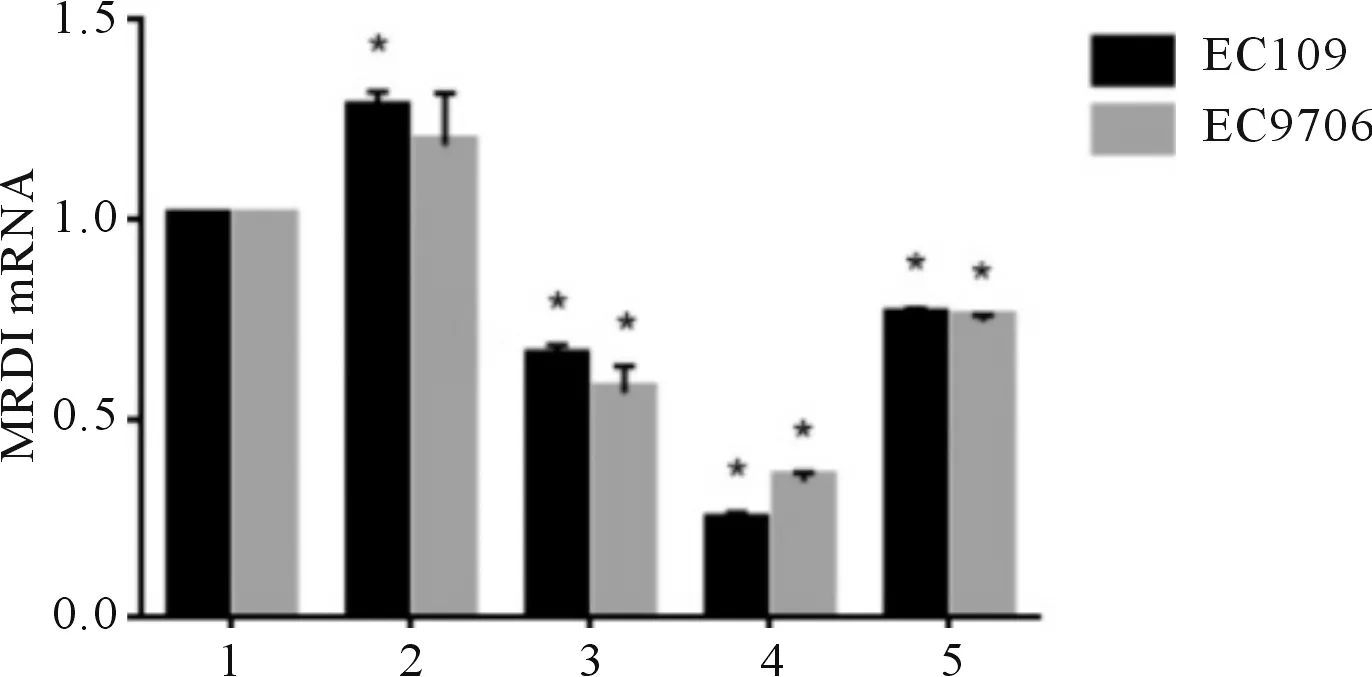
1~5:分别为空白对照组、siNCtrl组、MRDI-siRNA#1组、MRDI-siRNA#2组、MRDI-siRNA#3组
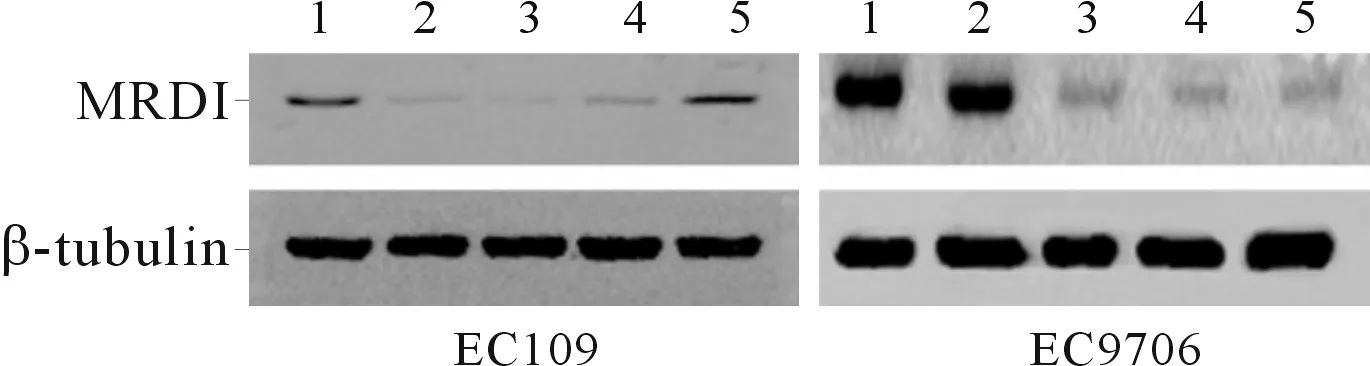
EC109:1~5分别为空白对照组、MRDI-siRNA#1组、MRDI-siRNA#2组、MRDI-siRNA#3组、siNCtrl组;EC9706:1~5分别为空白对照组、siNCtrl组、MRDI-siRNA#1组、MRDI-siRNA#2组、MRDI-siRNA#3组
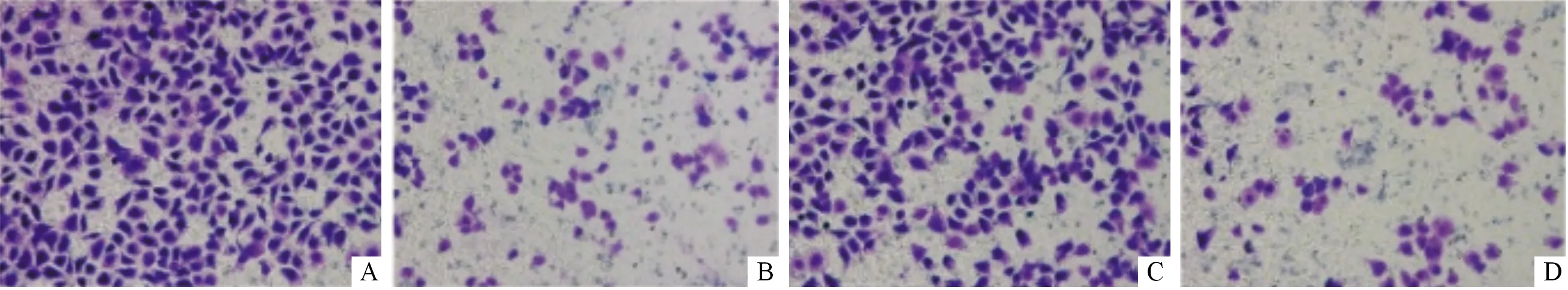
A、B:转染siNCtrl、MRDI-siRNA#2的EC109细胞;C、D:转染siNCtrl、MRDI-siRNA#2的EC9706细胞
3 讨论
Meta分析[9]显示79 777名食管癌患者的3 a生存率为46.0%,不同分期、组织学类型和肿瘤部位的食管癌患者之间存在差异。食管鳞癌具有晚期诊断、死亡率高的特点,尽管过去几十年在外科和非手术治疗方面取得了进展,但由于缺乏合适的早期诊断和有效治疗的生物标志物,食管鳞癌的预后仍然很差。
RhoA是哺乳动物Rho GTP酶典型成员之一,其在活性状态与非活性状态之间相互转换,发挥一种类似“分子开关”的作用[10-11]。其活性形式与下游效应蛋白相互反应可激活细胞分裂、存活、迁移和黏附等多种生物进程[12],基于这种作用,RhoA的异常活化(如过表达、异常突变)可激发肿瘤细胞无限增殖、浸润和转移机能。而MRDI基因作为一个依赖RhoA的基因,具有代谢酶和细胞侵袭媒介的双重作用。
本研究结果表明,MRDI在食管鳞癌组织中高表达,且在低分化、肿瘤浸润程度深、脉管癌栓阳性的食管鳞癌患者中表达高;MRDI高表达者预后差。另外,免疫组化结果显示,食管鳞癌癌旁组织中MRDI主要定位在胞核,少量位于胞质,而在食管鳞癌组织中主要在胞质,与Kabuyama等[13]在黑色素瘤中的研究结果一致。即在疾病晚期,MRDI蛋白在胞质中表达增加,胞核中表达减少;同时,作者还发现在部分癌旁组织中MRDI蛋白的分布具有积聚现象,主要富集于细胞质膜的前缘,考虑可能是非癌组织向癌组织转化的中间态,提示MRDI蛋白表达的变化较细胞形态学改变早。因此MRDI基因可能作为一个癌前基因来预测食管鳞癌的转移与进展,且MRDI蛋白的膜定位提示其可能参与细胞运动,对细胞侵袭、迁移有潜在的控制作用。作者利用siRNA下调食管癌EC9706和EC109细胞中MRDI的表达后,发现细胞的侵袭能力受抑,提示MRDI可能参与启动细胞运动相关基因,促进肿瘤细胞的侵袭、转移,然而具体机制还需要进一步的实验探究。
可以展望,MRDI作为一个新的基因靶点,可能为抗肿瘤新药的研发和食管癌的治疗提供新的思路。