原代培养大鼠心肌细胞低氧损伤时琥珀酸G蛋白偶联受体通路的变化
2020-10-19张方圆原美茹任建平刘永学
张方圆,齐 越,原美茹,任建平,刘永学
(军事医学研究院辐射医学研究所,北京 100850)
琥珀酸G 蛋白偶联受体91(G protein-coupled receptor 91,GPR91)是G 蛋白偶联受体(G proteincoupled receptor,GPCR)成员之一,但其内源性配基有别于传统GPCR[1],为三羧酸循环的一个中间产物-琥珀酸(盐)。该受体分布于多种器官组织,可在琥珀酸介导下调控炎症因子的产生[2],参与肾素释放的调节并导致血压升高,已有研究结果显示,心脏组织中亦存在GPR91的表达,提示GPR91很可能与心脏功能密切相关,心肌细胞低氧时GPR91可被激活[3-7]。低氧环境会对心肌组织造成损伤,破坏电平衡和心肌收缩功能[3-4],在患有心肌肥大的患者及各种心肌损伤动物模型中均可见钙调素依赖蛋白激酶Ⅱ(calmodulin dependent protein kinaseⅡ,CaMK Ⅱ)的上调,B 型尿钠肽(brain natriuretic peptide,BNP)为临床上常见的判定心肌肥大的标志物。本实验将CaMK Ⅱ及BNP作为判定心肌损伤的标志,通过研究常氧、低氧环境下GPR91与相关信号分子的变化,为GPR91作为心肌缺氧性疾病防治靶点的研究提供理论依据。
1 材料与方法
1.1 主要试剂与仪器
胎牛血清、PBS、DMEM 培养基、胰蛋白酶(Gibco),胶原酶Ⅱ、DNA 酶Ⅰ、磷酸酶抑制剂(Solarbio),琥珀酸盐(Succinate,Suc)和5-溴脱氧尿苷(5-bromo-2′-deoxyuridine,BrdU)(Sigma),蛋白酶抑制剂(Cwbio),抗β-actin 兔多克隆抗体(Cell Signaling Technology), 羊 抗 兔 二 抗 (Abcam), siRNA 试 剂 盒(Ribobio)。
洁净工作台(北京半导体设备一厂),CO2培养箱(Thermo),XH-89型涡旋振荡器(浙江乐成电器厂),台式高速离心机(Sigma),BS200s-WEI 台式天平(北京赛多利斯天平有限公司),电热恒温鼓风干燥箱(上海一恒科技有限公司),低氧培养小室(Stem Cell)。
1.2 实验方法
1.2.1 新生大鼠原代心肌细胞培养取出生24 h 内的SD乳鼠,浸于75%乙醇中消毒1 min后置于洁净工作台,开胸后快速取心脏并放入预冷的PBS 中清洗两遍,然后将心肌组织剪成1 mm3的细小组织块。加入0.06%的胰酶,消化2 min 后弃去液体,随即加入3 mL 0.05%的胶原酶置于恒温水浴锅中37 ℃消化5 min。重复消化过程3~4 次,直至瓶内组织块完全消失。加入含有15%胎牛血清的DMEM 培养基终止消化,将消化液过滤后移入离心管,1 000 r/min 离心10 min,弃上清,使用完全培养基DMEM 重悬细胞,吹打混匀后移入细胞培养瓶,放入37 ℃、CO2体积分数为5%的培养箱中90 min。显微镜下观察,可见成纤维细胞已贴壁,圆形心肌细胞悬浮在培养基中还未贴壁,吸取细胞悬液,使用血球细胞计数仪计数后,加入抑制成纤维生长的BrdU,然后按每孔1×106个细胞的密度接种于6 孔板中,放入37 ℃、CO2体积分数为5%的培养箱中继续培养。每24 h 换液一次,72 h后可见心肌细胞成片搏动。
1.2.2 siRNA干扰GPR91在原代心肌细胞中的表达原代心肌细胞培养72 h后,观察心肌细胞形态大小正常,心肌搏动有节律,可用于siRNA 干扰技术操作。具体步骤按照锐博生物提供的siRNA(即用型化学合成双链小分子RNA)产品说明书进行。对6孔板培养的细胞进行分组,随机分为阴性对照组(CTL,不作任何处理)、CTL+siGPR91(100 μmol/L)组、Suc(200 μmol/L)组、Suc(100 nmol/L)+siGPR91(200 μmol/L)组、低氧CTL组、低氧CTL+siGPR91(200 μmol/L)组、低氧Suc(200 μmol/L)组和低氧Suc(200 μmol/L)+siGPR91(200 μmol/L)组。干扰48 h 后使用Western blot 法检测干扰效果。
1.2.3 制备原代心肌细胞低氧模型低氧培养小室为独立、密闭、灭菌的细胞培养小室,可放入现有的实验室培养箱中与其他细胞共同培养。我们将原代心肌细胞进行siRNA 及分组给药处理后,将其放入已经消毒好的细胞培养小室,小室底部使用无菌细胞培养皿盛放高压灭菌蒸馏水,完全密封后,通入体积分数为10%氧、5%二氧化碳及85%氮气的混合气体,将气体速率控制在20 L/min,充气10 min使混合气体完全充满小室。拔掉通气管,使用75%乙醇消毒小室表面后放入37 ℃、CO2体积分数为5%的培养箱。本实验采用10%的氧含量下低氧培养5 d,观察细胞的搏动次数及形态改变。最后提取心肌细胞总蛋白,通过Western blot 法检测心肌损伤相关蛋白(GPR91、BNP及CaMKⅡ)的表达。
1.2.4 CCK-8 检测心肌细胞存活率原代心肌细胞以1×104/mL 的密度接种于96 孔板中,分组给药及siRNA 处理后置于低氧小室培养5 d,取出心肌细胞向每孔加入10 μL 的CCK-8 溶液(避免产生气泡)。然后将96孔板放入低氧小室并充入混合气体随即于培养箱内孵育1~4 h,用酶标仪测定D(450)值。

1.2.5 检测原代心肌细胞低氧模型的ATP 含量本实验全程在冰上操作。取出在低氧小室培养5 d 的原代心肌细胞,弃去培养液,然后使用移液枪每孔加入100 μL 裂解液;冰上裂解,12 000 g 离心 5 min 后,取上清。使用ATP检测裂解液稀释标准品,根据标准品浓度制作标准曲线;在标准品及样品孔内加入100 μL的检测工作液,室温放置3~5 min,然后分别在标准品及样本孔内加入20 μL标准品或者样品,迅速混匀,使用酶标仪测定450 nm处的吸光度D(450)值。
1.2.6 Western blot 检测相关目的蛋白的表达变化取出各组原代心肌细胞,全程置于冰上操作。加入预冷蛋白裂解液提取蛋白,BCA 试剂盒测定蛋白含量;各取20 μL 蛋白上样,进行SDS-PAGE 电泳,将蛋白转移至PVDF膜,室温下脱脂牛奶封闭3 h,4 ℃条件下一抗(1∶1 000)孵育过夜,TBST 缓冲液洗涤5 次,每次5 min,二抗摇床室温孵育1 h,TBST 缓冲液洗涤,凝胶成像系统扫描分析蛋白的相对表达量。
1.3 数据统计与分析
应用SPSS 20.0 软件。数据以xˉ±s表示,组间比较采用单因素方差分析(one-way ANOVA),两两比较采用SNK检验。不符合方差齐性者采用 Welch方差分析。以α=0.05为检验水准。
2 结 果
2.1 Western blot检测siRNA干扰效果
Western blot检测GPR91蛋白表达结果见图1。与CTL 组比较,CTL+siGPR91 组 GPR91 蛋白表达明显降低,差异具体统计学意义(P<0.01),说明siRNA干扰成功,可进行后续实验操作。
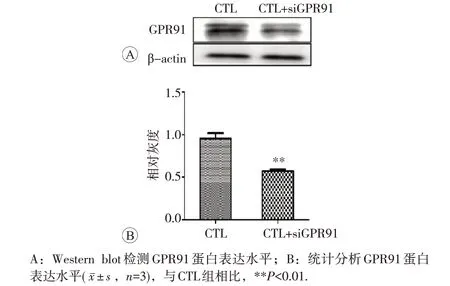
图1 Western blot检测siRNA干扰效果
2.2 CCK-8法检测心肌细胞存活率
原代心肌细胞的存活情况如图2 所示,常氧环境下,与CTL 组相比,CTL+siGPR91 组心肌细胞存活率未见明显差异,加入琥珀酸后,细胞存活率出现降低(P<0.05),Suc+siGPR91组细胞存活率较Suc组升高(P<0.05);低氧环境下,细胞存活率较常氧环境明显降低,与CTL 组相比,CTL+siGPR91 组细胞存活率升高(P<0.05),Suc 和 Suc+siGPR91 组细胞存活率明显降低(P<0.05);Suc+siGPR91组细胞存活率较Suc组升高(P<0.05)。
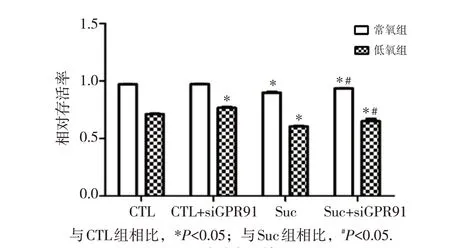
图2 原代心肌细胞的存活情况(xˉ±s,n=3)
2.3 原代心肌细胞低氧模型细胞的ATP含量
原代心肌细胞的ATP 含量见图3。常氧环境下,各实验组细胞ATP含量未见明显变化,各组ATP含量的差异均无统计学意义(P>0.05)。低氧环境下,CTL+siGPR91组及CTL 组细胞ATP 含量较常氧组出现下调,但组间差异均无统计学意义(P>0.05);而Suc组及Suc+siGPR91组细胞ATP含量较CTL组明显升高(P<0.01)。

图3 原代心肌细胞的ATP含量(xˉ±s,n=3)
2.4 原代心肌细胞低氧模型中GPR91、BNP 及CaMKⅡ蛋白的表达变化
Western blot 检测结果见图4。常氧时CLT+siGPR91 组细胞GPR91 较CLT 组表达减弱,说明干扰成功;Suc+siGPR91 组细胞GPR91 表达较Suc 组明显降低(P<0.01)。低氧环境下,CLT+siGPR91 组细胞GPR91表达较CLT组减弱,Suc及Suc+siGPR91组细胞较CLT组明显增加(均为P<0.01)。
常氧时CTL+siGPR91组细胞BNP表达较CTL组出现明显下调,加入200 μmol/L Suc 后,Suc 组细胞的BNP 表达较 CTL 组明显上调(P<0.01),Suc+siGPR91组细胞BNP 表达较CTL 组增加,而Suc+siGPR91 组BNP较Suc组出现降低(P<0.05);低氧环境下,总体较常氧环境下BNP的表达出现明显的增加,CTL+siGPR91组BNP 表达较 CTL 组减少,Suc 组较 CTL 组表达明显增加(P<0.01),Suc+siGPR91组BNP表达较CTL组也出现增加(P<0.01),与 Suc 组相比,Suc+siGPR91 组 BNP 表达也出现降低(P<0.05)。
常氧环境下,Suc 及Suc+siGPR91 组细胞的CaMKⅡ表达明显较CTL组降低(P<0.01),与Suc组比较,可见Suc+siGPR91 组细胞CaMKⅡ随着GPR91 的敲低出现减少(P<0.01),说明GPR91 可能对其造成影响;低氧环境下,较常氧环境总体CaMKⅡ表达明显增加,与CTL 组比较,CTL+siGPR91 组细胞明显减少(P<0.01),Suc 组和Suc+siGPR91 组CaMKⅡ表达显著的增多 (P<0.01), 与 Suc 组 相 比 , Suc+siGPR91 组 细 胞CaMKⅡ表达降低(P<0.01)。
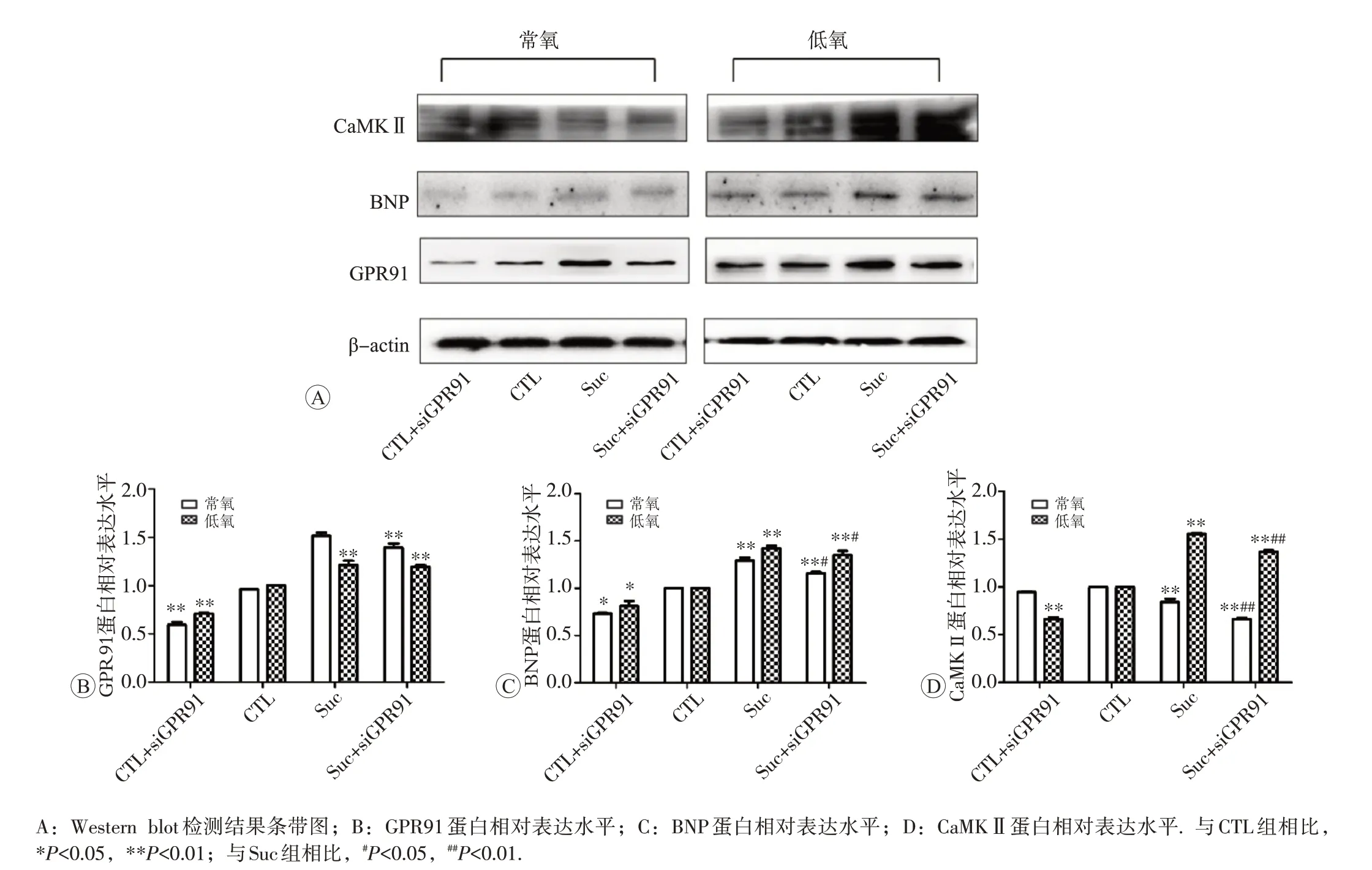
图4 原代心肌细胞低氧模型中GPR91、BNP及CaMK Ⅱ蛋白的表达变化(xˉ±s,n=3)
2.5 GPR91对PI3K/Akt通路的影响
Western blot 检测结果见图5。常氧环境下,CTL、CTL+siGPR91 组细胞Akt 的表达未见明显变化,加入 200 μmol/L 琥珀酸后,Suc 较 CTL 组的 Akt 表达增加,Suc+siGPR91 组 Akt 的表达较 CTL 组升高(P<0.05),但Suc+siGPR91组较Suc组相比,Akt表达减少(P>0.05);低氧环境下,Akt的蛋白表达较常氧情况出现明显的上调,CTL+siGPR91 组Akt 的表达较CTL 组降低(P<0.05),加入200 μmol/L琥珀酸,Suc组、Suc+siGPR91 组Akt 的表达较CTL 组明显增加,Suc+siGPR91组较Suc组相比,Akt表达减少(P<0.01)。
常氧环境下,CTL+siGPR91 组细胞的P-Akt 表达较CTL 组降低;加入200 μmol/L 琥珀酸后,Suc 组的P-Akt表达较CTL组降低,Suc+siGPR91组较CTL组也出现明显的降低(P<0.01);低氧培养后,与CTL 组相比,CTL+siGPR91组P-Akt的表达降低(P<0.01);加入200 μmol/L琥珀酸后,Suc及Suc+siGPR91组的P-Akt表达较 CTL 组增加(P<0.01);Suc+siGPR91 组 P-Akt 的表达较Suc组减少(P<0.01)。
3 讨 论
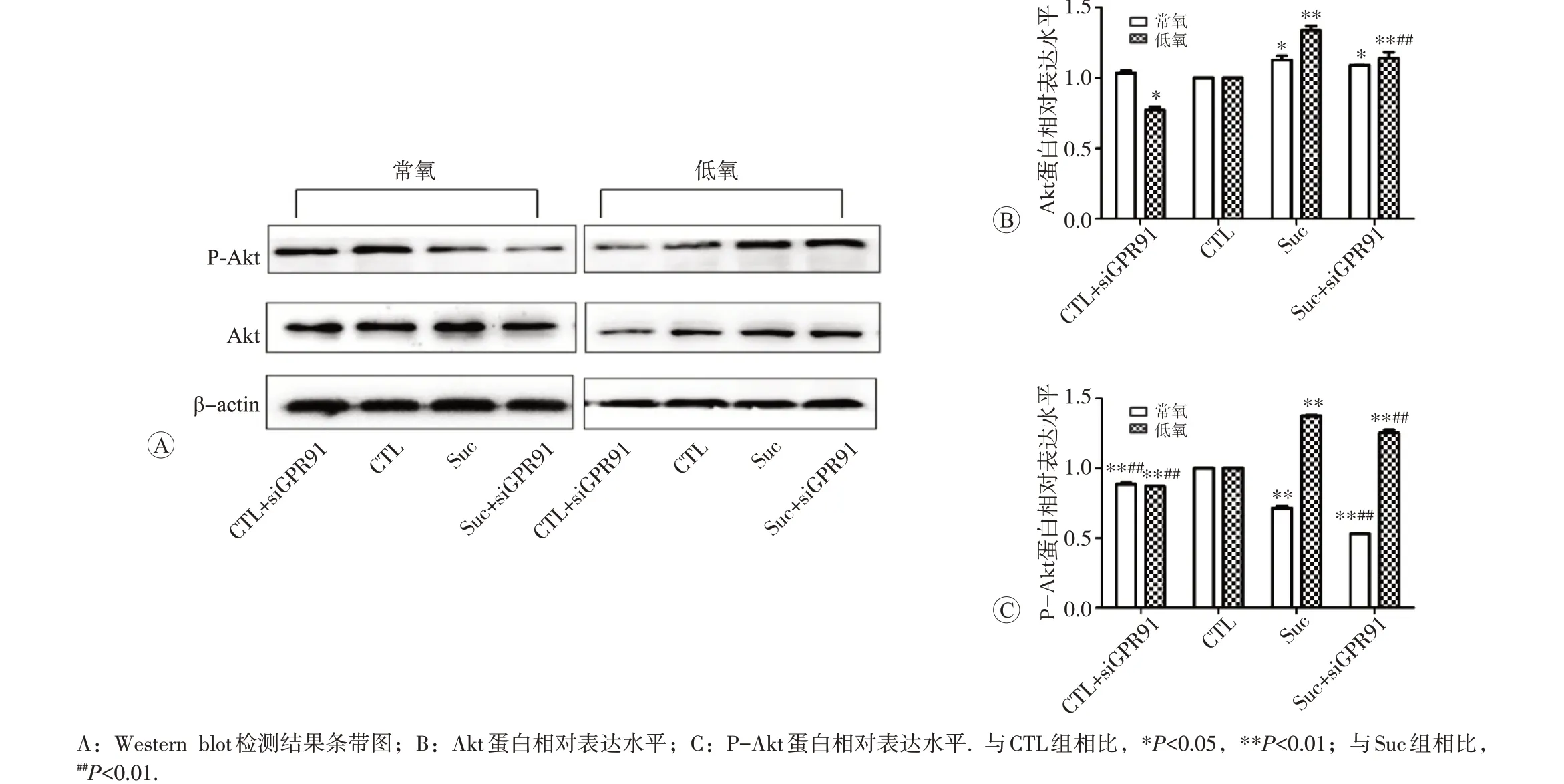
图5 原代心肌细胞低氧模型中GPR91对Akt磷酸化的影响(xˉ±s,n=3)
为探讨GPR91是否参与心肌细胞损伤的机制,我们选用siRNA技术干扰GPR91的表达,Western blot法检测干扰效果,可达到50%的抑制率,说明干扰成功,为下游信号分子通路的研究提供了基础。低氧培养小室具有独立、密闭性良好的特点,可直接放入现有实验室的细胞培养箱与其他细胞共同培养。初期实验设置体积分数为1% O2、94% N2和5% CO2的混合气体,模拟急性低氧环境,观察心肌损伤。接近无氧培养6 h 后,可见心肌细胞消失自主搏动,心肌间隙变宽,更有大片心肌细胞变形,胞核破裂,造成心肌细胞50%以上的死亡率。随即更改实验条件,更换体积分数为10% O2、5% CO2及85% N2的混合气体组分,模拟高原环境下氧含量,低氧培养5 d,每隔1 d 换液,可在显微镜下观察到实验第1天心肌细胞搏动稍有增快,心肌细胞形态较CTL未见明显变化;低氧环境下培养3 d后可在显微镜下观察到心肌细胞搏动减慢,心肌细胞间隙增宽,并且可见个别心肌细胞变形,停止搏动;完成低氧环境下培养5 d后,镜下可见心肌细胞跳动明显变缓,加入200 μmol/L琥珀酸实验孔,可见细胞变形、肿胀,大片未见梭形正常形态的心肌,搏动变慢。表明,低氧对心肌细胞形态和基本生理功能造成影响。CCK-8检测心肌细胞存活率发现,低氧各组较常氧组的存活率降低,其中干扰GPR91后可出现存活率上升(P<0.05)。说明GPR91可能参与了低氧性心肌损伤的病理过程。
在患有心肌肥大的患者及各种心肌损伤动物模型中均可见CaMKⅡ表达的上调,且心肌损伤大鼠模型常伴有心律失常、心腔扩大及猝死的表征[8],说明CaMKⅡ在心肌疾病的发生、发展中有重要价值。BNP为临床上常见的判定心肌肥大的标志物,本部分实验将CaMKⅡ及BNP作为判定心肌损伤的标志。丝氨酸/苏氨酸蛋白激酶,PI3K 可介导多种细胞反应,其中PI3K/Akt可调节心肌结构,造成心肌肥大[9-11]。琥珀酸盐是柠檬酸循环的重要中间代谢产物,缺血及低氧环境下血液中Suc 水平升高[12-14],本实验中Western blot结果显示,常氧情况下,干扰GPR91 后,BNP、CaMKⅡ及Akt表达减少,其中BNP较CTL组差异有统计学意义(P<0.05),说明正常情况下,GPR91对CaMKⅡ及Akt 的影响较小。加入200 μmol/L 琥珀酸后,BNP蛋白的表达出现上调,但对CaMKⅡ及Akt的影响较小,未见明显变化。常氧环境下,加入200 μmol/L琥珀酸,BNP、CaMKⅡ的表达Suc+siGPR91 组较Suc组有减少,差异均有统计学意义(P<0.05)。低氧情况,干扰GPR91 表达后,可见CTL+siGPR91 组的BNP、CaMKⅡ及Akt 表达水平较CTL 下调,且差异均有 统 计 学 意 义 (P<0.05), Suc+siGPR91 组 和 Suc 组BNP、CaMKⅡ及Akt 的蛋白表达水平相比CTL 组均明显增加(P<0.05),但 Suc+siGPR91 组较 Suc 组降低(P<0.05),说明GPR91可能在低氧心肌细胞损伤中对BNP及CaMKⅡ产生影响。敲低GPR91 的表达后可使Akt的磷酸化水平降低,推测GPR91 可能通过激活Akt 的磷酸化参与心肌损伤的病理过程。预示着GPR91可以作为心肌缺氧损伤的干预分子,具有药物防治靶点的潜在价值。
