酶解法提取虎杖中白藜芦醇的因素研究
2020-10-18钱辰星
钱辰星
(西安交通大学生命科学与技术学院,陕西 西安 710048)
白藜芦醇作为一种天然多酚类物质,广泛存在于植物界[1-2], 具有多种药理活性并广泛应用于医药领域。目前溶剂提取、超声提取、酶解法、微波提取、超临界 CO2萃取等方法[1,3-6]已广泛用于白藜芦醇的高效提取。溶剂提取法工艺成熟,但溶剂用量大,耗时长,提取率低,杂质多,不符合绿色化学理念[7-8,11-12]。超声提取法,微波提取法和超临界CO2提取法提取周期短,提取率高,但微波泄露存在健康隐患[4-5,13],实验仪器昂贵且实验条件苛刻,不利于大规模生产。纤维素酶提取法则有绿色环保,提取效果好,工艺简单,成品生物相容性高等优点。酶解温度、酶解液pH 值和酶解时间对纤维素酶提取白藜芦醇影响显著[9-11]。
虎杖具有长久的种植史和多种药用功效,且富含白藜芦醇及其衍生物,为高效提取白藜芦醇提供了可能[8-12,14]:刘树兴与陶明宝等[9-11]等运用响应面分析与正交实验对白藜芦醇的酶法乙醇提取进行了纤维素酶用量、酶解时间、溶剂用量与酶解温度等因素考察。N,N-二甲基甲酰胺(DMF)作为强极性溶剂,被证实对生物组织光合色素、辅酶与纤维素成分有较强提取作用[14-16]。而白藜芦醇酚羟基为强极性溶剂高效提取提供了可行性。本文将在已优化白藜芦醇提取工艺基础上,采用DMF、乙醇(EtOH)与乙酸乙酯(EtOAc)作为提取溶剂,结合酶解温度、溶剂用量探究酶解法提取白藜芦醇的产率影响因素。

图1 白藜芦醇的化学结构Fig.1 The structural formula of resveratrol
1 实 验
1.1 实验原理
植物中白藜芦醇以自由态和白藜芦醇葡糖苷2种形式存在,纤维素酶可催化植物体中白藜芦醇苷在一定条件下酶解脱去一分子葡萄糖,转换成白藜芦醇并通过对植物细胞壁的分解破坏增加白藜芦醇溶出。
酶解后利用有机溶剂进行萃取,利用高效液相色谱-紫外可见光谱联用法在306 nm特征峰处进行白藜芦醇含量测定,推算提取率。
1.2 仪器与材料
SQP型1/1万电子天平,赛多利斯科学仪器(北京)有限公司;PHS-25型酸度计,上海雷磁仪器厂;HH-2数显恒温水浴锅,国华电器有限公司;UPT-I-10T优普系列超纯水器,成都超越科技有限公司;Agilent 1260 高效液相色谱仪,安捷伦科技有限公司;TG20高速离心机,常州金坛良友仪器有限公司。
白藜芦醇对照品(11535-200502),中国药品生物制品检定所;色谱纯乙腈,德州润昕实验仪器有限公司;虎杖干粉,北京同仁堂有限公司;纤维素酶粉剂(3000 U/g),东恒华道生物科技有限责任公司。
1.3 实验方法
1.3.1 正交实验设计
对于拟探究的四个因素:酶解时间、溶剂选取、溶剂用量、酶解温度设定三个不同水平并进行L9(34)正交实验设计。
1.3.2 酸性酶解
精密称取虎杖干粉1 g,加入60 mg粉状纤维素酶,重复配置9组。加入4 mL用浓盐酸调节pH至5.0的蒸馏水。在表1所示的酶解条件下进行水浴加热。

表1 虎杖白藜芦醇醇提工艺正交实验因素水平Table 1 Orthogonal test levels of factors associated with polygonum cuspidatum extraction technology
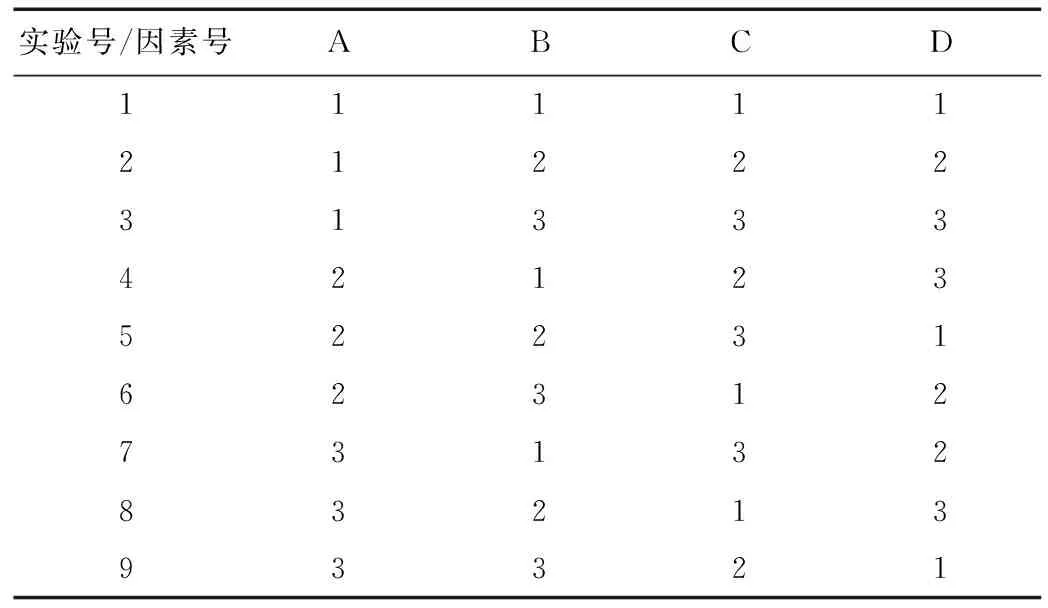
表2 虎杖白藜芦醇醇提工艺正交实验实验安排Table 2 Experiment scheme for orthogonal test
1.3.3 溶剂提取
酶解后的九组样品在表1所示的提取条件下尽行85 ℃提取2 h。之后将粗产物减压抽滤,再离心(3000 rpm,10 min),离心后得提取液。将离心过程重复三次,得到样品。
1.4 表 征
1.4.1 色谱条件
色谱柱:Kromasil-C18(200×4.6 mm,5 μm);流动相:乙腈-水(30:70);检测波长:305 nm;流速:1 mL·min-1;柱温:30 ℃;进样量:10 μL。
1.4.2 对照溶液配制与标准曲线测定
精密称取白藜芦醇对照品5.31 mg,置25 mL量瓶中,加甲醇溶解并稀释至刻度,摇匀,即得每1 mL中含白藜芦醇212.4 μg的标准溶液。 分别稀释至原浓度的1/10、1/5、2/5、3/5、4/5、5/5倍精密吸取对照品溶液10.0 μL注入液相色谱仪测定,以峰面积 Y对进样量X(μg)进行线性回归[12]。白藜芦醇质量在2.12~21.2 μg范围内呈良好线性关系。回归方程为:
S=7196.35 m+236.12,R2=0.997。
其中S为色谱峰面积(单位为mAU·s),m为样品中白藜芦醇质量。
1.4.3 精密度实验
在1.3.1所述色谱条件下精密吸取同一浓度的白藜芦醇21.24 μg/mL对照品溶液10 μL,连续进样6次,测定峰面积积分值,计算精密度。RSD为0.043%,表明仪器进样精密度良好。
1.4.4 稳定性实验
取同一样品溶液,分别在0、2、4、6、8、10、12 h测含量,结果样品在12 h内基本稳定,RSD为0.11%,12 h内稳定性保持良好。
1.4.5 样品白藜芦醇含量测定
利用高效液相色谱法进行九组样品每组样品吸取10 μL的白藜芦醇提取率鉴定。
1.4.6 计算提取率
根据高效液相色谱分析结果,计算每组提取率。计算公式为:
提取率=(总提取质量/虎杖干粉总质量)×100%
2 结果与讨论
2.1 实验结果
采用极差分析法对正交实验结果进行因素直观分析(表3),可知四种因素对于白藜芦醇提取率影响显著性排序为溶剂选择(D)>酶解温度(A)>溶剂用量(B)>酶解时间(C)。通过F检验判断不同因素的显著性大小(表4)。溶剂选择对于提取率的影响有决定性的显著性影响作用。最佳条件组合为五号实验A2B2C3D1,提取率达到18.333%,相比于陶明宝[9]等研究中提取率有所提高。
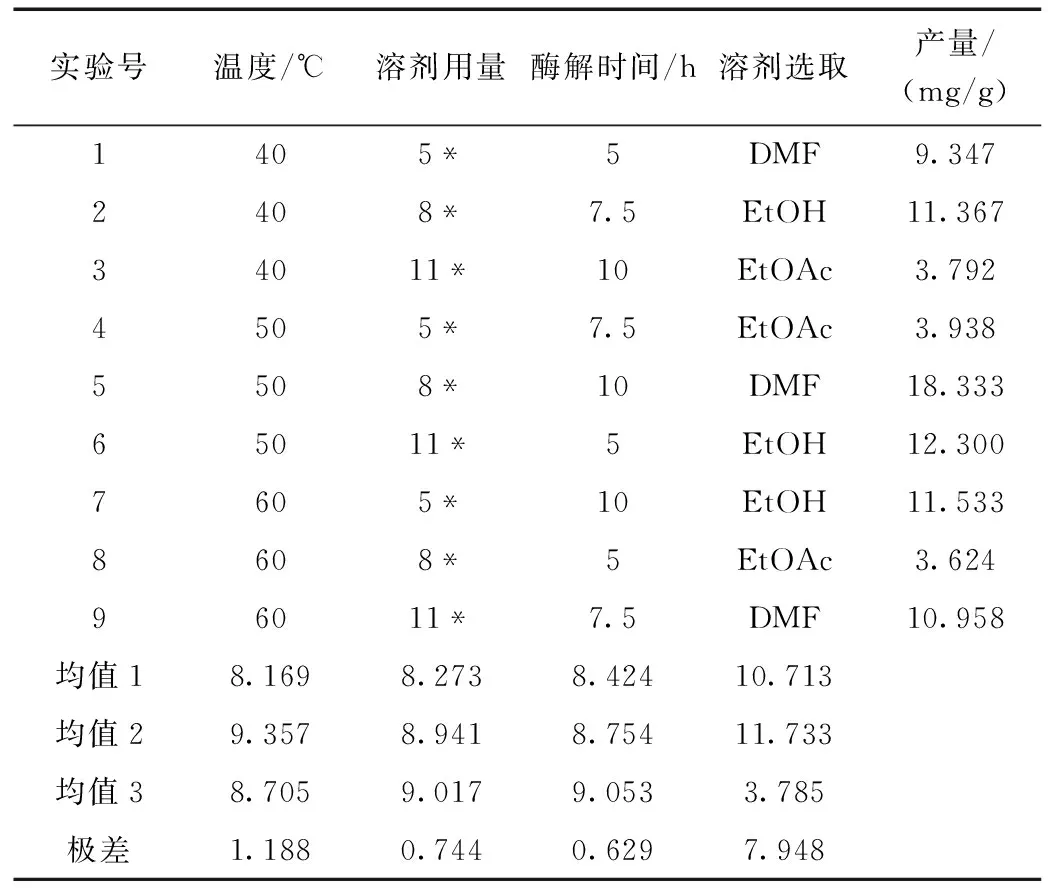
表3 正交实验结果与因素影响顺序分析Table 3 Impact order analysis for results of orthogonal test
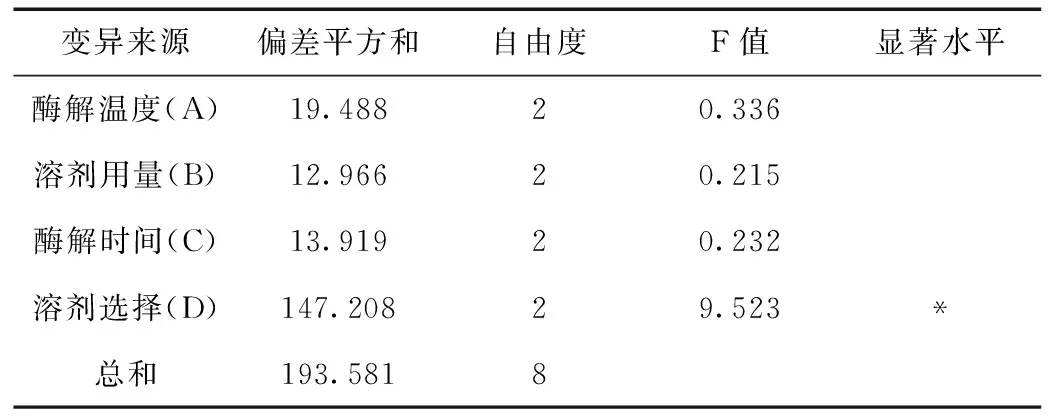
表4 正交实验因素显著水平分析Table 4 Significance analysis for orthogonal test results
2.2 讨 论
实验中酶解温度以50 ℃最为适合,这与纤维素酶的最适温度有关。酸解液-溶剂比控制在1:8能达到最佳提取率。最佳提取溶剂为DMF。实验中三种溶剂极性排序和与酚羟基形成氢键的强弱顺序为:DMF>乙醇>乙酸乙酯,暗示了溶剂选择对于提取率的影响主要取决于溶剂极性程度,与白藜芦醇-溶剂的之间氢键的强弱。本实验中DMF的高提取率为其他诸如DMSO,乙腈等强极性有机溶剂的高提取效率提供了可能。5~10 h内提取率与酶解时间存在不显著的正向变化,因此短时间内的白藜芦醇单次提取相比于长时(通常大于24 h),多次提取已经达到比较高的提取率。
3 结 论
提取最佳条件为:取1 g虎杖干粉加入4 mL pH=5的盐酸溶液,酶解10 h,加入32 mL DMF,85 ℃水浴加热2 h。其中溶剂选取占据了决定性因素,同时酶解时间也与提取率存在正向关系。本实验相比于耗时、耗溶剂、提取液液杂质含量高且提取率较低的传统方法溶剂用量少(8倍量DMF)、操作简便、高效、提取率(1.833%)相对较高。并证实了DMF作为提取溶剂时白藜芦醇提取率存在显著性上升,为白藜芦醇的酶解法提取优化工艺提供新思路。
