南极磷虾肽-亚铁螯合物的制备及理化性质分析
2020-10-18林海燕王珊珊马玉洁吕世伟周德庆
林海燕,王珊珊,马玉洁,吕世伟,周德庆
(1.中国水产科学研究院黄海水产研究所,青岛海洋科学与技术试点国家实验室海洋药物与生物制品功能实验室,山东青岛266071;2.上海海洋大学食品学院,上海201306)
南极磷虾(Euphausia superba)生物储量大,对维持整个南极海洋生态系统平衡起着重要作用[1]。据估计目前全球每年南极磷虾捕捞量近30万吨,主要用来制作鱼饵和饲料等低值化产品及虾油软胶囊等产品,大量富含优质蛋白的副产物未得到有效利用,造成资源的浪费。南极磷虾蛋白中含有18种常见氨基酸,其中包括 8种人体必需氨基酸(essential amino acids,EAA)[2],构成比例符合联合国粮农组织 (Food and Agriculture Organization,FAO)/世界卫生组织(World Health Organization,WHO)推荐的理想蛋白质模式[3]。目前对南极磷虾蛋白的研究主要集中在磷虾活性多肽的制备和功效研究等方面,为南极磷虾蛋白的高值化开发利用提供了有效途径。
铁作为机体必需的微量元素,对促进机体生长发育、新陈代谢等方面具有重要的生理功效[4]。铁元素主要参与机体氧的运输和储存、细胞色素及某些金属酶的合成、能量的生产和细胞的增殖等多种生化过程[5]。铁缺乏可导致细胞低色素贫血、成人机体活动障碍及儿童认知障碍等风险[6]。目前,由于机体对铁的摄入量较少、吸收率过低等原因,缺铁性贫血(iron deficiency anemia,IDA)已成为世界各国普遍关注的营养性疾病之一。市场上存在的铁补充剂主要是硫酸亚铁等无机铁补充剂,以及琥珀酸亚铁、富马酸亚铁、乳酸亚铁等可溶性的小分子有机铁盐络合物[7]。然而这些补铁剂存在稳定性差、机体生物利用率低等问题,若长期服用还可能对肠胃产生刺激,严重时可导致机体出现恶心呕吐的症状及铁中毒等风险[8]。肽-亚铁螯合物作为新型食源性铁补充剂,具有安全性好、稳定性佳、生物利用率高等优点,是当前食品领域中极具发展潜力的功能因子。本文以南极磷虾肽(antarctic krill iron-chelating peptides,AKP)和 FeCl2·4H2O为原料,以亚铁螯合率和螯合物得率为评价指标,在单因素试验基础上采用正交试验制备南极磷虾肽-亚铁螯合物(antarctic krill peptide-ferrous chelates,AKP-Fe),并对其理化性质进行分析,以期为南极磷虾蛋白的高值化利用和新型补铁剂的开发提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
南极磷虾:辽宁省大连海洋渔业集团公司;FeCl2·4H2O、FeSO4、邻菲啰啉、盐酸羟胺、茚三酮、D-果糖、无水乙醇、抗坏血酸、Na2S、NaOH、HCl(分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
XT5118-OV50电热鼓风干燥箱:杭州雪中炭恒温技术有限公司;UV-9000紫外可见分光光度计:上海元析仪器有限公司;SCIENTZ-10N冷冻干燥机:宁波新芝股份有限公司;STARTER 3C pH计:奥豪斯仪器有限公司;HH-21-4电热恒温水浴锅:常州诺基仪器有限公司;LC-4012离心机:安徽中科中佳科学仪器有限公司;Bruker Tensor 27红外光谱仪:德国Bruker公司;JSM-840型扫描电镜:日本JEOL公司。
1.3 方法
1.3.1 AKP-Fe的制备
1)AKP的制备:南极磷虾原料→预处理→匀浆→酶解→灭酶→离心→冷冻干燥→AKP样品[9]。
2)AKP-Fe的制备:AKP→溶解→加入抗坏血酸→调节pH值→加入FeCl2·4H2O→恒温水浴螯合反应→离心→取上清液→无水乙醇沉淀→沉淀→真空冷冻干燥→AKP-Fe样品[10]。
3)操作步骤:称取3 g AKP放入烧杯中,加入100 mL蒸馏水使其充分溶解,得到浓度为30 mg/mL样品溶液,并加入抗坏血酸防止Fe2+氧化,调节反应体系的pH值。然后按比例加入FeCl2·4H2O,在35℃反应30 min,冷却后将反应液在4 500 r/min的条件下离心15 min。取上清液用6倍体积无水乙醇反复洗涤多次后收集沉淀,将沉淀物冷冻干燥后得到AKP-Fe。
1.3.2 亚铁螯合率与螯合物得率的测定
参照李博等[10]和蔡冰娜等[11]的测定方法,并略作修改。
1)铁离子标准溶液(10 μg/mL)的配制:精确称取0.7022gFe(NH4)2(SO4)2·6H2O溶解于20mL6mol/LHCl和少量超纯水中,定容至1 L,得到浓度为100 μg/mL Fe2+溶液。从上述溶液中移取10 mL,加入2 mL 6 mol/L HCl溶液,定容至100 mL,配制成10 μg/mL的铁离子标准溶液,避光保存。
2) 标准曲线的绘制:分别吸取 2.0、4.0、6.0、8.0、10.0 mL的标准溶液于50 mL容量瓶中,然后依次加入1 mol/L HCl溶液、10%盐酸羟胺溶液、0.12%邻菲啰啉溶液各1mL、10%醋酸钠溶液5mL,定容后于510nm处测定吸光度。参比液为不含铁离子的溶液,横坐标为铁含量,纵坐标为吸光值。
3)样品测定:准确称取一定量的样品溶解于含有2mL浓盐酸的超纯水中,定容至100mL。吸取一定体积的样品溶液于50mL容量瓶中,按标准曲线测定方法测定样品中铁含量。每个样品重复3次试验,取平均值。


式中:m1为螯合物中亚铁含量,mg;m2为加入体系的铁含量,mg,W1为 AKP-Fe 的质量,mg;W2为AKP 与 FeCl2·4H2O 的总量,mg。
1.3.3 抗坏血酸添加量对螯合反应的影响
固定AKP的浓度为3%,AKP与FeCl2·4H2O的质量比为3∶1,选用抗坏血酸与FeCl2·4H2O的质量比为(0、0.1 ∶1、0.2 ∶1、0.3 ∶1、0.4∶1、0.5∶1)。将反应体系的pH值调整为5,置于35℃的水浴锅中螯合反应30 min取出,冷却后将反应液在8 000 r/min的条件下离心10 min,烘干并比较沉淀的质量。
1.3.4 单因素试验
分别固定AKP的浓度为3%,肽与FeCl2·4H2O的质量比为3∶1,螯合温度35℃,螯合时间30 min,pH值为5,乙醇体积倍数为6,抗坏血酸与FeCl2·4H2O质量比为0.2∶1,以亚铁螯合率和亚铁螯合物得率为测定指标,进一步探究螯合温度(25、35、45、55、65℃)、螯合时间(20、30、40、50、60、70 min)、AKP 的浓度(2%、3%、4%、5%、6%)、pH 值(3、4、5、6、7)、AKP 与FeCl2·4H2O 的质量比(1 ∶2、1 ∶1、2 ∶1、3 ∶1、4 ∶1、5 ∶1)对螯合反应的影响。
1.3.5 正交试验
在单因素试验的基础上,选择对评价指标影响较大的3个因素(肽铁质量比、螯合温度、pH值)进行正交试验,确定最佳螯合工艺参数。正交试验因素与水平的设计如表1所示。

表1 正交试验因素与水平Table 1 Factors and levels of orthogonal test
1.3.6 傅里叶变换红外光谱扫描
将烘干至恒重的KBr分别与适量的AKP与AKP-Fe冻干粉充分混合、研磨并压片,在波长为4 000 cm-1~400 cm-1的范围内对其进行扫描[10]。
1.3.7 扫描电镜及能谱分析
取适量的AKP与AKP-Fe样品,经真空喷金处理后,在扫描电镜(scanning electron microscope,SEM)下观察样品的显微结构,并利用能谱仪(electron energy disperse spectroscopy,EDS)分析元素成分及含量[2]。
1.3.8 氨基酸组成分析
参考GB 5009.124-2016《食品安全国家标准 食品中氨基酸的测定》[12]的方法进行测定。
2 结果与分析
2.1 抗坏血酸添加量对螯合反应的影响
研究表明,在中性或偏碱性的环境中,Fe2+较Fe3+的溶解性高,且Fe2+有利于机体的吸收利用。由于Fe2+在空气或溶液中极易被氧化成Fe3+,生成氢氧化铁沉淀[13-14],造成螯合物不纯。因此为制备纯度较高的亚铁螯合物,抗氧化剂的选择和使用十分关键。杨华等[15]制备大豆多肽-亚铁螯合物时,比较了亚硫酸氢钠、盐酸羟胺、抗坏血酸、异抗坏血酸钠等抗氧化剂对反应体系中Fe2+的保护效果,发现抗坏血酸的效果最佳。图1为抗坏血酸与FeCl2·4H2O质量比对螯合反应的影响。

图1 抗坏血酸与FeCl2·4H2O质量比对螯合反应的影响Fig.1 Effect of the mass ratio of ascorbic acid and FeCl2·4H2O on chelating reaction
由图1可以看出,在试验所选范围内,沉淀的质量随抗坏血酸与FeCl2·4H2O的质量比的增加呈现先减小后增加的趋势。当两者质量比为0.2∶1时,生成的沉淀质量最低,且抗坏血酸的添加也不会破坏整个反应体系。因此选择抗坏血酸与FeCl2·4H2O的质量比为0.2∶1。
2.2 单因素试验结果
2.2.1 肽浓度对螯合反应的影响
AKP浓度对亚铁螯合率和螯合物得率的影响见图2。

图2 AKP浓度对亚铁螯合率和螯合物得率的影响Fig.2 Effect of peptide concentration on iron-chelating rate and chelate yield
由图2可知,在螯合反应过程中,亚铁螯合率和螯合物得率均随AKP浓度的增大呈现先上升后下降的趋势。当AKP浓度在2%~5%时,亚铁螯合率和螯合物得率均呈现增加趋势;当肽浓度高于5%时,两个指标则呈现下降趋势。这可能是由于AKP浓度较低时,反应体系中肽链与Fe2+之间的相互碰撞较少,导致螯合率和产物得率相对偏低[16]。当AKP浓度过高时,反应体系中存在的大量产物可能会使螯合反应呈逆向进行,同样不利螯合反应的进行。因此选择AKP浓度为4%。
2.2.2 肽铁质量比对螯合反应的影响
肽铁质量比对亚铁螯合率和螯合物得率的影响见图3。

图3 肽铁质量比对亚铁螯合率和螯合物得率的影响Fig.3 Effect of mass ratio of peptide to iron on iron-chelating rate and chelate yield
图3表明,随肽铁质量比的增加,螯合物得率和亚铁螯合率均呈现先上升后下降的趋势。当肽铁质量比较低时,反应体系中存在过多的Fe2+未能螯合,致使亚铁螯合率和螯合物得率偏低。当肽铁质量比过高时,反应体系中则剩余部分肽链,不仅导致螯合物的纯度降低,还会造成多肽资源的浪费。当肽铁质量比为3∶1时,两指标均达到最高值,因此选择肽铁质量比为3∶1。
2.2.3 温度对螯合反应的影响
温度对亚铁螯合率和螯合物得率的影响见图4。
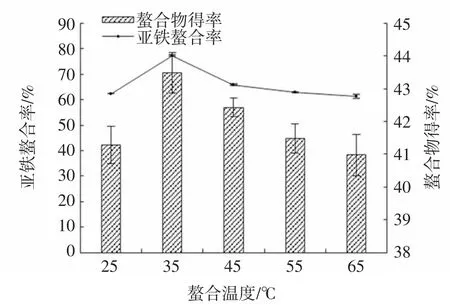
图4 温度对亚铁螯合率和螯合物得率的影响Fig.4 Effect of temperature on iron-chelating rate and chelate yield
由图4可知,当螯合温度为35℃时,亚铁螯合率和螯合物得率最高,其中亚铁螯合率可达77.31%。当反应体系温度过低时,肽链与Fe2+的反应活力降低,分子间的碰撞几率减小,致使螯合反应进行缓慢。当反应体系温度过高时,则可能导致Fe2+的氧化,致使产物不纯,从而降低螯合率和螯合物得率[8]。因此选择螯合温度为35℃。
2.2.4 时间对螯合反应的影响
时间对亚铁螯合率和螯合物得率的影响见图5。
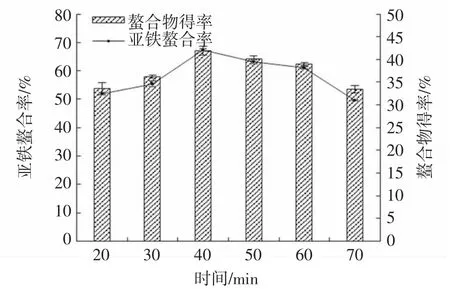
图5 时间对亚铁螯合率和螯合物得率的影响Fig.5 Effect of time on iron-chelating rate and chelate yield
由图5可知,随着螯合时间的延长,螯合物得率和亚铁螯合率均呈现先上升后降低的趋势。这可能是因为AKP与Fe2+可以在短时间内完成螯合,生成大量的螯合物;但随着时间的延长,AKP与螯合物均有不同程度的水解,导致螯合率和螯合物得率降低[17]。因此选择反应时间为40 min。
2.2.5 pH值对螯合反应的影响
pH值对亚铁螯合率和螯合物得率的影响见图6。
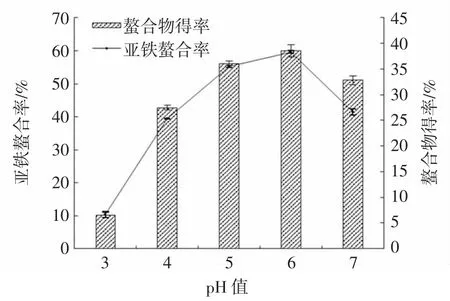
图6 pH值对亚铁螯合率和螯合物得率的影响Fig.6 Effect of pH on iron-chelating rate and chelate yield
由图6可知,pH值对亚铁螯合率和螯合物得率的影响较大。在pH值较低的酸性条件下,溶液中含有大量的H+,与Fe2+竞争供电基团,从而不利于产物的生成,导致亚铁螯合率下降。随着pH值的增大,产物得率和亚铁螯合率呈上升趋势,当pH值为6时,达到最大值。当pH值继续升高时,由于溶液中OH-含量增多,可与Fe2+结合生成氢氧化物沉淀[15-16],致使产物不纯。因此选择反应体系pH值为6。
2.3 正交试验结果分析
综合单因素试验结果,固定肽浓度为4%,螯合时间为40 min,乙醇体积倍数为6,选取A肽铁质量比、B螯合温度、C pH值3个因素为自变量,以亚铁螯合率和螯合物得率为评价指标,采用正交试验对螯合工艺进行优化,试验设计方案和结果如表2所示。
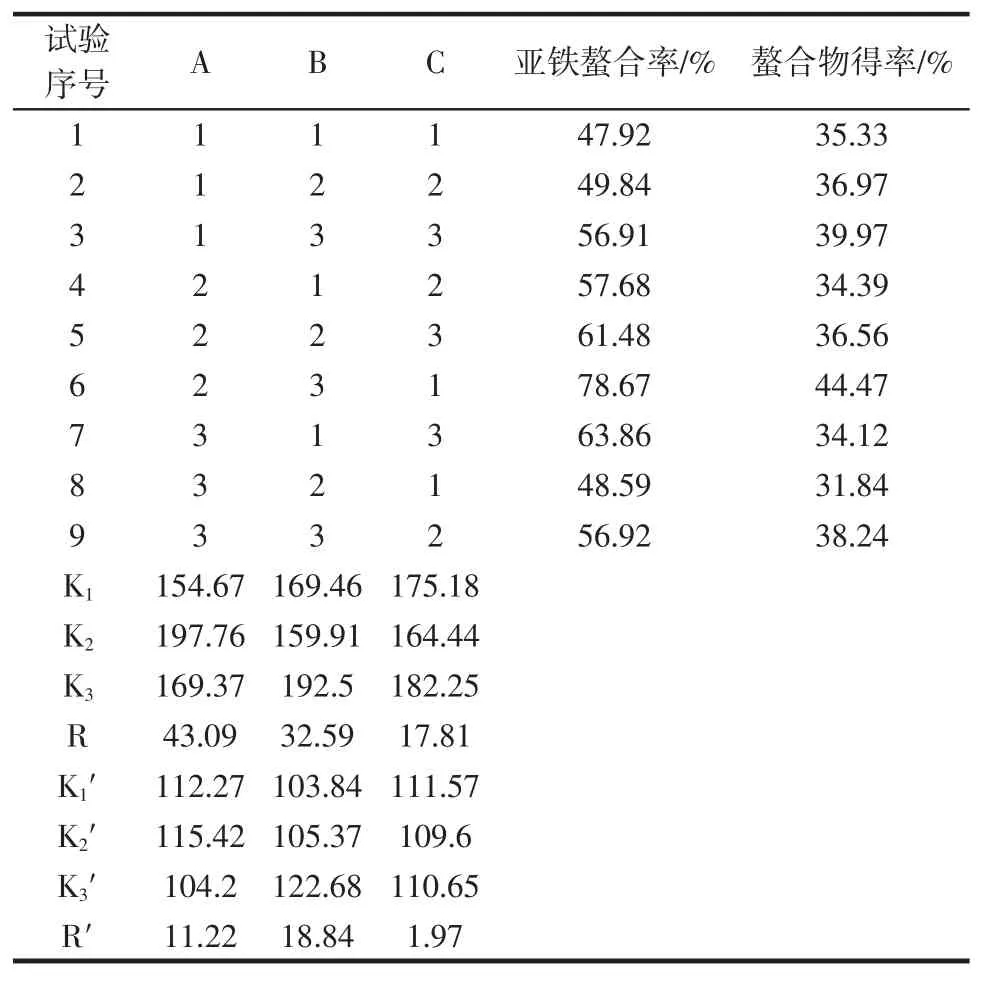
表2 正交试验设计方案与结果Table 2 Experimental design scheme with experimental results for orthogonal test
通过极差分析方法比较肽铁质量比、螯合温度、pH值3个因素对AKP-Fe制备的影响。由表2可知,肽铁质量比对亚铁螯合率的影响最大,温度次之,pH值影响最小,即A>B>C,得到以亚铁螯合率为指标的最优工艺组合为A2B3C3;温度对螯合物得率的影响最大,肽铁质量比的影响次之,pH值影响最小,即B>A>C,得到以螯合物得率为指标的最优工艺组合为A2B3C1;结合单因素试验结果,pH值较高时反应产生的沉淀相对较多,因此制备AKP-Fe的最佳工艺条件为:肽铁质量比3∶1,螯合温度40℃,螯合时间40min,pH值5.5,肽浓度4%,乙醇体积倍数6。经验证,此条件下测得亚铁螯合率为(77.25±2.11)%,螯合物得率为(41.03±0.68)%。
2.4 红外光谱分析
AKP与AKP-Fe的红外光谱图见图7。
如图7所示,AKP在3 341.79 cm-1处出现的酰胺A吸收峰,主要是由酰胺结构中N-H伸缩振动所产生;AKP在1 663.30 cm-1处出现的酰胺I强吸收峰,主要是由于C=O伸缩振动所产生;AKP在1 397.42 cm-1处出现的酰胺II吸收峰较弱,主要是由氨基酸残基侧链基团中COO-引起的;AKP在959.17 cm-1处的弱吸收峰主要是由NH4+引起[17]。与AKP谱图相比,经螯合后的AKP-Fe特征吸收峰发生了变化。AKP-Fe的酰胺A吸收峰由3 341.79 cm-1处移至3 355.29 cm-1处,酰胺I吸收峰由1 663.30 cm-1处移至1 654.62 cm-1处,而在959.17 cm-1处的铵盐吸收峰消失。由AKP-Fe酰胺A带蓝移、酰胺I带红移、铵盐吸收峰消失等特征,初步说明AKP中的氨基及羧基与Fe2+发生了螯合反应形成肽亚铁螯合物[16]。

图7 AKP与AKP-Fe的红外光谱图Fig.7 Infrared spectra of AKP and AKP-Fe
2.5 扫描电镜及能谱分析
AKP及AKP-Fe的SEM图谱见图8。

图8 AKP及AKP-Fe的SEM图谱Fig.8 Scannig electron micrographs of AKP and AKP-Fe
从图 8(A1~A3)可知,AKP 表面平滑,结构紧密、均匀,多为大小不一的片状,与Chen等[18]制备罗非鱼皮多肽的显微结构较为相似。由图8(B1~B3)可知,螯合反应导致产物显微结构发生明显变化,AKP-Fe呈现出较为致密的颗粒状聚集体结构,颗粒直径约为100 nm~200 nm。张凯等[19-20]研究发现鳕鱼骨明胶多肽与Ca2+螯合后,螯合物为直径10 μm左右的光滑球状颗粒结构。韩克光等[21]研究发现羊骨明胶多肽与Ca2+螯合之后,多肽也由零散的片状结构变为较为紧密的颗粒状聚集体,与本研究的结果较为一致。
分别对图8中AKP及AKP-Fe的视野进行能谱分析,结果如表3所示。

表3 各元素质量百分比Table 3 Chemical equivalent percentages of each element %
由图8和表3可知,AKP中的主要元素分别为C、N、O等,这些元素的含量占总元素的98.43%;AKP-Fe中的主要元素分别为C、N、O、Fe等,其中铁元素含量为20.71%,表明在螯合物制备过程中,大量Fe2+与AKP发生了螯合。
2.6 氨基酸组成分析
对AKP-Fe进行氨基酸组成分析,结果如表4所示。
AKP-Fe中含有常见的18种氨基酸,氨基酸种类齐全、含量丰富,其中Glu含量最高为18.24 g/100 g,Asp次之、含量为11.21 g/100 g,Lys与Arg的含量也相对较高,分别为 4.84 g/100 g 和 3.36 g/100 g,而 Thr、Trp、Pro、Tyr、Cys的含量相对较少。Wu 等与 Perrin 等[22-23]的研究表明,Glu和Asp因其具有环状结构能够与铁离子形成稳定的螯合物,是形成螯合物的关键氨基酸。AKP-Fe中的Glu和Asp含量较高,有可能在螯合反应中发挥了重要作用。

表4 氨基酸组成分析Table 4 Analysis of amino acid composition g/100 g

续表4 氨基酸组成分析Continue table 4 Analysis of amino acid composition g/100 g
3 结论
本研究以AKP和FeCl2·4H2O为原料,在单因素试验基础上,通过正交试验优化出AKP-Fe的制备条件为:肽铁质量比3∶1,螯合温度40℃,螯合时间40 min,pH值5.5,肽浓度4%,乙醇体积倍数6。此条件下测得亚铁螯合率为(77.25±2.11)%,螯合物得率为(41.03±0.68)%。FTIR分析显示Fe2+与AKP螯合后,AKP-Fe酰胺A吸收峰发生蓝移、酰胺I吸收峰发生红移、铵盐吸收峰消失。扫描电镜显示螯合后产物结构发生显著改变,AKP-Fe呈现出颗粒状聚集体结构。氨基酸分析表明,AKP-Fe中的氨基酸组成种类齐全,结构合理。本研究为南极磷虾蛋白的高值化开发利用和新型补铁剂的开发提供了理论支持。
