三种铁源对珍珠龙胆石斑鱼幼鱼生长性能、肝脏抗氧化酶活性及肠道发育形态的影响*
2020-10-17郭鑫伟迟淑艳谭北平姚亚军姚红梅
郭鑫伟,张 洋,迟淑艳,3**,谭北平,2,3,姚亚军,姚红梅
(1.广东海洋大学水产动物营养与饲料实验室,广东 湛江 524088;2.广东省水产动物精准营养与高效饲料工程技术研究中心,广东 湛江 524088;3.农业农村部南方水产与畜禽饲料重点实验室, 广东 湛江 524088;4.长沙兴嘉生物工程股份有限公司, 湖南 长沙 410128)
铁(Fe)作为鱼类健康生长所需微量元素之一,参与肌红蛋白和血红蛋白的行成,并且以Fe2+或Fe3+的形式激活糖代谢酶,催化该过程中的多种生化反应[1]。相比于无机态铁和简单有机酸铁两种形式,饲料中添加有机螯合铁被认为更易吸收,具有更高的生物活性[2-3]。甘氨酸铁(Fe-Gly(II))和柠檬酸铁比无机态的FeSO4能够更有效地提高凡纳滨对虾(PenaeusvannameiBoone)蛋白质效率和饲料效率[4]。然而,评价依据不同,铁源的生物效价存在差异,当分别以增重率和饲料效率为参考依据时,军曹鱼(Rachycentroncanadum)对蛋氨酸铁的生物利用率和FeSO4是相似的,但当以血清CAT活性为判据时,前者的生物利用率是后者的2.75倍[5]。目前关于铁源如FeSO4、Fe-Gly(II)和羟基蛋氨酸铁(Fe-MHA)的利用效果在猪[6]、肉仔鸡[7-8]和小鼠[9]等陆生动物上已经开展了比较研究,关于水产动物尤其是海水鱼类的研究较少。
石斑鱼目前已经成为中国四大海水养殖鱼类之一,珍珠龙胆石斑鱼(Epinepheluslanceolatu♂×E.fuscoguttatus♀)由于其生长速度快、肉质鲜嫩和抗病力强等优势已成为南海主养海水品种[10]。本研究分别添加无机态FeSO4、氨基酸螯合态Fe-MHA和Fe-Gly(II)3种铁源,探讨珍珠龙胆石斑鱼饲料中适宜铁源的应用效果,以期获得满足石斑鱼健康快速生长的微量元素Fe的适宜添加形式。
1 材料与方法
1.1 试验材料和养殖管理
参考有关鱼类商业饲料及文献[4,11-14]报道中Fe需要量,分别添加FeSO4、Fe-Gly(II)和Fe-MHA(纯度均为99%,长沙兴嘉生物工程发展股份有限公司)3种铁源,配制3组等氮等脂的试验饲料。根据饲料配方(见表1)准确称取已粉碎过60目筛的饲料原料,在V型立式混合机(JS14S型)中与微量组分预混合10 min后,倒入搅拌机并逐次加入鱼油、磷脂和适量的水,混合15 min后经双螺杆挤条机(F-75型)挤压成直径为3 mm的条状饲料。在室内自然风干至饲料水分将至10%左右,将各组饲料进行破碎分装,-20 ℃冰箱保存供养殖试验用。

表1 饲料配方及营养水平(干物质基础)[15]
在广东海洋大学海洋生物研究基地(东海岛,湛江)实施石斑鱼的养殖试验。将购回的试验用珍珠龙胆幼鱼(东海岛石斑鱼苗场,湛江,广东)置于室外水泥池中暂养10 d,期间投喂石斑鱼商业配合饲料(粗蛋白≥49%,粗脂肪≥8%)。待石斑鱼稳定并适应养殖环境后,挑选健康且规格均一的试验鱼(初重(9.00±0.49)g)随机分配到室内海水养殖玻璃钢桶中。根据试验设计,共设3个处理组,每个处理组3个重复,每个重复放养30尾鱼,静水养殖8周,定时换水2/3。每天在8:00和17:00进行投喂,投喂量约为其体重的3%,定时观察石斑鱼摄食情况及时调整投喂量,同时记录死亡数[15]。
养殖期间用水为经过沉淀和沙滤的天然海水,水体中铁元素含量≤0.000 67 mg/L,24 h供应氧气,溶解氧≥5 mg/L,盐度27~29,水温(29.14±0.75)℃,氨氮≤0.03 mg/L。
1.2 样本采集与处理
8周末,养殖试验结束,禁饲24 h后称重,记录每个重复存活尾数,分别用于计算各处理组的增重率(WGR)、特定生长率(SGR)和成活率(SR)。分别在每个玻璃钢桶中随机取3尾鱼,测量体长和体质量后置于-20 ℃冰箱,备测全鱼常规养分和Fe、铜(Cu)、锰(Mn)和锌(Zn)含量;另取4尾鱼分离肝脏并称重后迅速放于液氮中,后移至-80 ℃保存备测抗氧化酶活性,同时剥离脊椎骨保存于-20 ℃,备测Fe、Cu、Mn和Zn含量;每重复取2尾鱼分离肠道,并标记前、中和后肠固定于10%甲醛溶液中,用于肠道石蜡切片的制作。
1.3 检测方法
1.3.1 肝脏抗氧化酶活性 测定肝脏中丙二醛(MDA)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)和碱性磷酸酶(AKP)的活性(南京建成生物工程研究所),样本前处理和操作过程参考说明书。
1.3.2 矿物元素含量 准确称量养殖水体、实验饲料、全鱼和脊椎骨样品(0.10~0.15 g)于消解罐中,滴加8 mL默克硝酸和2 mL双氧水后放入微波消解仪(CEM MARS)消解。赶酸后转入比色管中用超纯水定容。等离子体质谱仪(ICP 6000)测定样品中Cu、Fe、Mn和Zn四种元素的含量[15]。
1.3.3 肠道石蜡切片 将固定好的珍珠龙胆石斑鱼前、中、后肠样本分别进行常规石蜡包埋,切片厚度为6 μm,苏木精-伊红(HE)染色,在全自动生物显微镜(DM600)下观察、拍照并测量肠道样本的皱襞高度(PH)、皱襞宽度(PW)和肌层厚度(MT),每张切片分别测定10个相应数据[15]。
1.4 计算方法[15]
成活率(Survival rate, SR, %)=100×Nt/N0;
饲料系数(Feed coefficient rate, FCR)=Wf/(Wt-W0);
增重率(Weight gain rate, WGR, %)=100×(Wt-W0)/W0;
特定生长率(Special growth rate, SGR, %/d)=100×(lnWt-lnW0)/t;
脏体比(Viscerosomatic index, VSI, %)= 100×Wv/Wt;
肝体比(Hepatosomatic index, HSI, %)=100×WL/Wt;

式中:Nt为终末尾数;N0为初始尾数;Wt为终末体质量(g);W0为初始体质量(g);t为试验天数(d);Wf为摄入饲料干重(g);WL为肝脏质量(g);Wv为内脏团质量(g);Lt为终末体长(cm)。
1.5 数据分析[15]
实验数据以平均值±标准差(Mean±SD)表示,通过SPSS 20.0软件进行单因素分析,当处理间有显著差异(P<0.05)时,用 Duncan氏法进行多重比较检验。
2 结果分析
2.1 铁源对珍珠龙胆石斑鱼幼鱼生长性能和形态学指标的影响
3种铁源对珍珠龙胆石斑鱼SR、WGR和SGR均无显著影响(P>0.05);Fe-MHA组的FCR显著高于FeSO4组(P<0.05)。FeSO4组HIS和VSI显著高于2个添加氨基酸螯合态Fe源组(P<0.05),其中Fe-Gly(II)组的HSI和VSI显著高于Fe-MHA组(P<0.05)。Fe-Gly(II)组和Fe-MHA组的CF显著高于FeSO4组(P<0.05),Fe-MHA组CF显著高于Fe-Gly(II)组(P<0.05)(见表2)。

表2 铁源对珍珠龙胆石斑鱼幼鱼生长性能及体形态学指标的影响
2.2 铁源对珍珠龙胆石斑鱼幼鱼鱼体和脊椎骨矿物元素含量的影响
Fe-MHA组全鱼Fe和Zn含量显著高于FeSO4和Fe-Gly(II)组(P<0.05);FeSO4组全鱼Cu含量显著高于有机铁源组(P<0.05),且这两个有机铁源组间无显著差异(P>0.05);铁源对珍珠龙胆石斑鱼全鱼Mn含量没有显著性影响(P>0.05)(见表3)。

表3 铁源对珍珠龙胆石斑鱼幼鱼全鱼Fe、Zn、Cu和Mn含量的影响
FeSO4组幼鱼脊椎骨Cu含量显著高于其余2个Fe的氨基酸螯合物组(P<0.05);Fe-MHA组石斑鱼脊椎骨中Fe含量显著高于其他2组(P<0.05);Fe-Gly(II)组Mn含量显著低于FeSO4组和Fe-MHA组(P<0.05),且FeSO4组和Fe-MHA组这2组间无显著差异(P>0.05);Fe-MHA组Zn含量显著高于Fe-Gly(II)组和FeSO4组(P<0.05),而后2组间无显著差异(P>0.05)(见表4)。

表4 铁源对珍珠龙胆石斑鱼幼鱼脊椎骨Fe、Zn、Cu和Mn含量的影响
2.3 铁源对珍珠龙胆石斑鱼幼鱼肝脏抗氧化能力的影响
如表5所示,Fe-Gly(II)组和FeSO4组肝脏CAT活性无显著差异,但是,显著低于Fe-MHA组(P<0.05)。Fe-MHA组肝脏AKP活性显著低于Fe-Gly(II)组(P<0.05)。Fe-MHA组肝脏MDA含量显著低于其余2组(P<0.05)。Fe-Gly(II)和Fe-MHA组对肝脏T-SOD活性无显著影响(P>0.05),但是这2组的T-SOD活性显著高于FeSO4组(P<0.05)。

表5 三种铁源对珍珠龙胆石斑鱼幼鱼肝脏抗氧化酶活性的影响
2.4 铁源对珍珠龙胆石斑鱼幼鱼肠道结构的影响
如表6所示,Fe-MHA组石斑鱼3个肠段PH显著高于FeSO4组和Fe-Gly(II)组(P<0.05)。Fe-Gly(II)组和FeSO4组前、中、后肠PW均显著高于Fe-MHA组(P<0.05)。Fe-Gly(II)组前肠和后肠MT显著高于Fe-MHA组和FeSO4组(P<0.05);Fe-MHA组中肠MT显著高于Fe-Gly(II)组和FeSO4组(P<0.05)。肠道切片显示(见图1~3),有机铁源组石斑鱼中肠的杯状细胞数量显著多于无机FeSO4组。
表6 铁源对珍珠龙胆石斑鱼幼鱼肠道形态的影响

(绿色双向箭头:皱襞高度;黑色双向箭头:皱襞宽度;黄色双向箭头:肌层厚度。a: FeSO4组;b: Fe-Gly(II)组;c: Fe-MHA组,下同。Green two-way arrows: plica height; Black two-way arrow: plica width;Yellow two-way arrow: muscle thickness.a: FeSO4 group; b: Fe-Gly(group II); c: MHA-Fe group.The same below.)
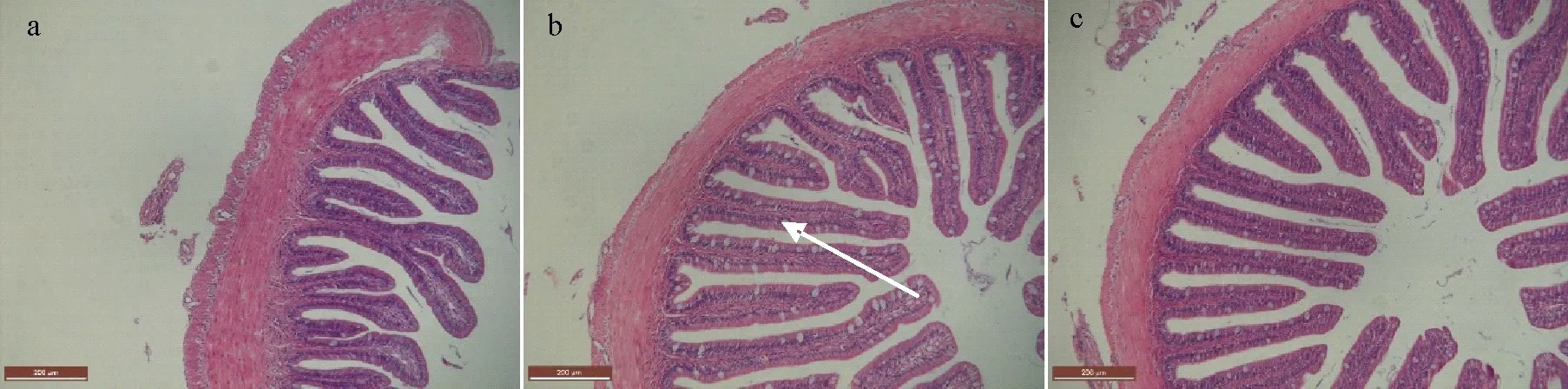
(白色箭头表示杯状细胞。White arrow represent goblet cells.)

图3 铁源对珍珠龙胆幼鱼后肠发育的影响(HE染色,10×)
3 讨论
3.1 三种铁源对珍珠龙胆石斑鱼幼鱼生长性能和形态学指标的影响
金属离子只有在肠道内与蛋白质或氨基酸结合形成络合物,才能通过富含阴离子的细胞膜,被机体吸收利用。并且,该络合物的形成需要动物体内辅酶的参与,在吸收进入血液后与某些蛋白结合被运输到所需组织才能发挥其功效[15]。金属离子在鱼的碱性中肠环境下溶解度较低,降低了消化吸收率,而矿物质的氨基酸螯合物可直接被吸收[10,16]。当微量元素与氨基酸以螯合物的形式进入机体后,则以胞饮的方式被吸收,这样不但减弱了矿物元素之间的竞争,提高了吸收效率,还改善了其他营养物质的吸收。
黄颡鱼(Pelteobagrusfulvidraco)摄食氨基酸螯合态铁后增重率、蛋白质效率以及饲料系数均优于七水合硫酸亚铁组[17],这与军曹鱼[18]和奥尼罗非鱼(Oreochromisaureus×O.niloticus)[19]的研究结果类似。添加Fe、Cu、Mn和Zn复合的氨基酸螯合物与其无机盐相比,可以改善青鱼(Mylopharyngodonpiceus)[20]和尼罗罗非鱼(Oreochromisspp)[21]的生长,提高非特异性免疫力,表明相比无机微量元素,鱼类能够更有效地利用矿物元素的氨基酸螯合物提高机体的生长性能。并且,氨基酸的分子量亦会影响微量元素的吸收。氨基酸螯合矿物盐Fe-MHA和Fe-Gly在动物体内的生物利用度较FeSO4高的原因可能是由于氨基酸的分子量和氨基酸的需要程度。甘氨酸的分子量在所有氨基酸中最小,而依据饲料原料的使用,蛋氨酸成为鱼类的第一限制性氨基酸。氨基酸分子量的大小有利于维持其与矿物元素螯合结构的稳定性,并且可以减少消化道内其他相关抑制因子的干扰,从而有利于微量元素的吸收[22]。
循环养殖的水体矿物质浓度会对鱼体组织的矿物质沉积产生一定影响[23],本实验会定期换水,并且通过定期采样抽查发现养殖用水体中的Fe元素含量较低,并且各重复玻璃钢桶中水体Fe含量无显著差异,对本实验中矿物元素有效利用不会造成显著影响。尽管3种铁源对石斑鱼的生长性能在统计学未产生显著影响,但是石斑鱼摄食含有Fe-MHA的饲料,对鱼体的形态学相关数据有显著改善,HIS和VSI豆显著低于无机组,CF显著高于无机组,表明Fe-MHA比FeSO4更能改善珍珠龙胆石斑鱼的生长。有研究表明,相比FeSO4,蛋氨酸螯合铁更有效地参与大鼠肝脏脂肪酸和类固醇的合成,上调电子呼吸链途径中电子传递复合体Ⅰ、细胞色素C氧化酶及ATP合成相关基因表达,下调氨基酸分解和尿素循环途径中的关键酶基因表达,表明蛋氨酸螯合铁有利于降低机体氨基酸分解产氨,促使能量更有效地参与动物的生长和合成代谢[24],更有效地促进机体的生长发育。
矿物元素的添加形式不同,会导致不同的吸收效率,因此也会影响矿物元素发挥其生理作用和在机体内的沉积效率。蛋氨酸螯合盐可有效提高加州鲈(Micropterussalmoides)机体各组织微量元素的含量[25]。本实验中,Fe-MHA组和Fe-Gly(II)组全鱼和脊椎骨中Fe和Zn含量显著高于FeSO4组,其中以Fe-MHA组最高,表明氨基酸鳌合铁Fe-MHA和Fe-Gly(II)比FeSO4更有利于珍珠龙胆石斑鱼对Fe和Zn的沉积。Cu作为造血反应的激活剂可催化Fe合成血红蛋白和生成红细胞、参与将Fe2+转化为Fe3+合成转铁蛋白和参与生成铜蓝蛋白[26]。本实验中FeSO4组全鱼和脊椎骨Cu含量显著高于Fe-Gly(II)组和Fe-MHA组,可能是由于Fe-MHA和Fe-Gly(II)更有利于Fe的吸收转运,加速了Cu的动员而降低了组织Cu的沉积。尽管各处理组全鱼Mn含量没有受到3种铁源的显著影响,但是从数据上可以看出,各组脊椎骨Mn的含量均为其全鱼Mn含量的2.5倍,提示脊椎骨可能是Mn元素沉积的主要场所。
3.2 三种铁源对珍珠龙胆石斑鱼幼鱼肝脏抗氧化酶活性的影响
Fe在动物机体内参与血红蛋白与肌红蛋白的合成、激活碳水化合物代谢过程的关键酶、直接参与CAT等的合成,是细胞抗氧化防御体系的重要组成部分[27]。Fe2+非常活跃,容易被氧化为Fe3+,而氨基酸鳌合铁由于其结构稳定,能更好地避免这种氧化反应[28]。相比无机铁,Fe-Gly(II)和Fe-MHA具有较低的氧化性,增强了机体的抗氧化能力。
与FeSO4相比,军曹鱼[4]、猪[6]和肉仔鸡[8]摄食含有蛋氨酸铁和甘氨酸螯合铁的饲料可提高血清CAT活性,本实验中相比于FeSO4和Fe-Gly,添加Fe-MHA显著提高了肝脏CAT活性。氨基酸螯合铁具有较高的生物活性也体现在其较强地清除自由基的能力方面[11]。除CAT外,体内自由基的动态变化及组织损伤情况亦可通过SOD的活性得到体现[21]。珍珠龙胆石斑鱼肝脏SOD的活性在其摄食氨基酸螯合铁Fe-Gly(II)或者Fe-MHA后得到显著改善。机体对氨基酸螯合铁吸收效率高,提高了血红蛋白、肌红蛋白以及细胞色素等物质的生物活性,有利于调节呼吸、氧化应激以及电子转移,进而提高了铁的利用率,同时,SOD的活性有赖于Cu、Mn和Zn的参与,本实验的结果亦表明氨基酸螯合Fe有利于机体对这几种元素的吸收利用,从而使石斑鱼肝脏SOD活性的增强。AKP活性表示吞噬细胞清除异物的能力,是巨噬细胞溶酶体的标志酶,同时与一些营养物质的消化吸收能力有关[29]。Fe-Gly(II)组珍珠龙胆石斑鱼肝脏AKP活性较高,表明氨基酸螯合铁有利于提高鱼体吞噬细胞清除外源有害物质的能力。本实验中石斑鱼摄食Fe-MHA后肝脏MDA含量显著低于其余两组,更加印证了氨基酸Fe螯合物具有可以增强机体抗氧化酶活性和清除自由基的能力的生物活性。
此外,氨基酸鳌合铁改善细胞防御机制,促进机体对炎症的自然反应,提高机体免疫反应[30]的结果也可能是通过对肠道粘膜发育及物理屏障的改善产生的影响。
3.3 三种铁源对珍珠龙胆石斑鱼幼鱼肠道形态的影响

珍珠龙胆石斑鱼幼鱼摄食Fe-MHA后显著提高了前、中、后肠的PH,肠道褶皱数量增多,皱襞相对完整,排列整齐,提示饲料中添加Fe-MHA有利于提高石斑鱼肠道吸收营养物质的表面积。由平滑肌组成肠道的肌肉层,其节律性舒缩是肠道运动的主要动力,环肌通过波状收缩实现肠蠕动,推动食糜向后移动[36],MT的增加能够提高肠道运动的能力。珍珠龙胆石斑鱼摄食Fe-Gly(II)或Fe-MHA可一定程度地改善肠道MT,促进肠道蠕动,有利于营养物质的吸收。杯状细胞主要分泌黏液和消化酶,发挥着润滑、免疫和帮助消化的作用,因此,杯状细胞的数量可间接反映鱼类的消化能力[37]。通过HE染色的切片中可看出,石斑鱼摄食Fe-MHA或Fe-Gly(II)后,中肠皱襞杯状细胞的数量明显多于FeSO4组,表明有机螯合Fe可通过增加杯状细胞的数量来减少肠道黏膜损伤维护肠道屏障功能,具有改善免疫和提高消化能力的作用。
4 结语
相比于无机态的FeSO4,珍珠龙胆石斑鱼幼鱼饲料中添加Fe-Gly(II)或Fe-MHA,对鱼体形态学和微量元素的沉积产生有益的影响,增加了前肠和中肠的肌层厚度,提高了后肠的皱襞高度,有利于维护养殖期鱼类肠道健康。并且,Fe-MHA提高了肝脏的过氧化氢酶和总超氧化物歧化酶活性,降低了丙二醛含量,使幼鱼的抗氧化能力得到提升,有利于石斑鱼健康生长。推荐珍珠龙胆石斑鱼幼鱼饲料中添加的铁源形式为Fe-MHA。
