毒素-抗毒素系统yafON 缺失对ExPEC 生物被膜形成的影响
2020-10-16王晨燕车勇良栗绍文周伦江
侯 博 王晨燕 车勇良 栗绍文 周伦江*
(1.福建省农业科学院畜牧兽医研究所 福州 350013;2.华中农业大学动物医学院 武汉 430070)
细菌生物被膜(Bacterial biofilm)是细菌粘附聚集到有生命或无生命固体表面的一种群体性行为,是细菌适应应激环境(不利环境)而采取的一种生存策略,具有极强的耐药性及免疫逃逸性[1],是造成临床慢性感染和持续感染的主要原因之一。 细菌生物被膜不仅造成抗菌药物在兽医临床上的治疗失败[2],也影响食品加工过程中的消毒效果,通过食物链进入人体,对人类健康同样有着极大的威胁[3]。 生物被膜存在于农产品加工业、乳品加工业、鱼品加工业、禽和肉品加工业以及即食食品加工业[4],存在于食品工业中的生物被膜细菌主要有大肠埃希菌、李斯特菌、空肠弯曲菌、金黄色葡萄球菌等[5],可以存在于所有类型食品加工装置塑料、玻璃、金属、木头、食品产品的表面[6-8],成为影响公共卫生安全的重要隐患。因此,控制细菌生物被膜的形成在兽医、医学、食品等领域均具有极为重要的意义。
毒素-抗毒素系统(Toxin-antitoxin,T-A)最早是在1983 年被发现,存在于低拷贝质粒上[9],目前发现T-A 系统普遍存在于细菌和古细菌的染色体上,包括人类和动物的致病菌, 每个系统都有2 个共表达基因组成,其中一个基因编码毒素蛋白,另一个编码抗毒素;毒素通常比较稳定,抑制细菌生长;而抗毒素不稳定, 则可以通过中和毒素, 对细菌起保护作用。 II 型T-A 系统编码的抗毒素不仅可以通过直接的蛋白-蛋白相互作用中和相应的毒素, 并且可以通过与启动子区域的操纵元件结合调控T-A 操纵子转录。 关于T-A 系统对生物被膜形成影响的研究较少, 报道与生物被膜形成具有直接作用的第一个T-A 系统为MqsRA[10-11],并且对其调控生物被膜形成的分子机制研究较为深入。 本研究通过缺失肠外致病性大肠埃希菌的毒素-抗毒素系统yafON 基因, 研究yafON 毒素-抗毒素系统缺失对ExPEC 生物被膜形成能力的影响, 为解析毒素-抗毒素系统yafON 调控生物被膜形成机制奠定基础。
1 材料与方法
1.1 菌株和质粒 ExPEC 野生菌株PPECC42、大肠杆菌χ7213、 自杀性载体pRE112 均由华中农业大学栗绍文副教授惠赠。 大肠杆菌DH5α 购自北京庄盟生物科技有限公司。
1.2 主要试剂 试验所需限制性内切酶、高保真聚合酶Premix Prime STAR○RHS(Loading dye mix)、T4-DNA 连接酶购自大连宝生物有限公司(TakaRa);PCR MIX 和各种DNA marker 购自东盛生物有限公司; 细菌培养用培养基和蔗糖购自OXOID 公司;试验所用抗生素购自Amresco 公司;2,6-二氨基庚二酸(DAP)购自Sigma 公司;核酸回收试剂盒购自天根生化 (北京) 有限公司;96 孔培养板购自NUNC公司。
1.3 引物的设计 根据ExPEC PPECC42 菌株基因组序列信息和重叠PCR (Over-Lapping PCR) 的原理,利用软件Primer Premier 5.0 设计靶基因缺失的上下游引物以及鉴定引物,其序列见表1,由南京金斯瑞生物有限公司合成。
1.4 缺失菌株的构建及鉴定
1.4.1 靶基因上下游同源臂的重叠PCR 扩增 根据重叠PCR(overlapping-PCR)的原理和方法,使用P1/P2,P3/P4 两对引物分别对靶基因yafON 的上游片段和下游片段进行扩增,扩增反应体系如下:Premix Prime STAHS 12.5 μL、P1/P2 或P3/P4 各0.5 μL、 模板1 μL、ddH2O 10.5 μL; 扩增反应条件为:98 ℃、10 s,56 ℃、5 s,72 ℃、1 min,共计30 个循环。将上下游片段的扩增产物分别切胶回收,将回收的产物作为模板,利用重叠PCR 对上下游同源臂进行重叠PCR。以引物P1/P4 为模板进行扩增,扩增体系如下:Premix Prime STARHS 12.5 μL、上游片段回收产物1 μL、 下游片段回收产物1 μL、ddH2O 10.5 μL,先扩增5 个循环后,再加入引物P1/P4 各1 μL 进行扩增;扩增反应条件为:98 ℃、10 s,56 ℃、5 s,72 ℃、1 min40 s,共计5/28 个循环。

表1 yafON 双缺失株构建所用引物序列和PCR 产物大小
1.4.2 同源重组供体菌的构建 将上述over-lapping PCR 产物进行切胶回收,将回收产物和自杀性载体pRE112 进行Xba I、Sac I 双酶切,对酶切产物切胶回收后与载体片段连接, 转化感受态细胞χ7213,在含氯霉素(终浓度25 μg/mL)的L-A 平板(含1‰DAP)上挑取单菌落培养后提取质粒,酶切鉴定,将鉴定正确的测序验证。
1.4.3 靶基因缺失株的筛选与鉴定 根据参考文献[12]中的方法,将构建正确的阳性克隆χ7213 供体菌和野生亲本菌株进行接合转移。 将筛选到的氯霉素抗性、蔗糖敏感的接合子接种在无NaCl、无抗性的LB 液体中,37 ℃振荡培养17~18 h 后,筛选氯霉素敏感、蔗糖抗性的菌落,使用引物P5/P6 进行PCR鉴定,PCR 反应体系:PCR MIX 12.5 μL、P5/P6 各0.5 μL、模板1.5 μL、ddH2O 10 μL ;PCR 反应条件:95 ℃、3 min,95 ℃、30 s,56 ℃、30 s,72 ℃、1 min,30 个循环,72 ℃、10 min。
1.5 ExPEC 野生菌株与yafON 基因缺失株的生物被膜形成能力比较 根据参考文献[13]中的方法修改进行, 将野生菌株、yafON 基因缺失株分别接种LB 培养基,37 ℃振荡培养过夜,将过夜培养物分别用新鲜M9 培养基进行1:100 稀释,稀释好的菌液分别加入96 孔细胞培养板中,每孔100 μL,每株细菌分别设8 个重复。 以无菌培养基作空白对照,28 ℃或37 ℃静置培养24 h 或5 d,将过夜培养物轻轻吸出,用灭菌蒸馏水洗涤微孔三次,晾干,96 孔板中,每孔加1%结晶紫125 μL 染色15 min,用流水轻轻冲掉染液,轻甩晾干,再每孔加入33%乙酸150 μL,振荡溶解10 min,置于酶标仪下测定OD630值,运用统计学分析所得数据。
2 结 果
2.1 ExPEC yafON 基因缺失株的构建与鉴定 根据同源重组的原理和自杀性质粒pRE112 进行缺失株的构建。首先扩增yafON 基因的上下游片段,其大小分别为665 bp、690 bp,扩增结果见图1。 将扩增的上下游片段纯化后采用重叠PCR 的方法扩增同源重组所需基因缺失片段ΔyafON, 其大小为1 330 bp,扩增结果见图2。 将重叠PCR 产物的片段回收,与自杀性载体pRE112 同时酶切,纯化回收酶切产物,连接后转入χ7213,挑单菌落扩大培养抽提质粒进行酶切鉴定, 将酶切条带位置正确的质粒再经过测序证实序列缺失正确。
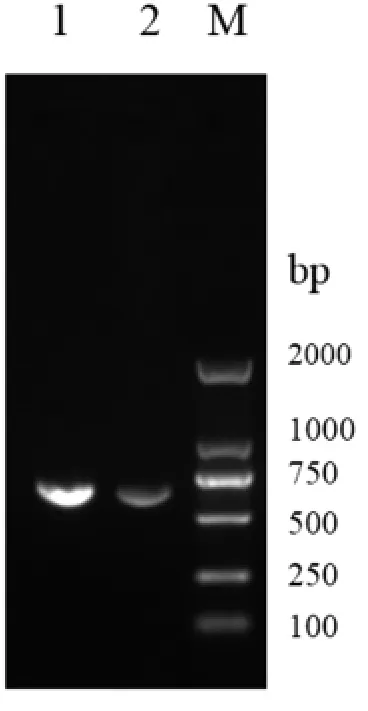
图1 yafON 基因上下游片段扩增PCR 产物电泳结果
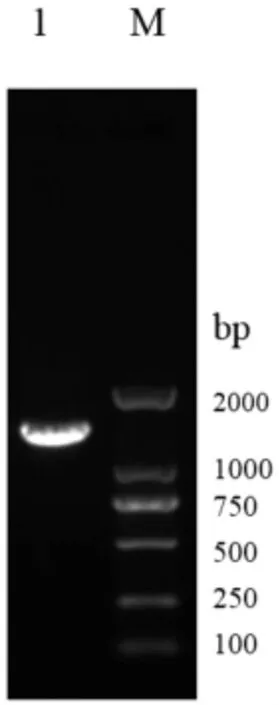
图2 yafON 基因上下游片段重叠PCR 产物电泳结果
接合转移后,经两次筛选,将表型正确的单菌落接种于LB 培养基,扩大培养后,采用引物P5/P6 进行PCR 鉴定,PCR 产物经电泳鉴定(见图3),结果显示yafON 基因缺失菌株即ExPEC PPECC42-ΔyafON 菌株的PCR 扩增产物大小为277 bp, 对照野生菌株ExPEC PPECC42 的PCR 扩增产物大小为817 bp,与预期结果一致,初步证实yafON 基因缺失菌株构建成功,并且将PCR 产物片段回收纯化后测序,证实缺失序列正确。

图3 鉴定引物P5/P6 扩增缺失菌株及野生菌株的yafON 基因产物电泳结果
2.2 ExPEC yafON 基因缺失对生物被膜形成能力的影响 为探索yafON 在ExPEC 生物被膜形成中的作用, 采用结晶紫染色法对ExPEC 野生菌株PPECC42 和 yafON 基因缺失菌株ExPEC PPECC42-ΔyafON 的生物被膜形成能力进行测定和比较。结果显示在M9 培养基28 ℃条件下培养5 d,野生菌株ExPEC PPECC42 的生物被膜形成能力非常强,为强生物被膜形成菌株,而yafON 基因缺失菌株ExPEC PPECC42-ΔyafON 的生物被膜形成能力极显著下降(P<0.01),结果见图4。

图4 缺失菌株与野生菌株生物被膜形成情况
3 分析与讨论
肠外致病性大肠埃希菌(Extraintestinal Pathogenic E. coli,ExPEC)是一种重要的病原菌,不仅可以引起人、宠物以及食用动物的肠外感染,比如新生儿脑膜炎、败血症、肺炎和乳房炎[14-16],还是一种重要的食源菌,可通过污染的饮水、食品引起食源性疾病暴发流行[17-18];ExPEC 菌株目前在不同的国家广泛地从零售鸡肉、牛肉、猪肉、餐馆、即食食品(包括肉类、水果和蔬菜)中分离得到[19-20],因此,推测肉制品可能是人ExPEC 感染的最重要来源。本研究对猪源ExPEC 的yafON 毒素-抗毒素基因缺失后,与野生株相比,其生物被膜形成能力显著下降,证实yafON 毒素-抗毒素系统参与了ExPEC 生物被膜形成过程, 在生物被膜形成过程中发挥了主要作用, 但yafON 在生物被膜形成中的具体作用还不清楚,其发挥作用的分子机制尚待研究。 毒素-抗毒素系统(Toxin-antitoxin,T-A)广泛存在于细菌基因组中,在细菌的生理活动中发挥着重要作用:维持基因组的稳定性、促进抗生素压力下持留细胞的形成、增强噬菌体感染的耐受性、调控细菌细胞程序性死亡、在细菌致病中发挥作用, 在本研究中发现还参与了细菌生物被膜的形成。 因此,T-A 系统成为多重耐药病原菌致病机理和防控技术研究的新靶标, 可以作为控制ExPEC 乃至多重耐药细菌感染和生物被膜形成新的潜在的药物靶标。
