T-2毒素的危害及脱毒研究进展
2020-10-15王文杰
宋 佳,范 寰,闫 雪,王文杰,赵 晨✉
(1. 国家粮食和物资储备局科学研究院,北京 100037;2. 天津市畜牧兽医研究所,天津 300381;3. 新希望六和股份有限公司/农业农村部饲料及畜禽产品质量安全控制重点实验室,四川 成都 610023)
T-2毒素是单端孢霉烯族中常见的 A型真菌毒素之一,具有强毒性,在自然界中分布广泛,常见于被镰刀菌污染的田间作物或库存谷物上,是粮食行业和畜牧业防治的重点之一。1968年T-2毒素晶体被Bamburg等人首次分离提纯并确定其化学结构[1](图 1),T-2毒素逐渐走进人们的视野。T-2毒素化学名为 4β-15-二乙酰氧基-3α-羟基-8α-(3-甲基丁酰氧)-12,13-环氧单端孢霉-9-烯-3醇,分子式C24H34O9,是一种四环的倍半萜烯化合物,其中C-9、C-10位的双键和C-12、C-13位的环氧环是 T-2毒素致毒的化学结构基础[2]。T-2毒素的性质很稳定,有强耐热性和紫外耐受性,在常温下放置6~7年,毒性不会降低,在高温 200~210 ℃时处理约 40 min或浸泡在NaClO-NaOH溶液中至少4 h才可以灭活[3]。因此,在食物生产和加工过程中,对 T-2毒素的防范尤为重要。
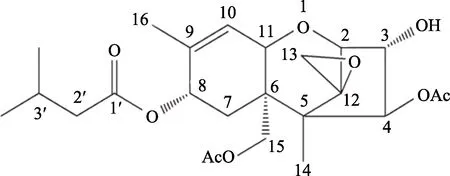
图1 T-2毒素晶体的化学结构
1 危害及其致毒机理
自上世纪中期在美国发现可以使饲料玉米感染从而导致动物出现中毒症状的名为 T-2的镰刀菌菌株,并从该菌株中分离纯化得到 T-2毒素晶体[4],T-2毒素便引起世界各地的广泛关注。T-2毒素因其毒性强、发病快,1973年在由联合国粮食及农业组织(FAO)和世界卫生组织(WHO)召开的联席会议上,将这类毒素同黄曲霉毒素一样列为天然存在的最危险的食品污染源之一[5]。2011年,欧洲食品安全局(EFSA)再次指出谷物及谷物加工食品是 T-2毒素和其代谢衍生物HT-2毒素的主要污染对象,并规定了T-2毒素及HT-2毒素的人类最小摄入量为100 ng/kg.b.w[6]。国际卫生和粮农组织(JEFCA)认为,T-2毒素及其代谢衍生物HT-2的毒性作用无法被短时间消除,因此规定,最大可耐受日摄入量为60 ng/kg.b.w[7]。由于 T-2毒素的高稳定性和对人畜的强毒性,一些研究也将其纳入生物武器的阵列[8]。
1.1 动物中毒症状
T-2毒素除了会导致动物产生恶心、头晕、消化道灼热、心跳过速等食物中毒的症状以外[9],还会对动物血液系统、免疫系统、神经系统、生殖系统、骨骼系统、肝脏等部位造成严重的损伤。如:T-2毒素会让大鼠患上心肌病、产生大脑损伤等[10-11]。投喂小鼠含有 T-2毒素的食物,无论雌雄,小鼠的生殖器官都会发生萎缩,精子质量下降,排卵被抑制,生殖系统相关细胞也会出现不同程度的损伤[12]。猫在感染T-2毒素的一段时间内会逐渐出现全身性疲倦、厌食呕吐、后腿失调、白细胞减少、显现与免疫系统疾病有关的淀粉样变等明显的中毒迹象[13]。4.97 mg/kg剂量的 T-2毒素就可以杀死 50%与人类饮食密不可分的肉鸡,该剂量不到黄曲霉毒素LD50的75%[14]。水生动物也同样难逃T-2毒素的毒害,饮食中的T-2毒素会使虾肠绒毛消失,粘膜变性坏死从而抑制虾的生长[15]。T-2毒素还会降低中华绒螯蟹的生长性能,恶化健康状况并引起肝胰腺功能障碍[16]。而且 T-2毒素和其代谢衍生物会残留在动物的可食性组织中[17],人一旦食用这些被T-2毒素感染过的动物,甚至有调查表明只是喝过几百毫升被霉菌感染过的水果榨成的果汁[18],就会产生中毒现象,中毒量大或治疗不及时会致人死亡[19]。除上述所述的急性毒性症状,ATA病、大骨节病等疾病也被证明与长期低剂量摄入T-2毒素存在直接关系[14,20]。
1.2 T-2毒素致毒机理
结合近年来关于 T-2毒素的文献报道,发现T-2毒素的致毒机理主要有以下方面:①抑制蛋白质的合成。这会导致细胞膜的结构、体内酶系等一系列的生命状态发生改变。②细胞毒性。主要包括:氧化应激反应,DNA损伤,细胞周期阻滞,线粒体功能障碍等。③诱导细胞凋亡和程序性细胞死亡[21]。值得注意的是,上述致毒机理在动物体内并不完全是单一或并列的关系,比如,T-2毒素会先诱导人肝脏 7702细胞氧化应激从而导致线粒体分裂融合失衡,最终激活细胞凋亡引起肝脏损伤[22]。所以,T-2毒素的致毒机理其实是复杂且多样的。近年来,随着分子生物学的发展,T-2毒素的致毒机理所涉及的更为细致的信号通路也被越来越多的曝光。MAPK[23]、caspase-3[24]、IRE1/XBP1[25]、DRP-1[26]、AQP4[27]等众多信号通路都被证明会参与T-2毒素的致毒过程。
T-2毒素对粮食谷物污染的广泛性和对人畜巨大的毒性,使 T-2毒素脱毒成为一个迫切的研究问题。
2 T-2毒素脱毒
T-2毒素常见的脱毒方式有三种,即物理脱毒(高温、吸附、辐照)、化学脱毒(碱化、氧化、降解)和生物脱毒(吸附、降解)。
2.1 物理脱毒
T-2毒素性质稳定,121 ℃持续1~2 h其毒性也不会发生改变,升温至210 ℃处理30~40 min后T-2毒素的毒性结构才发生改变[28]。吸附法是与高温脱毒相比更为常用的物理脱毒方法,其主要机理是吸附剂与T-2毒结合形成无毒的复合体。常见的T-2毒素吸附剂有蒙脱石、沸石、硅藻土、活性炭、滑石粉等[29],这些吸附剂对饲料及谷物中的 T-2毒素都有较高的脱除效率,但特异性较低,不能完全清除 T-2毒素。辐照脱毒也是物理脱毒常见方式之一,是指利用紫外线、γ射线、X射线等电离辐射射线,破坏毒素的化学结构,同时辐射对有害真菌的生长和T-2毒素的产生都有明显的抑制作用。但目前关于辐射脱毒的研究仍处于初级阶段,有待深入研究完善。
2.2 化学脱毒
T-2毒素在碱性条件下,结构会发生化,5%~8%的NaOH可以将85.5%~90.7%的T-2毒素结构破坏,(NH4)2CO3可除去 T-2毒素二分之一的毒性[30],NaHCO3、NaClO也具有脱毒效果[31]。许多氧化试剂也可以和 T-2毒素的官能团反应,如臭氧会与T-2毒素的C-9、C-10位之间的双键作用,致使其毒性下降[32]。但上述化学法(碱法、氧化)处理后,会使食品、饲料本身的营养物质遭到不同程度的破坏,所以近年来通过化学降解法实现 T-2毒素脱毒的研究越来越多。桦树酸(BA)可以通过调节小鼠JAK2/STAT3信号通路来减轻T-2-毒素诱导的睾丸氧化损伤[33],大蒜衍生物PTS也可以对T-2毒素进行降解,使其毒性下降[34]。降解法解决了食品饲料中营养物质被破坏的问题,但化学降解后是否会带来其它影响还有待进一步研究。
2.3 生物脱毒
生物法脱毒具有特异性好、污染小等优点,是近年来单端孢霉烯族毒素研究的热点之一。生物脱毒主要分为两类:微生物脱毒和生物酶解脱毒。微生物脱毒是利用微生物对毒素的吸附能力或代谢为其他衍生物的方式,实现毒素的脱除;生物酶解脱毒是指生物代谢产生的酶与毒素作用,使毒素的结构发生改变生成低毒或无毒衍生物。
2.3.1 T-2毒素代谢衍生物
T-2毒素代谢衍生物种类较多,目前已经鉴定结构的就有二十多种,其中常见的代谢衍生物有水解产物 HT-2(C-4位水解)、neosolaniol(C-8位水解,简称NEO)、T-2 Triol(C-4位、C-15位水解)、T-2 tetraol(C-4位、C-8位、C-15位水解)、羟基化产物3-OH-T-2(C-3位羟基化)等,这些代谢衍生物的毒性与 T-2毒素相比都有不同程度的降低[35](图2,表1)。部分代谢衍生物在特定条件下,环氧环结构被打开,生成几乎无毒的脱环氧基产物 deepoxy HT-2、deepoxy T-2triol、deepoxy T-2 tetraol等[36](图3,表 2)。除这些常见的代谢衍生物,较 T-2毒素毒性降 低的代谢衍生物还有 4-deacetylneosolaniol、3-acetyl-HT-2等[37]。

图2 T-2毒素及其代谢衍生物化学结构
2.3.2 微生物脱毒
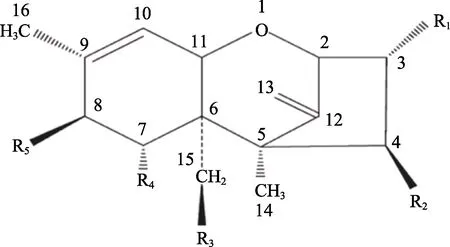
图3 T-2毒素脱环氧基代谢衍生物化学结构

表1 T-2毒素及其代谢物化学式

表2 T-2毒素脱环氧基代谢物化学式
土壤中丰富的菌群为 T-2毒素的降解提供了非常多的微生物来源。Ueno等通过用T-2毒素作为唯一碳源的培养基,证实了土壤中短小杆菌属(Curtobacterium sp.)114-2菌株可以将T-2毒素生物转化成多种代谢产物,如HT-2,NEO,T-2 Triol[38]。Beeton等从 20个地理来源的土壤和水域样本中分离出17个细菌群落,其中芽生杆菌属菌(Blastobacter natatorius)在5天内将T-2毒素转换成T-2triol,节杆属菌(Atypical Arthrobacter sp.)可以继续将T-2triol变成T-2 tetraol[39]。
动物消化系统中的丰富菌群也被多次证明可以将T-2毒素及其代谢衍生物脱环氧,进而将T-2毒素代谢为毒性更低的脱环氧基代谢衍生物。Swanson发现在大鼠的肠道微生物作用下 T-2毒素的代谢产物T-2 tetraol和3-OH-T-2可以改变这些物质中的环氧环结构,生成deepoxy T-2 tetraol和deepoxy 3-OH-T-2[40]。此后,百奥明公司基于从瘤胃中分离的细菌菌株BBSH 797,成功开发了微生物饲料脱毒制剂,也是目前唯一一株被应用为批量生产脱毒制剂的菌株[41]。2017年,华南农业大学邓诣群教授研究团队,首次分离鉴定出一株人肠道厌氧细菌,命名为Eggerthella sp.D II-9,它也被证明可代谢T-2triol、T-2 tetraol和HT-2为脱环氧环结构的产物[42]。从瘤胃中还分离出三株菌株,溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)StrainCE51、解脂厌氧弧菌(Anaerovibrio lipolytica)、反刍月形单胞菌(Selenomonas ruminantium),也被发现可以降解 T-2毒素,但未检测到 T-2毒素的脱环氧基产物[31]。

表3 生物脱毒微生物和酶
2.3.3 生物酶解脱毒
肝脏内酶系丰富,为降解 T-2毒素提供了多种生物酶。Johnsen等通过实验发现,在大鼠肝微粒体中,pH=5.4的羧酸酯酶可以将T-2毒素代谢为 HT-2[43]。Lin等采用化学抑制法发现当 CYP酶抑制剂和羧酸酯酶抑制剂同时存在人肝微粒体中,只有3%的T-2毒素会发生代谢,同时证实在人肝微粒体中羧酸酯酶降解 T-2毒素产生的主要代谢物为HT-2,通过CYP3A4酶降解产生的主要代谢物为 3-OH-T-2[44]。除 CYP3A4酶外,CYP1A5、CYP3A37、CYP3A22、CYP3A29、CYP3A46等多个细胞色素酶家族成员也在动物肝细胞中被发现可以降解T-2毒素[45]。在猪、鸡、小鼠等动物肝脏细胞内,T-2毒素还可以生成NEO、T-2triol、T-2 tetraol、4-deacetylneosolaniol等多种产物[46],虽然起到降解T-2毒素效果的物质未得到鉴定,但科学家推测这与肝脏中丰富的酶系存在必然联系。
除酶系丰富的肝脏,人体白细胞中将 T-2毒素水解成HT-2毒素的酶和红细胞中将T-2毒素水解成 NEO的酶均被特异性抑制剂鉴定为羧酸酯酶[47]。不仅仅在动物中,植物玉米中提纯得到的脂酶CXEs也被发现会在T-2的C-4位置选择性水解得到HT-2[48]。
3 展望
T-2毒素的污染造成的巨大经济损失的同时严重危害人类健康,如何有效地解决 T-2毒素污染是科研工作者应思考的问题。生物脱毒无疑是众多脱毒方法中最有前景的。脱毒工艺的研制将有效促进粮食、畜牧行业产业链的延伸和健康发展。然而,近年来关于 T-2毒素的酶及酶制剂的研究却并不多,因此,挖掘高效降解酶、丰富降解菌株,开发高效降解 T-2毒素的脱毒酶制剂及微生态制剂是核心任务。
