褐藻胶裂解酶的结构及催化机制研究进展
2020-10-15宁利敏朱本伟
李 谦,胡 富,宁利敏,朱本伟,倪 芳,姚 忠
(1.南京工业大学 生物与制药工程学院,江苏 南京 211800;2.南京工业大学 食品与轻工学院,江苏 南京 211800;3.南京中医药大学 医学与生命科学学院,江苏 南京 210023)
褐藻胶主要是由褐藻以及细菌产生的一种酸性多糖,是褐藻门植物如海带(Saccharinajaponica)、裙带菜(Undariapinnatifida)等细胞壁的主要成分[1]。褐藻胶主要由两个单体组成,β-D-甘露糖醛酸(M)以及它的C5差向异构体,α-L-古罗糖醛酸(G)。各个单体之间通过1,4-糖苷键相连,可以形成均聚甘露糖醛酸片段(polyM)、均聚古罗糖醛酸片段(polyG)以及两个单体交替连接形成杂合片段(polyMG)[2]。褐藻胶具有多种生物活性,广泛应用于食品、医药等行业,但是由于其具有分子量大、水溶性差及生物利用度低的缺点,极大地限制了其在生物医药领域的应用[3]。可以采用酶解的方法将其降解为褐藻胶寡糖,褐藻胶寡糖保持了多糖所具有的抗肿瘤、促进生长、调节免疫等功效,更是由于水溶性好和生物利用度高,受到了国内外研究者的关注[4]。
褐藻胶裂解酶属于多糖裂解酶家族,通过β消除来降解褐藻胶。褐藻胶裂解酶的来源主要有①海洋细菌、土壤细菌、噬菌体以及真菌等微生物;②海洋藻类;③海洋棘皮动物以及软体动物[5]。目前对褐藻胶裂解酶的分类方法大致有以下几种方式:根据酶的作用方式来分可以分为内切型和外切型的酶[6-7];根据氨基酸序列来分,褐藻胶裂解酶分属到7个多糖裂解酶家族(polysaccharide lyase family),即PL5、PL6、PL7、PL14、PL15、PL17,PL18;根据底物特异性来分,可分为polyM特异性裂解酶、polyG特异性裂解酶和可降解polyM和polyG的双功能裂解酶[5]。从结构上来看,褐藻胶裂解酶主要可以分为3类:①β果冻卷,PL7、PL14,PL18家族的酶多为这种结构;②(α/α)n桶状结构,PL5、PL15、PL17家族的酶多为这种结构;③β螺旋,PL6家族的酶多为这种结构[8]。
褐藻胶裂解酶通过β消除的方式降解褐藻胶,其具体的催化机制可以分为组氨酸(Tyr)/Tyrβ消除、金属离子辅助β消除。本文中,笔者主要综述目前褐藻胶裂解酶的结构分类以及催化机制的研究进展。
1 褐藻胶裂解酶的结构
1.1 β果冻卷(β jelly roll)
β果冻卷结构中主要含有两条反向平行的β折叠片,如图1所示,内凹片段SA(Sheet A)和外凹片段SB(Sheet B),这两条β折叠片从中间弯曲近90度并且由多条环所连接,从而使得整个结构呈球形。SA片段形成的裂缝中含催化活性位点,褐藻胶通过裂缝进入其中,与活性位点的氨基酸残基相互作用,由此可推断SA片段中保守的氨基酸残基对这一类酶的催化机制有着十分重要的影响。β果冻卷是褐藻胶裂解酶中最常见的折叠方式。目前,在已经解析晶体结构的褐藻胶裂解酶中,有13种褐藻胶裂解酶采用β果冻卷折叠,其中有9种来自PL7家族,2种来自PL14家族,2种来自PL18家族,如表1所示。
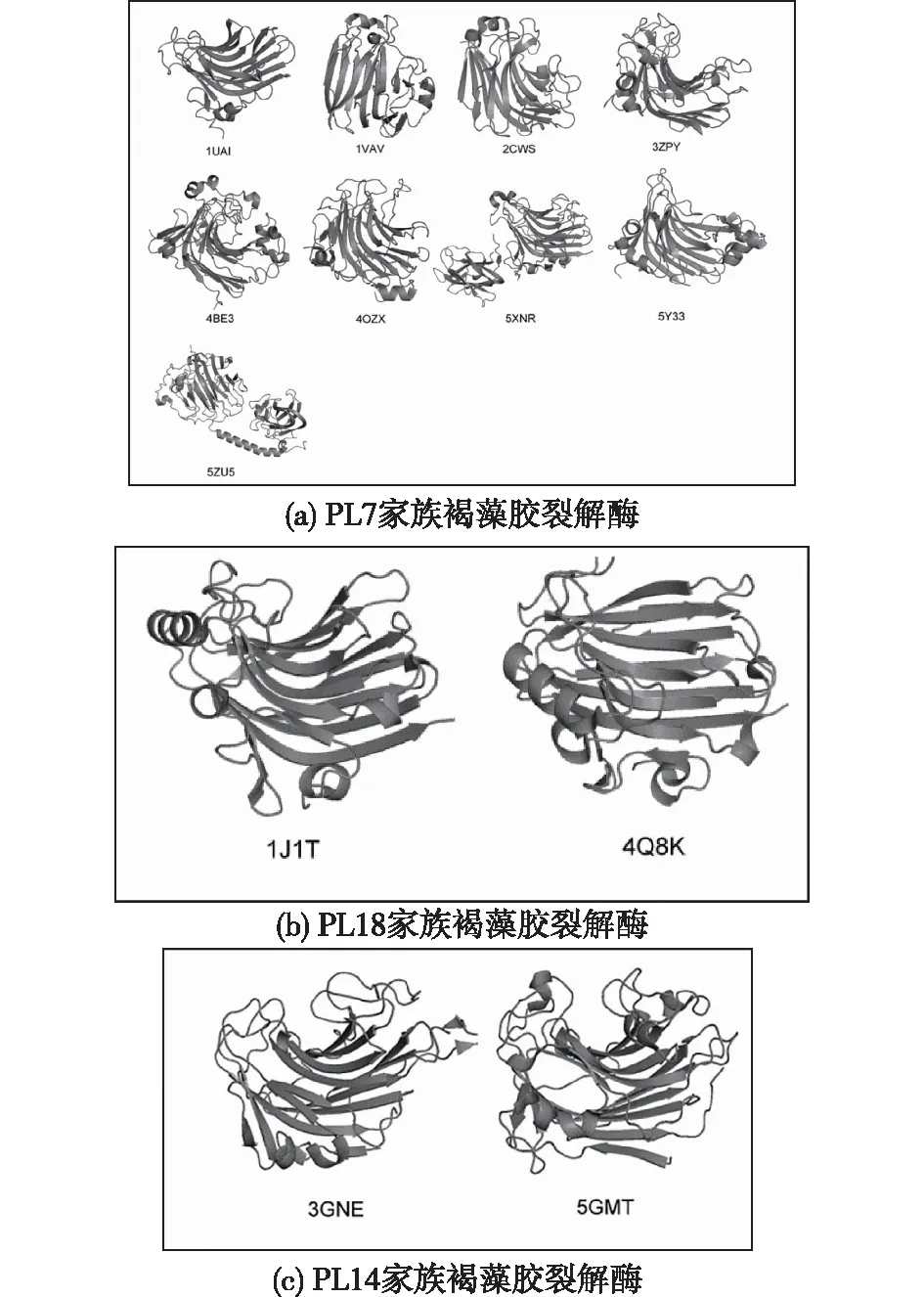
图1 具有β果冻卷结构的褐藻胶裂解酶的三维结构
PL7家族的褐藻胶裂解酶多采用β果冻卷的结构(图1(a)),目前已经表征的10种褐藻胶裂解酶中有9种来自其中,包括由PseudomonasaeruginosaPAO1产生的PA1167[9]、Klebsiellapneumoniae产生的AlyA、Corynebacteriumsp.ALY-1产生的alyPG[10]、Zobelliagalactanivorans产生的AlyA1和AlyA5[11],以及由Sphingomonassp.A1产生的A1-II[12],还有来源于Persicobactersp.CCB-QB2的AlyQ[13]、来源于Flavobacteriumsp.UMI-01的FlAlyA[14]及来源于VibriosplendidusOU02的AlyB[15]。
PA1167(PDB:1VAV)是该家族最早被表征的采用β果冻卷结构的酶,它由3条短的α螺旋和两条反向平行的β折叠片构成。它的SA片段由8条β链、SB片段由7条β链构成。该家族的A1-II’(PDB:2CWS)是目前研究较为透彻的酶,它包含2个反向平行的β折叠片和4个小α螺旋结构。其中9条β链组成SA,7条β链组成SB片段。该酶的活性中心由Arg146、Gln189、His191和Tyr2844个氨基酸残基组成,作为一种内切型的酶,该酶的活性中心呈敞开状。通过结构解析,多数催化位点均处于SA上(如SA3、SA4和SA5),其中位于SA3上的Arg59、Glu61和Arg63,与位于SA5上的Gln102、His104以及SA4上的Tyr193、Lys195、Gly197、Tyr199和Gln201均处于酶分子的表面,构成了一个活性裂隙,在催化反应中起着重要的作用。同时,沿着折叠片结构分布的一些高度保守的位点如Phe34、Ser60、Leu62、Phe194、Ala196和Leu218,这些处于催化活性中心周围的氨基酸残基与周围的同源性残基如Trp7、Ile11、Tyr29、Ile89、Ile103和Phe215共同围成一个疏水性的区域,对于维持酶的稳定性具有重要作用。对于SB来说,其具体作用尚未被阐明,推测其具有维持酶的刚性结构等作用。
PL18家族的褐藻胶裂解酶相对于PL7家族的褐藻胶裂解酶来说,主要存在两点差异:一方面,大多数PL18家族的褐藻胶裂解酶的编码基因推测的序列中含有N端延伸,起到分子伴侣的作用,从而促进蛋白质的正确折叠。这段结构在蛋白质成熟之后,大多会被切除。另一方面,存在维持酶活的二价金属离子Ca2+远离酶的活性中心,不直接参与催化反应,但是对于维持酶活来说至关重要。2种晶体结构已经解析的的PL18家族的酶Aly272、Aly-SJ02均来自Pseudoalteromonas(图1(b));成熟的Aly-SJ02酶表现出典型的β果冻卷结构,类似于PL7中内切式褐藻胶裂解酶的活性位点结构,Aly-SJ02中含有3条相邻的β链,SA2、SA3、SA4形成两段敞开的催化沟槽[16]。
PL14家族是所有家族中唯一的一个既包含细菌来源又包含病毒和真菌来源的褐藻胶裂解酶。2种已经被表征的14家族褐藻胶裂解酶,是由小球藻病毒产生的vAL-1[17]和Aplysiakurodai产生的AkAly30[18]。vAL-1由N-末端细胞附着结构域和C末端催化结构域构成,目前仅解析了VAL-1的C端结构域,该结构域采取了β果冻卷的结构,对VAL-1进行截短,发现在pH 7.0的条件下产生二到六糖,在pH 10.0条件下优先产生二糖,这表明催化位点表面的电荷改变会影响底物的结合方式并且调节酶的内切、外切作用(图1(c))。
1.2 (α/α)n桶状结构(α/α barrel)
(α/α)桶状结构由3到7个反向平行的α螺旋构成,目前有4种采取(α/α)桶状结构的褐藻胶裂解酶被表征(图2),其中有2种来自PL5家族,1种来自PL15家族,1种来自PL17家族(表2)。从结构上来看,PL5家族的褐藻胶裂解酶,是仅含有催化结构域的单结构域蛋白,而PL15、PL17家族的褐藻胶裂解酶,除了催化结构域外还有其他结构域,因此他们属于多结构域蛋白,采用这种结构酶的催化中心由两层α螺旋组成,从而形成深隧道状结构,以容纳底物。

表2 具有桶状结构的褐藻胶裂解酶的特征
2种被表征的PL5家族的褐藻胶裂解酶,Sphingomonassp.产生的A1-III[19]和PseudomonasaeruginosaPAO1产生的PA3547[20]均是内切型并且是polyM特异性的褐藻胶裂解酶。A1-III由12个α螺旋构成,其中有6个内螺旋和5个外螺旋,形成有4个重复发卡结构的(α6/α5)桶状结构。褐藻胶进入隧道状裂缝,被α内螺旋所包围,从而与催化位点的残基相互作用。PA3547与A1-III相比来看,主要的差异存在于N端和C端结构域(图2(a))。
Agrobacteriumtumefaciens产生的Atu3025是唯一一个被表征的PL15家族的褐藻胶裂解酶(图2(b))。它是一种外切型的酶,它由N端小β折叠结构域、(α/α)n桶状结构域以及C端反相平行β折叠结构域共同组成。其中N端小β折叠结构域的功能尚未被表征,(α/α)n桶状结构域由15个α螺旋组成,其中有6个内螺旋,6个外螺旋组成桶状催化结构域,C端的β折叠结构域由18条β链组成,从而形成三层反向平行的β折叠三明治结构。与PL5家族的褐藻胶裂解酶相比较,Atu3025的活性位点位于(α/α)n桶状结构域和C端的β折叠结构域,底物跨越两个结构域与酶的活性位点相互作用[21]。
Saccharophagusdegradans2-40产生的Alg17c是唯一被表征的PL17家族褐藻胶裂解酶,Alg17c是一种外切型的褐藻胶裂解酶(图2(c)),与PL15家族Atu3025不同的是,Alg17c仅由(α/α)n桶状结构域和C端反向平行的β折叠结构域组成同源二聚体,但是缺少N端的小β折叠。Alg17c的桶状区域由13个螺旋组成,其中12个形成(α/α)n桶状结构和1个额外的螺旋,额外的螺旋支撑在桶管的侧面,保持其刚性。C端结构域展示出三层反向平行β折叠结构,顶层附近有4个小螺旋,插入2个结构域之间。底物也结合在(α/α)n桶状结构域和C端β折叠结构域中[22]。
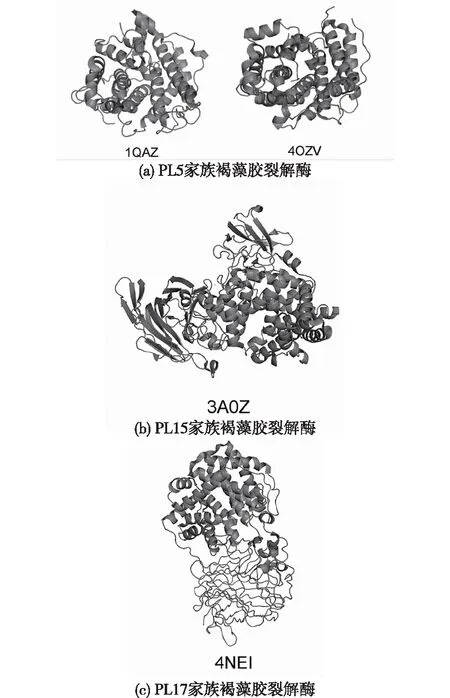
图2 具有α螺旋结构的褐藻胶裂解酶的三维结构
1.3 β螺旋结构(β-helix)
PL6家族的AlyGC是唯一的一个采用右手β螺旋的褐藻胶裂解酶(图3),它是一种外切性polyG特异性的褐藻胶裂解酶[23]。该酶由N端和C端2个结构域组成,并且这2个结构域都采用β螺旋结构,β螺旋的结构由三段β折叠片组成-PB1、PB2、PB3。2个折叠之间的转角或者环被称为T、T1(存在于PB1和PB2之间)、T2(存在于PB2和PB3之间)和T3(存在于PB3和PB1之间)。β螺旋一圈的排列是PB1-T1-PB2-T2-PB3-T3,PB1和PB2几乎是反平行的,PB3几乎垂直于PB2。AlyGC的N末端结构域由12个PB1链、14个PB2链和14个PB3链组成。C末端结构域由9个PB1链、11个PB2链和9个PB3链组成。AlyGC的活性位点位于N端结构域,但C端结构域对于维持酶AlyGC的活性来说也是必不可少的。该酶的活性中心是位于N端结构域表面的长裂缝,周围环绕着来自N端结构域的β链和来自C端结构域的一个环,该酶活性中心的一端被阻断,导致酶外切作用模式。

图3 具有β螺旋结构的褐藻胶裂解酶(PL6家族)的三维结构
2 褐藻胶裂解酶的催化机制
褐藻胶裂解酶通过β消除的方式降解褐藻胶,β消除降解褐藻胶分三步进行:①去除羧基阴离子上的负电荷,然后通过盐桥(组氨酸或赖氨酸)中和电荷;②需要酶活性中心的一个残基作为广义碱,将褐藻胶C5位的质子抽走,酶活性中心的另一个残基作为广义酸提供质子;③来自羧基的电子转移在C4、C5之间形成双键,从而导致含氧糖苷键的断裂[24]。根据去除C5羧基上负电荷的机制以及广义酸碱催化时广义酸和广义碱的不同,β消除可分为:组氨酸(Tyr)/Tyrβ消除,金属离子辅助β消除。大部分褐藻胶裂解酶采用His(Tyr)/Tyr 型β消除,采用这种方式进行β消除的酶,大多数由酶中的Glu、His、Arg或者Asn残基来消除羧基阴离子上的负电荷。在这种类型的β消除中,Tyr作为广义酸,提供质子。根据广义碱的不同,这种类型的β消除又可以进一步进行分类,若广义碱还为原来的Tyr,则这类消除可定义为Tyr/Tyr型β消除;若广义碱为His或者另一个Tyr,则可以将这类消除方式定义为 His(Tyr’)/Tyr型β消除。
2.1 Tyr/Tyrβ消除机制
PL5家族中的A1-III采用这种β消除机制(图4(a)),基于A1-III与三糖降解产物复合结构,预测出Tyr246在酶催化过程中既作为广义酸又作为广义碱。在催化过程中C5端羧基的负电荷首先被Arg239和Asn191所中和,因此C5中的质子相对容易被移除,形成一个羧酸盐二价阴离子中间体,紧接着Tyr246作为广义碱从甘露糖醛酸C5中提取质子,然后Tyr246又作为广义酸向糖苷键提供质子,从而在C4和C5之间形成双键,进而导致糖苷键的断裂[19]。PL18家族的 aly-SJ02也采用这种催化机制,在 aly-SJ02中,Tyr353残基在催化过程中既作为广义酸又作为广义碱,aly-SJ02活性中心的保守残基包括Arg219、Lys223、Gln257、His259、Tyr347以及 Lys349,这些保守位点的残基起到识别并且结合褐藻胶羧基的作用[16]。
2.2 His(Tyr’)/Tyrβ消除机制
His(Tyr’)/Tyr 型β消除机制既适用于顺式消除又适用于反式消除,顺式消除和反式消除的选取取决于酶+1位点结合的底物残基,因此对于双功能的酶来说,它既可以采取顺式消除又可以采取反式消除。对于特异性降解G片段的酶来说,它们只能采取反式消除,而特异性降解M的酶只能采取顺式消除。在这种消除机制中,Glx(Glu和Gln)和Asx(Asp和Asn)残基通常作为中和剂,来中和+1位点处结合糖醛酸羧基端的负电,一些带正电荷的氨基酸残基如His和Arg通过与底物形成氢键来辅助中和负电。在这一类消除机制中,Tyr残基通常作为广义酸提供质子。对于采取顺式消除的酶来说,通常采用相同的Tyr作为广义碱来接受质子;而对于采取反式消除的酶来说,通常采用His残基来接受质子。
A1-II’是PL7家族中首先被阐述催化机制的一种酶,通过对该酶与褐藻酸盐四糖(GGMG)复合物的分析,在催化过程中A1-II’中的Gln189充当中和剂,用来去除C5端羧基的负电荷,His191在催化过程中充当广义碱,Tyr284在催化过程中充当广义酸[25]。PL15家族催化机制唯一被表征的酶是Atu3025,这是一种内切型以及双功能的酶,通过分析该酶的突变体和褐藻酸三糖(ΔGGG)的复合物可以得出:Atu3025中带正电荷的氨基酸残基 Arg199、Arg314和His531在催化过程中起到稳定以及中和C5羧基负电荷的作用,该酶的His311残基在催化过程中充当广义碱,接受质子,而Tyr365残基在催化过程中充当广义酸,提供质子[21]。
PL17家族的Alg17c采用Tyr’/Tyr 型β消除(图4(b)),这种消除机制与His/Tyr型β消除有细微的差别,通过分析突变菌株与ΔMMG复合物的结构,可以得出该酶的Tyr450残基作为广义碱从C5中抽取一个质子,Tyr258残基作为广义酸在催化过程中起到提供质子的作用。该酶中的Asn201和His202 两个残基在催化过程中起到稳定以及中和羧基端负电荷的作用[22]。
关于PL14家族褐藻胶裂解酶催化机制报道较少。小球藻病毒产的酶vAL-1的催化过程对pH值有较大的依赖性,通过对结构和突变分析,Lys197残基对酶在pH7.0条件下维持活性起到重要的作用,Ser219残基在pH10.0条件下对维持该酶活性至关重要[17]。对于polyM特异性真核酶AkAly30,其与底物结合模型显示Lys99残基在+1位点处与polyM残基形成离子键,Tyr140和Tyr142残基偶联在一起并与糖苷键形成氢键网络。由此可以看出这2种PL14家族酶的催化机制有着很大的不同[18]。
2.3 金属离子辅助型β消除机制
PL6家族所有已经表征了的酶均采用Ca2+辅助β消除的机制来降解褐藻胶(图4(c)),通过对酶AlyGC的结构进行分析,可发现Ca2+与Asn181、Glu213、Glu215和Glu184残基共同位于酶的活性中心,在催化过程中的作用类似于His(Tyr’)/Tyr型β消除中Glx和Asx的作用,中和+1位点处所结合糖醛酸羧基的负电。在这种类型的β消除中,Lys220充当广义碱,Arg241充当广义酸[23]。
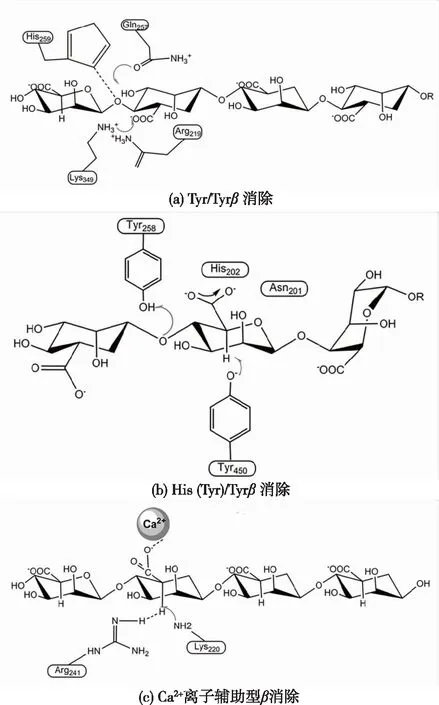
图4 不同类型的褐藻胶裂解酶的反应机制
3 结论
褐藻胶裂解酶是多糖裂解酶家族中的一种酶,按照褐藻胶裂解酶的序列来看,目前已经表征的褐藻胶裂解酶可分属到7个多糖裂解酶家族。本文中,笔者介绍了目前已经表征的酶的结构,褐藻胶裂解酶的结构大致可以分为三类:β果冻卷、(α/α)n桶状结构以及β螺旋结构。采用β果冻卷结构的酶主要是由2个β折叠片和少量的α螺旋组成的球状结构,PL7、PL14、PL18家族的褐藻胶裂解酶多采取这类的结构。(α/α)n桶状结构通常由3到7个α螺旋组成,PL5、PL15、PL17家族的褐藻胶裂解酶大多采取这种结构。β螺旋结构由三段β折叠片以及转角和环组成,PL6家族的褐藻胶裂解酶多采取这种结构。
褐藻胶裂解酶通过β消除来降解褐藻胶,根据催化过程中有无金属离子辅助,β消除可进一步分为His(Tyr)/Tyrβ消除和金属离子辅助型β消除,在His(Tyr’)/Tyrβ消除中,根据+1位点处结合底物残基的不同,β消除又可分为顺式消除和反式消除。尽管对部分褐藻胶裂解酶的结构和催化机制有了很深入的研究,仍然有大部分的酶尚未表征,需要进一步去研究。
