多倍体银鲫nanos2等位多态性、共线性和表达模式分析
2020-10-15张琴琴甘瑞海俞兆曦桂建芳
张琴琴 周 莉 李 志 甘瑞海 俞兆曦 桂建芳 汪 洋
(1. 中国科学院水生生物研究所种子创新研究院, 淡水生态与生物技术国家重点实验室, 武汉 430072;2. 中国科学院大学, 北京 100049; 3. 宁夏回族自治区水产研究所(有限公司), 银川 750001)
生殖干细胞(Germline stem cells, GSCs)是一种独特的成体干细胞, 具有自我更新的能力, 维持着配子的发生和分化, 在世代间传递遗传信息, 被认为是“不朽干细胞”[1,2]。因此, 鉴定分离GSCs, 不仅可作为研究成体干细胞自我更新和不对称分裂、生殖细胞发育及其谱系稳态维持的理想实验系统,而且对理解水产养殖动物的繁殖策略、发展“借腹怀胎”等生物技术至关重要[3]。
nanos基因最早在果蝇中被鉴定为腹部形成的决定因子之一[4], 后被证实是维持GSCs所必需的[5]。脊椎动物的nanos基因家族包括nanos1、nanos2和nanos3三个成员, 其中nanos2和nanos3是生殖细胞发育所必需的[6]。跟其他成员一样,nanos2是一个RNA结合蛋白, 含有一个保守的锌指结构域(Zinc Finger-domain, ZF-domain)。在模式鱼类斑马鱼(Danio rerio)和青鳉(Oryzias latipes)中,nanos2被鉴定为GSCs的标记基因[7—9]。随后在少数养殖鱼类,如虹鳟(Oncorhynchus mykiss)[10]、尼罗罗非鱼(Oreochromis niloticus)[11,12]、斜带石斑鱼(Epinephelus coioides)[3]、半滑舌蹋(Cynoglossus semilaevis)[13]和大黄鱼(Larimichthys crocea)[14]中进行了nanos2的克隆和表达分析。但它们在成体组织的分布以及性腺中的细胞定位都存在差异, 表现出物种的特异性。譬如,nanos2特异地在尼罗罗非鱼雄性生殖细胞中表达[11,12]; 而斜带石斑鱼和半滑舌蹋的nanos2除了在精巢和卵巢中高表达外, 还在脑或肝脏等组织中微量表达[3,13]。在斜带石斑鱼的卵巢、精巢及间性性腺中,nanos2特异表达于一类直径小于20 μm的细胞中[3], 与斑马鱼和青鳉的nanos2表达细胞类似, 可能是GSCs; 而虹鳟nanos2的转录本可在未分化A型精原细胞、卵原细胞和早期卵母细胞中检测到[10]。
银鲫(Carassius gibelio)是一种广泛分布于亚欧大陆的六倍体鱼类[15,16], 具有独特的单性雌核生殖、有性生殖和类杂种生殖等多重生殖方式[15,17],其性别由雄性个体中额外的微小染色体决定, 并受温度调控[18—20]。这些特性使其成为一种开展生殖发育遗传学研究的独特对象[21,22]。在前期的研究中, 本实验室已从银鲫中鉴定了一些重要的生殖细胞标记基因, 如vasa[23]、dazl[24]和dnd[25]等, 为研究单性脊椎动物生殖方式的调控机制提供了重要线索, 但尚未鉴定到GSCs的标记基因。因此, 本研究克隆鉴定了两个歧化的nanos2基因Cgnanos2a和Cgnanos2b, 分析它们等位基因的多态性、基因组结构和与其邻近基因的共线性关系, 成体组织和卵巢不同发育阶段的表达差异以及在卵巢和精巢中的细胞定位。研究结果一方面可为研究多倍体鱼类重复基因的进化提供基础数据, 另一方面为分离银鲫GSCs, 深入研究GSCs的功能奠定基础。
1 材料与方法
1.1 实验材料
银鲫F系取自中国科学院水生生物研究所官桥实验基地。取5月龄的银鲫雌性个体的心、肝、脾、肾、脑、下丘脑、垂体和卵巢组织, 相同月龄雄性个体的精巢组织, 以及孵化后25d、35d、45d、60d、90d、120d和190d的银鲫雌性个体的卵巢组织进行qPCR分析, 进行3个生物学个体重复。取4月龄的银鲫卵巢和精巢进行RNA切片原位杂交分析。
1.2 总RNA提取和SMARTer cDNA模板合成
按照Trizol和SV Total RNA Isolation System试剂盒(Promega)说明书步骤进行总RNA的提取, 其质量和浓度分别用1.0% (w/v) 琼脂糖凝胶电泳和Nanodrop 2000C(Thermo Fisher Scientific)分光光度计进行检测。银鲫卵巢和精巢组织提取的总RNA等量混合后, 按照SMARTer®RACE 5′/3′ Kit(TaKaRa)说明书描述的步骤构建3′ 和5′ cDNA文库。合成的cDNA置于-80℃保存。
1.3 银鲫Cgnanos2a和Cgnanos2b cDNA全长克隆
首先在银鲫F系基因组中进行斑马鱼nanos2序列的同源搜索, 获得两个同源性较高的序列CI01000080_01993914_01996596和ENSDARP000000 89386-D3, 分别命名为Cgnanos2a和Cgnanos2b。接着, 根据Cgnanos2a和Cgnanos2b的基因组序列用Oligo7.0软件设计了3对RACE引物, 进行了三轮扩增(表 1)。以卵巢和精巢混合的cDNA文库为模板,使用RACE引物Cgnanos2a-5′Outer、外Cgnanos2a-3′Outer、Cgnanos2b-5′Outer、Cgnanos2b-3′Out-er与引物UPM分别进行5′和3′RACE的第一次PCR扩增。接着将首次PCR产物稀释100倍后作为模板,用相应的RACE内引物Cgnanos2a-5′Inner1、Cgnanos2a-3′Inner1、Cgnanos2b-5′Inner1、Cgnanos2b-3′Inner1和引物NUP进行巢式PCR, 电泳检测PCR产物, 若无目的条带或者条带不单一, 将第二次PCR产物稀释100倍后作为模板, 再用相应的RACE内引物Cgnanos2a-5′Inner2、Cgnanos2a-3′Inner2、Cgnanos2b-5′Inner2、Cgnanos2b-3′Inner2和引物NUP进行第二次巢式PCR, 三次PCR的反应体系和反应程序均参见前期研究[26]。扩增出的特异DNA带经过1.0%琼脂糖凝胶电泳后, 采用Gel Extraction Kit(Omega Bio-Tek)回收, 回收产物与pMD18-T载体(TaKaRa)连接后转化DH5α感受态细胞。选取阳性克隆进行双向测序, 序列经拼接后获得Cgnanos2a和Cgnanos2b的cDNA全长序列。

表1 本文中所用引物Tab. 1 Primers used in this study
1.4 银鲫Cgnanos2a和Cgnanos2b基因序列分析、系统发育树构建和其邻近基因共线性分析
在ORFfinder(https://www.ncbi.nlm.nih.gov/orffinder/)预测Cgnanos2a和Cgnanos2b的编码氨基酸序列; NCBI(https://www.ncbi.nlm.nih.gov/)上下载了7个物种的Nanos2的氨基酸序列; 采用BioEdit软件进行Nanos2多重序列比对分析; 用MEGA 6.06软件, 采用邻接法(NJ法)对脊椎动物Nanos2进行系统进化树构建。不同物种Nanos2的登录号如下: 银鲫CgNanos2a(MN864889)、银鲫CgNanos2b-1(MN864890)、银鲫CgNanos2b-2(MN864891)、银鲫CgNanos2b-3(MN864892)、鲫(Carassius auratus)CaNanos2a(XP_026098184.1)、鲫CaNanos2b(XP_026068547.1)、鲤(Cyprinus carpio)CcNanos2a(XP_018956476.1)、鲤CcNanos2b(XP_018949587.1)、斑马鱼DrNanos2 (BK008580.1)、青鳉OlNanos2(NP_001153919.1)、石斑鱼EcNanos2 (KX262962.1)、人(Homo sapiens)HsNanos2 (NP_001025032.1)和小鼠(Mus musculus)MmNanos2 (NP_918953.2)。
从银鲫F系基因组和彩鲫基因组中获得nanos2a和nanos2b的上下游基因序列, 并从Ensembl数据库获得斑马鱼nanos2的上下游基因, 绘制nanos2及其周边基因的共线性关系。
1.5 实时荧光定量PCR(Quantitative Reverse Transcription PCR, qPCR)
每个样品取0.1 μg总RNA, 按照GoldScript cDNA合成试剂盒(Invitrongen)的说明书步骤反转录获得cDNA。使用Oligo7.0软件设计Cgnanos2a和Cgnanos2b基因的qPCR特异性引物(表 1)。根据实验室前期对银鲫最适内参基因的分析[27], 选取真核翻译延伸因子1α1-类似因子1(Eukaryotic translation elongation factor 1 alpha 1-like1,eef1a1l1)作为内参基因, 用CFX96TMOptics Module(Bio-Rad)进行qPCR,反应条件如下: 95℃预变性30s; 95℃变性5s, 60℃,30s, 40cycles; 65℃, 5s; 95℃, 5s。进行3次生物学个体重复, 并每个样品做3次技术性重复, 用2-ΔΔCt方法计算基因的相对表达量。采用平均值±标准误(Mean±SEM)来表示, 采用SPSS 20.0 软件进行方差分析,P<0.05表示存在显著性差异。
1.6 探针合成和原位杂交(Sections in situ hybridization, SISH)
根据Cgnanos2a和Cgnanos2b的cDNA序列, 设计原位杂交反义和正义引物, 5′端加入T7启动子序列(表 1)。探针的体外合成以及切片原位杂交均参照文献[28]进行。取4月龄银鲫的卵巢和精巢组织,在4℃环境中于4% PFA中固定12—16h, 再经30%蔗糖渗透过夜后, OTC包埋后进行冰冻切片, 切片的厚度为5 μm。利用地高辛标记的Cgnanos2a和Cgnanos2b的RNA探针进行切片原位杂交。镜检染色达到合适效果后, 经梯度甲醇脱色、复水和封片后,在Carl Zeiss正置荧光显微镜 Axio Imager M2 (中国科学院水生生物研究所分析测试中心)进行拍片。
2 结果
2.1 银鲫Cgnanos2a和Cgnanos2b的3个不同等位基因的分子特征
首先通过RACE-PCR各获得了Cgnanos2a和Cgnanos2b的3个全长cDNA序列。其中Cgnanos2a的3个全长cDNA大小分别为752、753和758 bp, 它们之间高度保守, 序列平均一致性高达(98.9±0.3)%,且开放阅读框均为438 bp, 预测编码相同的145个氨基酸。Cgnanos2b的3个全长cDNA的大小分别为783、784和782 bp, 平均一致性为(99.5±0.1)%; 均编码141个氨基酸(CgNanos2b-1、CgNanos2b-2和CgNanos2b-3), 它们之间的平均一致性为(99.1±0.4)%, 在第73和第85位氨基酸存在差异。而Cgnanos2a和Cgnanos2b序列分歧较大, 它们之间cDNA的平均一致性仅为(69.2±0.3)%, 氨基酸一致性为(79.1±0.7)%。
在四倍体鲫和鲤的基因组中也存在两个分歧较大的nanos2基因(其中鲤nanos2在GenBank中被注释为nanos homolog 1-like), 而在斑马鱼、青鳉、石斑鱼等其他鱼类和其他脊椎动物基因组中, 均只搜索到一个nanos2基因。其中, 银鲫Nanos2与鲫Nanos2高度保守, 其中CgNanos2a和CgNanos2b与CaNanos2a和CaNanos2b的一致性分别高达91.6%和82.7%。与其他鲤科鱼类(如鲤和斑马鱼)Nanos2的一致性在72.1%—89.0%, 而与其他非鲤科鱼类的一致性仅为40.0%左右。尽管银鲫Nanos2与人、小鼠Nanos2的一致性在35.9%—37.3%, 但Nanos2的ZF结构域在所有脊椎动物中比较保守, 均具有半胱氨酸和组氨酸残基组成的“CCHC CCHC”特征序列, 平均一致性为(75.6±14.4)%。
为了揭示银鲫CgNanos2a和CgNanos2b的进化关系和起源, 我们采用邻接法(NJ法)构建了系统进化树(图 1)。银鲫CgNanos2b-1、CgNanos2b-2和CgNanos2b-3首先与鲫CaNanos2a聚为一簇, 再与鲤CyNanos2a聚为一簇; 同样, 银鲫CgNanos2b-1、Cg-Nanos2b-2和CgNanos2b-3与鲫CaNanos2b和鲤CyNanos2b聚为另一簇; 接着再与斑马鱼DrNanos2聚为鲤科鱼类Nanos2一枝。上述的结果表明, 在银鲫、鲫和鲤的进化历程中发生了一次异源多倍化事件, 导致在它们的基因组中产生了分歧较大的两个nanos2基因。
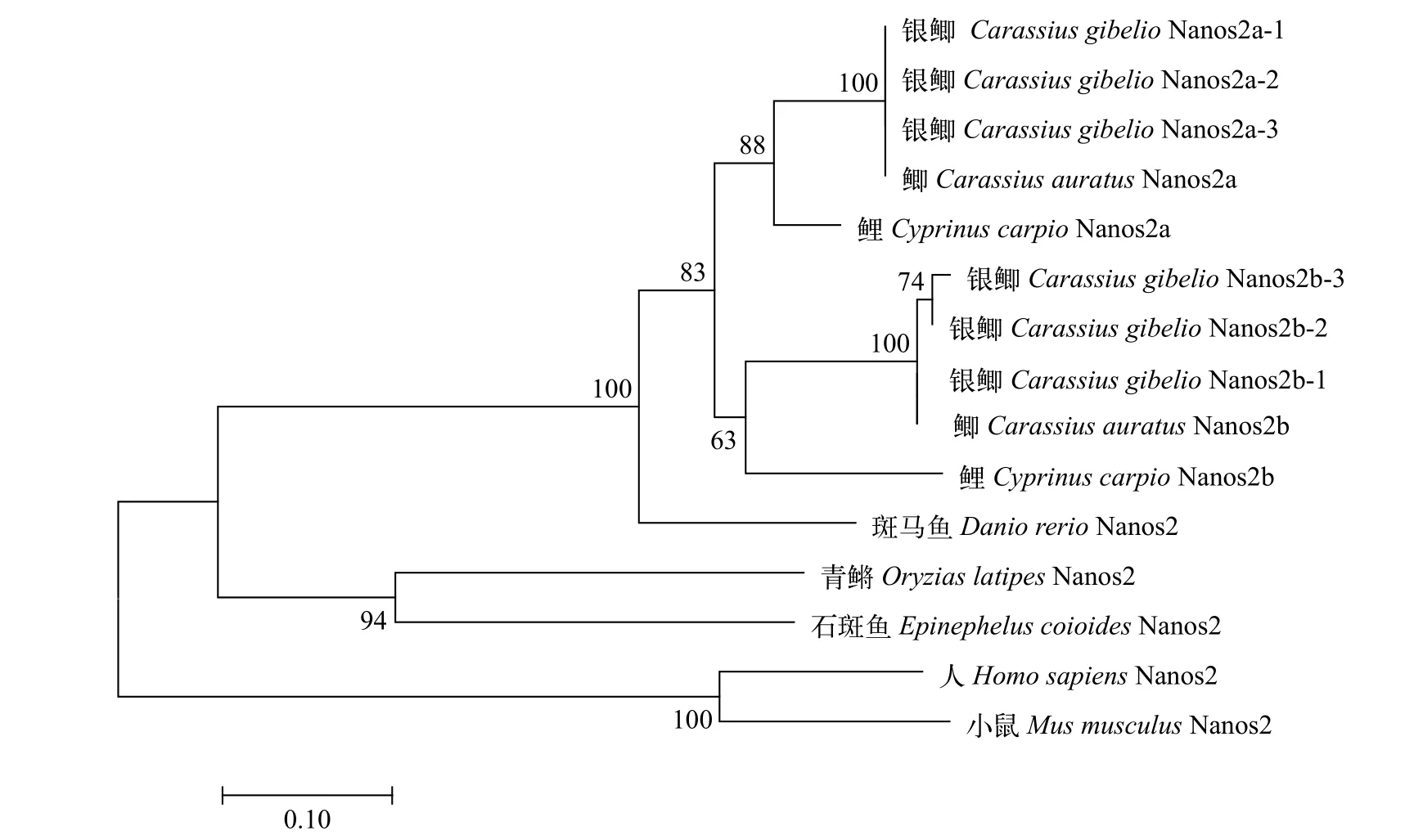
图1 NJ法构建的脊椎动物Nanos2的系统进化树Fig. 1 The phylogenetic tree of vertebrate Nanos2 based on NJ method分支上数值代表置信度, 设置1000 次bootstrap 进行评估The values on the branches indicate the number of hits supporting the branching pattern from 1000 bootstraps
2.2 银鲫Cgnanos2a和Cgnanos2b的基因组结构和相邻基因共线性
我们将扩增获得的Cgnanos2a和Cgnanos2b的全长cDNA序列与银鲫基因组进行比对, 以分析它们的基因组结构。结果表明, 与其他脊椎动物nanos2一样,Cgnanos2a和Cgnanos2b也均由一个外显子组成, 无内含子。
接着, 根据Ensembl 数据库获得的nanos2所在区域的基因组序列, 我们绘制了银鲫、鲫、斑马鱼nanos2及其上下游基因的共线性图(图 2)。Cgnanos2a和Cgnanos2b分别位于银鲫A5和B5染色体上; 与斑马鱼相比, 银鲫和鲫的nanos2a所在的A5染色体仍然保留着大多数基因, 具有保守的rsph4anapaa、selenow1-akap10-spata22-zgc:85789、apsaabr-nanos2-zswim7-adora2b-specc1-timm22等基因块(Gene block), 但丢失了znf541-ehd2a、pho和tlcd3a; 其中znf541-ehd2a仍然保留在银鲫和鲫nanos2b所在的B5染色体上, 表现出一定的“互补丢失”的特征。与A5染色体相比, B5丢失了更多重复基因, 如rsph4a、zgc:85789、abr和zswim7。与鲫的A5和B5染色体对上的基因相比, 银鲫A5和B5染色体对保留着所有基因, 而在鲫的进化历程中丢失了tbcelb基因。与鲫的A5染色体相比, 银鲫A5染色体仅有rsph4a发生了倒置; 而与银鲫和鲫A5染色体以及鲫B5染色体相比, 银鲫B5染色体nanos2邻近区域发生了大片段倒置, 导致它们的转录起始方向全部发生改变。
2.3 银鲫Cgnanos2a和Cgnanos2b在性腺中高丰度且偏向表达
鉴于Cgnanos2a和Cgnanos2b的3个不同等位基因之间的一致性非常高, 我们无法设计特异引物将它们等位基因分别扩增。因此, 在本研究中我们针对Cgnanos2a和Cgnanos2b之间的序列差异, 设计了两对特异引物, 并采用qPCR方法分析了Cgnanos2a和Cgnanos2b在银鲫F系成体组织中的分布以及在不同发育阶段卵巢的表达动态变化(图 3)。在5月龄银鲫中,Cgnanos2a和Cgnanos2b主要在精巢中高表达, 且呈现偏向表达,Cgnanos2a的表达水平显著高于Cgnanos2b(P<0.05)。其次在卵巢中可以检测到较多的Cgnanos2a和Cgnanos2b的转录本, 但它们在5月龄银鲫卵巢中的表达丰度没有明显差别, 仅为精巢中Cgnanos2a的25.6%左右, 与Cgnanos2b的表达丰度相同。此外, 还可在下丘脑、垂体和肾脏等其他组织中检测到少量Cgnanos2a和Cgnanos2b的转录本, 其中在肝脏、脾脏、肾脏、下丘脑和其他脑组织中Cgnanos2a和Cgnanos2b呈现偏向表达(图 3A)。
随后我们分析了它们在不同卵巢发育阶段的表达动态变化。结果表明, 在孵化后25d,Cgnanos2a和Cgnanos2b的转录水平最高, 其中Cgnanos2a的转录水平是Cgnanos2b的6.5倍。随后Cgnanos2a和Cgnanos2b的表达急剧下降。从孵化后25—60d,Cgnanos2a的表达量始终显著高于同时期Cgnanos2b的表达量(P<0.05); 在孵化后90d后, 二者无显著性差异(图 3B)。

图2 鲫复合种nanos2a和nanos2b基因与其邻近基因保守的共线性关系Fig. 2 Syntenic alignment of chromosomal regions around Carassius auratus complex nanos2a and nanos2b
2.4 银鲫Cgnanos2a和Cgnanos2b可标记生殖干细胞
为了揭示Cgnanos2a和Cgnanos2b是由银鲫卵巢和精巢组织的哪类细胞表达, 我们合成了分别特异于Cgnanos2a和Cgnanos2b的地高辛探针, 并在4月龄银鲫的卵巢和精巢组织切片中进行了RNA原位杂交分析(图 4)。4月龄的银鲫卵巢组织处于卵母细胞初级生长期, 可观察到大量卵原细胞和初级卵母细胞。原位杂交结果表明,Cgnanos2a和Cgnanos2b均特异地在邻近生殖上皮的胞囊(Cyst)中一类直径小于20 μm的细胞中表达(图 4A、4B)。SISH的结果与qPCR的结果一致,Cgnanos2a和Cg-nanos2b在卵巢中的表达量没有明显差异, 不存在偏向表达。以Cgnanos2a为例, 在4月龄银鲫卵巢组织切片中, 我们观察到了仅含有1—4个Cgnanos2a阳性细胞的胞囊(图 4C、4D), 含有2个Cgnanos2a阳性细胞和若干卵原细胞(Oogonia, Og)的胞囊(图 4E)以及含有2个Cgnanos2a阳性细胞、若干卵原细胞和初级卵母细胞(Primary oocyte, PO)的胞囊(图 4F)。
4月龄银鲫精巢特征为含有精原细胞(Spermatogonia, SPG)、初级精母细胞(Primary spermatocyte, SPC1)和次级精母细胞(Secondary spermatocyte, SPC2), 尚未产生精子细胞(SPZ, Spermatozoa)。Cgnanos2a和Cgnanos2b的表达存在明显的差异(图 4G、4J)。与qPCR的结果一致(图 3A),Cgnanos2a的表达水平高于Cgnanos2b。二者均可在精原细胞和初级精母细胞中检测到, 但Cgnanos2a还在精小囊边缘一类单个或两个紧紧相邻的细胞中高表达。
3 讨论
在本研究中, 我们从银鲫F系中克隆了nanos2的两个部分同源基因Cgnanos2a和Cgnanos2b, 进行了它们3个等位基因的序列特征和邻近基因的共线性等进化以及表达特征分析。自从nanos基因从果蝇中鉴定以来[4],nanos基因家族成员由于其在生殖细胞发育中的关键作用一直广受关注[6,29,30]。至今,已在十余个物种中鉴定了nanos2, 并发现它在不同物种中的表达模式存在着明显的差异。在人、小鼠和尼罗罗非鱼中,nanos2均特异地在精巢中表达,在卵巢和脾脏等其他组织中检测不到转录本或蛋白的存在[6,12,31]。而Cgnanos2a和Cgnanos2b在银鲫成体组织中的分布与牛[32]、鸡[33]、斑马鱼[8]、青鳉[34,7]、虹鳟[10]、斜带石斑鱼[3]、半滑舌蹋[13]和大黄鱼[14]相似, 除了在精巢中高丰度表达外, 还在卵巢中可以检测到较高丰度或微量转录本的存在, 表明nanos2除了具有维持雄性生殖细胞的自我更新的功能外[6,35], 在这些物种的卵巢发育和再生中也具有重要作用[36]。
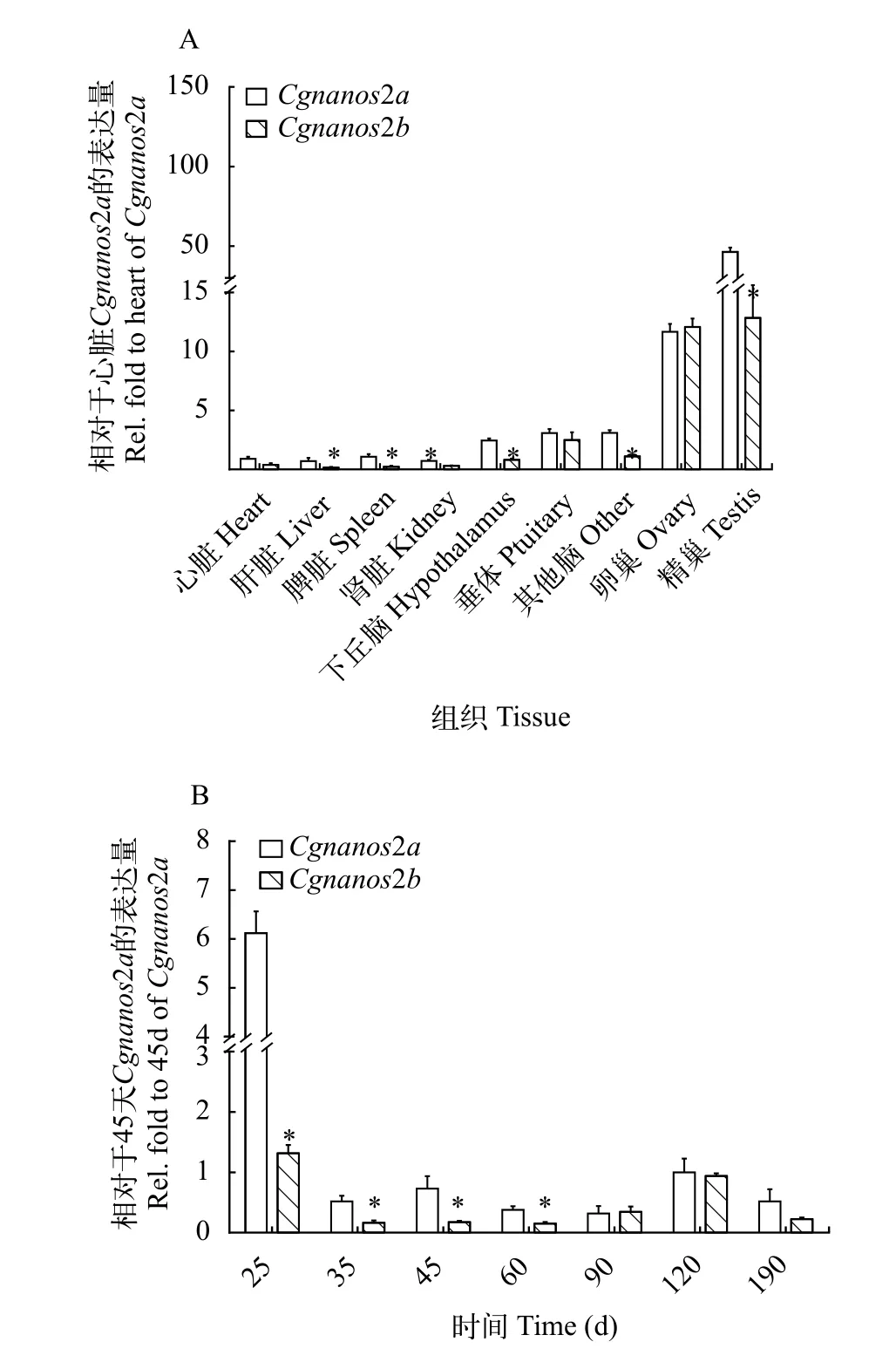
图3 Cgnanos2a和Cgnanos2b在银鲫不同成体组织(A)和不同发育阶段卵巢(B)的表达分析Fig. 3 The expression of Cgnanos2a and Cgnanos2b in adult tissues (A) and ovaries at different developmental stages of gibel carp (B)
GSCs维持着生物体整个生命周期中配子的发生。nanos2已在小鼠[6]、斑马鱼[8]、青鳉[7]、虹鳟[10]和斜带石斑鱼[3]等物种中, 被鉴定为GSCs或未分化A型精原细胞的标记基因。在本研究中, 我们通过SISH分析发现Cgnanos2a和Cgnanos2b均特异地在银鲫卵巢邻近生殖上皮的胞囊中一类直径小于20 μm的细胞中表达, 以及Cgnanos2a在精巢精小囊边缘一类单个或两个紧紧相邻的细胞中高表达(图 4)。这些nanos2阳性细胞的大小以及在性腺中的分布,与斑马鱼、青鳉和斜带石斑鱼的GSCs相似, 因此,我们推测nanos2可能是银鲫GSCs的标记基因。在孵化后25d的卵巢中,Cgnanos2a和Cgnanos2b的转录水平最高, 随后表达水平急剧下降。这表明在孵化后25d左右或更早期, 银鲫卵巢中的GSCs正在大量增殖。根据含有nanos2阳性细胞的胞囊内含有细胞的类型和大小, 我们描述了银鲫卵巢早期胞囊的发育过程(图 4C—F)。最小的胞囊中一般仅含有一个Cgnanos2阳性细胞; 接着Cgnanos2阳性细胞经过1—2次有丝分裂, 分裂成含有2—4个Cgnanos2阳性细胞; 随着胞囊的发育, 一部分nanos2阳性细胞开始分化成不表达Cgnanos2的卵原细胞; 接着卵原细胞进一步有丝分裂增殖, 并进入减数分裂, 产生初级卵母细胞、次级卵母细胞和卵子。在人[31]和牛[32]等物种中,nanos2不仅局限于未分化A型精原细胞或精原干细胞中表达, 还在其他雄性生殖细胞中, 如精母细胞和精子细胞中表达。在本研究中,我们还在精原细胞和初级精母细胞中检测到Cgnanos2a和Cgnanos2b的转录本, 但在次级精母细胞中没有检测到阳性信号。
拥有156条或162条染色体的银鲫[37], 已被证明在其进化历程中除了经历硬骨鱼类特异的全基因组复制(Teleost genome duplication, TGD)事件外[38—40], 还经历了额外的两轮连续多倍化事件[41]。对银鲫Dmrt1[41]、bmp15[26]、头肾组织的转录组[42,43]以及干扰素系统基因的分析[27]均表明, 在银鲫基因组中至少存在两个歧化的部分同源基因。与前期的研究结果一致, 银鲫也具有序列分歧较大的两个部分同源基因Cgnanos2a和Cgnanos2b, 其cDNA序列的平均一致性仅为(69.2±0.3)%; 与Cgbmp15a和Cgbmp15b一样[26],Cgnanos2a和Cgnanos2b各自具有高度保守的3个等位基因, 等位基因之间的一致性均高达99.0%。系统进化树和nanos2相邻基因的共线性分析再次证明(图 1和图 2), 银鲫进化历程中发生了额外的两轮多倍化事件, 是一个异源六倍体。其中异源多倍化事件导致银鲫和鲫的四倍体共同原始祖先的基因组中包含Cgnanos2a和Cgnanos2b; 随后的同源多倍化事件导致Cgnanos2a和Cgnanos2b各自具有了序列高度一致性的3个等位基因。

图4 Cgnanos2a和Cgnanos2b在银鲫卵巢和精巢中的细胞定位Fig. 4 Cellular distribution of Cgnanos2a and Cgnanos2b in gibel carp ovary and testis
新形成的多倍体在经历“基因组休克(Genomic shock)”的混乱后[44,45], 发生一系列复杂的、非孟德尔的基因组变化来突破不稳定的瓶颈, 重建多倍体基因组。这些变化包括染色体重排和染色质重构[46,47], 基因转换、部分同源基因的丢失、沉默或偏向表达[48,49], 表观遗传重塑[50,51]以及亚基因组的转录表达响应和基因共表达网络的改变等[52,53]。相对于斑马鱼nanos2的邻近基因分布, 银鲫和鲫的nanos2a所在的A5染色体保留着大多数的基因, 而nanos2b所在的B5染色体丢失了更多基因, 表现出一定的“互补丢失”的特征; 且与银鲫和鲫A5染色体以及鲫B5染色体相比,nanos2邻近区域发生了大片段倒置, 导致它们的转录起始方向全部发生改变(图 2)。同时, 尽管在成体组织分布、不同发育阶段卵巢中,Cgnanos2a和Cgnanos2b具有相似的表达谱式, 但在5月龄精巢、肝脏、脾脏、肾脏、下丘脑和其他脑组织, 以及在孵化后25—60d的卵巢中,Cgnanos2a的表达水平均显著高于Cgnanos2b的表达水平(图 3); 而且在精巢中,Cgnanos2a还在精小囊边缘一类单个或两个紧紧相邻的细胞中高表达(图 4G—J)。上述的结果表明, 银鲫在形成异源多倍体后, 其基因组发生了大片段的倒置、不同来源的两个部分同源基因的丢失和偏向表达等复杂变化。
