油酰乙醇酰胺改善LO2细胞中脂肪酸诱导的氧化应激
2020-10-15刘元法李进伟
陈 静,刘元法,李进伟
(1.江南大学 食品学院,江苏 无锡 214122; 2.粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122)
非酒精性脂肪性肝病(NAFLD)是一种常见的与代谢相关的慢性肝病[1],被认为是代谢综合征的肝脏表现[2-3]。NAFLD是指在没有过量饮酒的情况下,肝脏组织中的脂肪含量大于肝脏质量5%或肝细胞中甘油三酯浸润大于肝细胞体积5%的病理状况[4]。
人们普遍认为脂肪组织与肝脏的肥胖及胰岛素抵抗(IR)导致肝脏内游离脂肪酸(FFA)通量增加,过量的脂肪酸氧化诱导活性氧(ROS)水平升高,ROS通过靶向生物膜上膜磷脂和脂蛋白中多不饱和脂肪酸(PUFA)的双键引发脂质过氧化,从而造成细胞损伤[5]。同时,很多证据表明氧化应激(OS)是NAFLD发展过程中最重要的病理事件,是单纯脂肪变性向非酒精性脂肪性肝炎(NASH)发展的标志[6]。因此,减少肝脏氧化应激对于预防和治疗NAFLD至关重要。
油酰乙醇酰胺(OEA)是过氧化物酶体增殖物激活受体α(PPARα)的高亲和力配体,在治疗肥胖和其他肥胖相关的代谢并发症方面表现出很多的药理学特性[7]。美国FDA已经批准OEA用作膳食补充剂。研究发现,OEA能够通过改善氧化应激,对原代人脐静脉内皮细胞(HUVEC)损伤模型[8]和脂多糖诱导的大鼠额叶皮层[9]起到保护作用。OEA还可以降低小鼠肝脏中硫代巴比妥酸反应物(TBARS)和总谷胱甘肽水平,从而改善氧化应激[10]。此外,OEA处理能够显著降低高脂血症模型大鼠肝脏中的丙二醛(MDA)含量,并同时提高肝脏谷胱甘肽过氧化物酶(GPx)活性[11]。研究表明OEA可能是改善氧化应激的有效成分,但其作用机制尚不完全清楚。本研究致力于探究OEA对人肝细胞系LO2细胞内脂肪酸诱导的氧化应激的作用及潜在机制,为OEA改善肝脏氧化应激以治疗NAFLD提供理论基础和科学依据。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
LO2细胞,中科院上海细胞库。油酸钠、棕榈酸钠和油酰乙醇酰胺,美国Sigma公司;无脂肪酸牛血清白蛋白(FFA-free BSA),美国Equitech-Bio公司;RPMI 1640培养基,美国Hyclone公司;澳洲胎牛血清,乌拉圭Lonsera公司;100 X青霉素-链霉素溶液和0.25%胰蛋白酶-EDTA消化液,美国Gibco公司;二甲基亚砜(DMSO)、CCK-8试剂盒、BCA蛋白浓度测定试剂盒、活性氧检测试剂盒、总SOD活性检测试剂盒、过氧化氢酶检测试剂盒、脂质氧化(MDA)检测试剂盒和总谷胱甘肽过氧化物酶检测试剂盒,上海碧云天生物技术有限公司;UNlQ-10柱式总RNA抽提试剂盒、AMV第一链cDNA合成试剂盒和2×SG Fast qPCR Master Mix试剂盒,上海生工生物工程股份有限公司;Nrf2、HO-1和β-actin抗体,沈阳万类生物科技有限公司。
1.1.2 仪器与设备
CO2细胞培养箱,超净工作台,低速离心机,高速冷冻离心机,倒置荧光显微镜,SpectraMax190酶标仪,流式细胞仪,Quickdrop超微量分光光度计,RT-PCR仪,BIO-RAD电泳仪,C-DiGit数码化学发光成像仪。
1.2 实验方法
1.2.1 样品制备
1.2.1.1 0.2 g/mL BSA-PBS溶液
称取6 g BSA于50 mL离心管中,添加30 mL预先加热的PBS溶液,配制成0.2 g/mL的母液,于离心机中4 000 r/min离心10 min,得到棕黄色澄清溶液。
1.2.1.2 脂肪酸混合溶液
本实验采用油酸和棕榈酸(摩尔比为2∶1)混合物诱导细胞氧化应激。称取0.243 6 g油酸钠和0.111 4 g棕榈酸钠于50 mL离心管中,添加30 mL超纯水,配制成浓度为40 mmol/L的母液,置于75℃水浴中充分溶解至溶液澄清透明。实验前与0.2 g/mL BSA-PBS溶液按比例混合,使培养液中脂肪酸混合溶液终浓度为0.4 mmol/L,BSA质量分数为0.4%。
1.2.1.3 OEA溶液
称取1 g OEA,添加30.719 mL DMSO,配制成终浓度为100 mmol/L的母液。实验前按比例添加,使培养液中DMSO 体积分数为0.1%。
1.2.2 细胞培养与处理
将LO2细胞与含有10%胎牛血清、100 U/mL青霉素和0.1 mg/mL链霉素的RPMI培养基在湿润的5% CO2细胞培养箱中37℃恒温培养。与脂肪酸混合溶液孵育24 h诱导细胞氧化应激,同时加入不同浓度的OEA溶液。
1.2.3 细胞活力测定
采用CCK-8法测定细胞活力。将LO2细胞以1.0×104个/孔的密度种植在96孔板中贴壁培养24 h。加入0.4 mmol/L脂肪酸混合溶液和不同浓度的OEA溶液共同培养22 h后,每孔加入10 μL CCK-8溶液继续孵育2 h。采用酶标仪在450 nm处测定吸光值。
1.2.4 ROS水平测定
在实验中,使用活性氧检测试剂盒检测LO2细胞内的ROS水平。按照试剂盒说明,将细胞种植于6孔板中,培养结束后,倒掉细胞培养液,4℃的PBS洗涤1次。加入1 mL稀释好的2′,7′-二氯荧光黄双乙酸盐(DCFH-DA,按照1∶1 000用无血清培养液稀释,使DCFH-DA终浓度为10 μmol/L),37℃细胞培养箱内继续孵育20 min。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA,最后使用流式细胞仪检测细胞内荧光强度。
1.2.5 MDA含量及抗氧化酶活性测定
将细胞种植于6 cm2培养皿中,培养结束后,倒掉细胞培养液,4℃的PBS洗涤1次。加入200 μL Western及IP细胞裂解液,适当吹打以充分裂解细胞。4℃条件下12 000g离心5 min,取上清液作为待测样品。根据试剂盒说明,使用脂质氧化(MDA)检测试剂盒测定样品MDA水平,总SOD活性检测试剂盒测定样品SOD活性,过氧化氢酶检测试剂盒测定样品过氧化氢酶(CAT)活性,总谷胱甘肽过氧化物酶检测试剂盒检测样品谷胱甘肽过氧化物酶(GPx)活性,样品蛋白浓度通过BCA蛋白浓度测定试剂盒测定。
1.2.6 RT-qPCR分析
使用UNlQ-10柱式总RNA抽提试剂盒提取LO2细胞总RNA,通过Quickdrop超微量分光光度计检测总RNA浓度和纯度,使用AMV第一链cDNA合成试剂盒将RNA反转录成cDNA,保存于-20℃。最后使用2×SG Fast qPCR Master Mix试剂盒进行PCR扩增。实验用引物由上海生工生物工程股份有限公司设计合成(如表1所示),以β-actin为参照基因,结果用2-ΔΔCt表示。
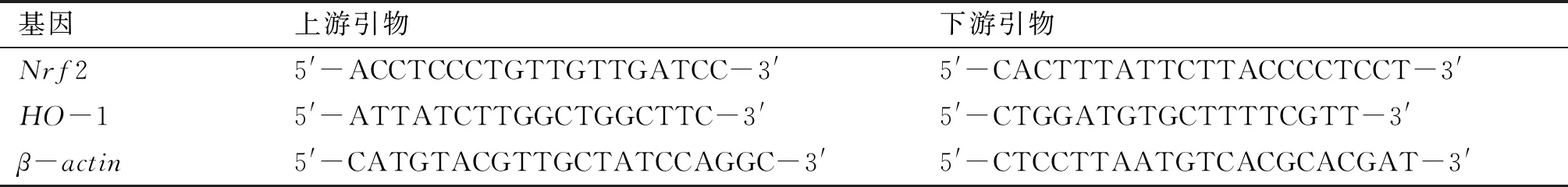
表1 引物序列
1.2.7 免疫印迹分析
收集细胞并用Western及IP细胞裂解液裂解,4℃条件下12 000g离心10 min,然后用BCA蛋白浓度测定试剂盒测定上清液中蛋白质含量。SDS-聚丙烯酰胺凝胶分离等量(30 μg)蛋白样品,再将蛋白转移到PVDF膜上。将膜与Nrf2、HO-1以及β-actin抗体4℃孵育过夜,再与二抗室温孵育1 h。最后通过特超敏ECL化学发光试剂盒检测蛋白条带,并通过Image J软件对光密度进行定量分析。
1.2.8 统计分析
所有实验至少重复3次,数据结果用“平均值±标准差”的形式表示。使用SPSS 23.0软件对数据进行统计分析,使用Origin 9.1软件作图。
2 结果与分析
2.1 OEA对细胞活性的影响
本实验通过添加油酸和棕榈酸混合物(摩尔比为2∶1)诱导LO2细胞发生氧化应激。首先采用CCK-8法检测0.4 mmol/L脂肪酸和不同浓度的OEA对细胞活性的影响,结果见表2。表2中空白组为仅添加0.1% DMSO和0.4% BSA的LO2细胞,对照组为添加0.1% DMSO和0.4 mmol/L脂肪酸混合溶液的LO2细胞(下同),实验组为添加0.4 mmol/L脂肪酸混合溶液和不同浓度OEA的LO2细胞。由表2可知,0.1~10 μmol/L的OEA处理24 h后对细胞活性无明显影响,25 μmol/L和50 μmol/L的OEA则使细胞活性分别降至空白组的93.42%和82.27%。通常认为活性高于90%对细胞不具有明显的毒性影响[12],因此选择0.1~25 μmol/L的OEA进行后续实验。
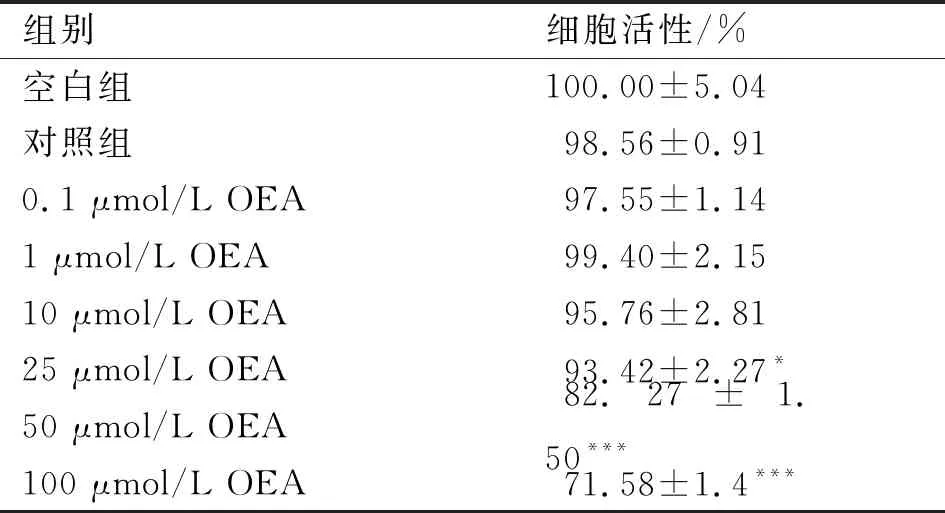
表2 不同浓度OEA对LO2细胞活性的影响
2.2 OEA对细胞内ROS和MDA含量的影响
研究表明,过量的氧化应激可能导致线粒体呼吸异常和功能障碍,最终导致NAFLD发展[12]。因此,调节氧化应激和相应的抗氧化酶对治疗NAFLD是非常重要的。按照1.2.4方法测定不同组别细胞内荧光强度,以荧光强度表示细胞内ROS水平,得到不同浓度OEA对LO2细胞ROS含量的影响,结果见表3。不同浓度OEA对细胞MDA含量的影响见表4。

表3 不同浓度OEA对LO2细胞ROS含量的影响

表4 不同浓度OEA对细胞MDA含量的影响
由表3可知,0.4 mmol/L脂肪酸显著增加了细胞内ROS含量,OEA处理以浓度依赖性方式降低了由脂肪酸引起的ROS生成。
由表4可知,0.4 mmol/L脂肪酸显著增加了细胞内MDA含量,而OEA处理表现出显著的抑制作用。
2.3 OEA对细胞内抗氧化酶活性的影响(见表5)
由表5可知,相比于空白组,0.4 mmol/L脂肪酸处理显著降低了细胞内SOD、CAT和GPx的活性,而OEA处理后,细胞内抗氧化酶活性均以浓度依赖性方式增加。这些数据表明OEA能够显著抑制脂肪酸导致的抗氧化酶活性下降,增强细胞抗氧化能力。

表5 不同浓度OEA对细胞3种抗氧化酶活性的影响 U/mg
2.4 OEA对氧化应激相关蛋白和基因的影响
为了研究OEA改善氧化应激的作用机制,利用蛋白免疫印迹和RT-qPCR检测了氧化应激关键调节因子(Nrf2和HO-1)的水平,结果分别见图1、图2。由图1可知,与仅0.4 mmol/L脂肪酸处理的LO2细胞相比,OEA处理的细胞Nrf2和HO-1蛋白水平随OEA浓度增大而显著上升。由图2可知,在OEA处理的细胞中,Nrf2和HO-1 mRNA的表达也在增加。这些结果表明,对于脂肪酸诱导的LO2细胞氧化应激,OEA处理可通过激活抗氧化关键调节因子Nrf2和HO-1来增强细胞抗氧化能力。
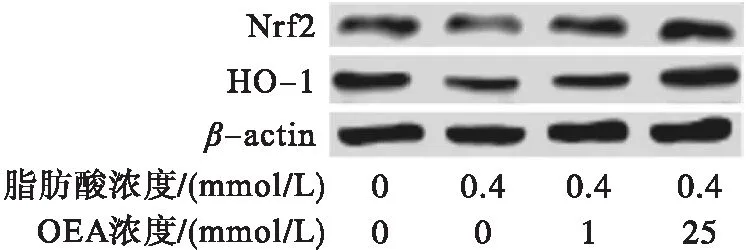
注:与空白组相比,#p<0.05,##p<0.01;与对照组相比,*p<0.05,**p<0.01,***p<0.001。下同。

图2 不同浓度OEA对抗氧化相关基因表达的影响
2.5 讨论
NAFLD是一种以肝脂肪变性为特征的慢性肝病,尽管其发病机制尚未完全了解,但氧化应激在NAFLD从单纯性脂肪变性到NASH的进展中起着关键作用[13]。过量的ROS会诱发线粒体功能障碍,从而加重脂肪变性和肝损害,甚至导致肝脏发炎。因此,抑制肝脏氧化应激可用于预防和治疗NAFLD。本研究探究了OEA对脂肪酸诱导的LO2细胞氧化应激的影响。首先通过CCK-8法选择OEA作用浓度,结果表明在0.4 mmol/L脂肪酸诱导的LO2细胞中,0.1~25 μmol/L的OEA不会对细胞产生明显毒性作用。
很多证据表明ROS在氧化应激中发挥关键作用[14]。MDA是脂质过氧化的最终产物之一,被用作细胞和组织氧化损伤的指标。实验结果表明,0.4 mmol/L脂肪酸诱导细胞内ROS水平上升,并进一步促进MDA产生,OEA处理以浓度依赖性方式逆转了脂肪酸引起的上述效应,这与先前在体外人脐静脉内皮细胞损伤模型中的研究结果相似[8]。Nrf2是关键的抗氧化应激转录因子,激活状态下Nrf2移位进入细胞核,诱导各种抗氧化酶的转录以消除ROS,发挥抗氧化作用[15-16]。本研究结果显示,脂肪酸诱导的LO2细胞内Nrf2和HO-1蛋白及mRNA水平较空白组显著降低,OEA通过上调这两种基因和蛋白的表达,提高细胞内3种重要抗氧化酶(SOD、CAT和GPx)的活性,从而抵抗脂肪酸诱导的应激状态。
总之,OEA可激活与氧化应激相关的转录因子,进而提高抗氧化酶及降低细胞内ROS和MDA水平,从而显著抑制细胞内因脂肪酸诱导的氧化应激。本研究可以为与氧化应激相关疾病的治疗提供一定的科学依据。
3 结 论
0.4 mmol/L的脂肪酸混合物(油酸和棕榈酸摩尔比2∶1)和0.1~25 μmmol/L OEA均对LO2细胞无明显毒性作用,而当OEA浓度增大到50 μmmol/L时,细胞活性低于90%,因此选择0.1~25 μmmol/L作为后续处理的OEA浓度。OEA能够抑制脂肪酸诱导的活性氧生成增加,并且能降低细胞内MDA含量。此外,OEA还能够通过增强细胞抗氧化酶活性来提高细胞抵御脂肪酸的能力。进一步研究发现,OEA通过激活抗氧化关键调节因子Nrf2和HO-1来增强细胞抗氧化能力。
