11种植物油的脂肪酸组成与抗氧化活性比较
2020-10-15刘晓谦梁曜华冯伟红杨立新王智民
刘 颖,刘晓谦,梁曜华,冯伟红,杨立新,李 春,王智民
(1.天津中医药大学 中药学院,天津 300193; 2.中国中医科学院中药研究所 中药质量控制技术国家工程实验室,北京 100700)
随着经济的发展,人民生活水平不断提高,居民在选择生活必需品如食用油时已不仅仅停留在安全卫生的水平,而是更加注重其健康与营养性[1]。为响应这种需求,市场上研发了多种新资源食品油。新资源食品是指在中国新研制、新发现、新引进的无食用习惯的,符合食品基本要求,对人体无毒无害的物品[2]。截至2017年卫生部已批准的新资源食品中,可归属于植物油的有14种,现在市场上备受大家推崇的是美藤果油、牡丹籽油、杜仲籽油和茶叶籽油4种[3-6]。除此之外,2种在西方国家食用历史悠久的牛油果油和橄榄油[7-8]在市场上也大受欢迎。而在我国居民消费中,消费比例最大的5种植物油分别是花生油、大豆油、玉米油、葵花籽油和菜籽油[5]。这些油之间的品质差异至今未见相关的系统研究。
植物油的品质主要通过化学成分组成和理化性质两方面来评价。化学成分以脂肪酸组成和其他微量成分含量来评价[9],理化性质方面则依据植物油的酸价、碘值、过氧化值、抗氧化能力来判断,其中抗氧化活性是评判植物油品质的一个重要指标[10]。因此,本文拟以上述11种植物油为研究对象,通过脂肪酸组成和抗氧化活性两方面评价其质量,以期为国人选择食用植物油提供参考依据。
1 材料与方法
1.1 试验材料
杜仲籽油胶囊(河南省许昌市鄢陵县杜仲森林基地);印奇美藤果油;北京同仁堂牡丹籽油;千岛源茶叶籽油;西班牙佰多力橄榄油;墨西哥CHOSEN FOODS牛油果油;中粮原香花生油;多力葵花籽油;金龙鱼玉米油、大豆油和菜籽油。
1,1-二苯基-2-三硝基苯肼(DPPH,LOT:W27F10E81251)、2,2′-联氮-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS,LOT:K18N8M48402)、2,4,6-三吡啶基三嗪(TPTZ,LOT:M19M7E14190)、6-羟基-2,5,7,8-四甲基苯并二氢吡喃-2-羧酸(Trolox,LOT:S08J10N79226)和14%三氟化硼-甲醇溶液(BF3-CH3OH,LOT:H06J10X90055),上海源叶生物有限公司;FeSO4·7H2O,FeCl3·6H2O;甲醇和乙腈为HPLC级,美国 Fisher 公司;三水合乙酸钠、无水乙酸钠、氢氧化钠、乙酸乙酯、甲醇、冰乙酸、盐酸等均为分析纯。
Agilent 7890A/5975C型气相色谱-质谱联用仪;HH-2数显恒温水浴锅;可调微量移液器,德国Eppendorf公司;Multiskan Go1510型酶标仪,美国Thermo Fisher公司;96孔板,美国Thermo Fisher公司;XS105DU型天平(精度0.01 mg)、XSE104型天平(精度0.1 mg),瑞士梅特勒-托利多公司。
1.2 试验方法
1.2.1 11种植物油脂肪酸组成分析
1.2.1.1 脂肪酸甲酯的制备
参照GB 5009.168—2016方法并略加改动。称取植物油样品0.1 g,加入2%NaOH甲醇溶液8 mL,水浴回流至油滴消失,然后加入7 mL 14%三氟化硼-甲醇溶液,再回流2 min后取下烧瓶迅速冷却至室温。向烧瓶中准确加入10 mL正庚烷振荡2 min,再加饱和NaCl水溶液适量,静置分层。取上层溶液于试管中,加入5.0 g无水Na2SO4固体,振摇后静置,取上清液进行分析。
1.2.1.2 气相色谱-质谱条件
气相色谱条件:Agilent DB-WAX 122-7032毛细管色谱柱(30 m×250 μm×0.25 mm);柱流量1.0 mL/min;柱升温程序为初温50℃,保持1 min,以25℃/min的速率升温到200℃,然后以3℃/min至230℃,保持12 min;载气为高纯氦气;进样口温度250℃;分流进样,分流比25∶1。质谱条件:电离方式 EI,电子能量70 eV,离子源温度230℃,四级杆温度150℃,质量扫描范围 (m/z) 50~550,溶剂延迟时间4 min。
1.2.2 样品溶液及工作液的制备
1.2.2.1 供试品溶液的制备
全油样品的制备:称取4.0 g植物油样品,用乙酸乙酯配制成质量浓度为0.4 g/mL溶液作为母液,取母液加乙酸乙酯稀释成质量浓度分别为0.3、0.2、0.15、0.1、0.05 g/mL的工作液,备用。
极性萃取液的制备:称取5.0 g植物油样品,精密加入5 mL甲醇,振荡混匀,3 000 r/min离心15 min,取上层清液,沉淀按照上述方法连续萃取4次,合并萃取液,甲醇定容至25 mL,备用。
1.2.2.2 DPPH工作液的制备[11]
精密称取DPPH 10.04 mg,用乙酸乙酯溶解并定容至25 mL容量瓶,配制成质量浓度为0.4 mg/mL 的DPPH溶液,避光保存备用,现用现配。
1.2.2.3 ABTS工作液的制备[12]
0.02 mol/L醋酸盐缓冲液的配制:精密称取295 mg无水乙酸钠,加0.37 mL冰乙酸溶解,再加蒸馏水定容至500 mL,配成浓度为0.02 mol/L的醋酸盐缓冲液。
ABTS溶液的制备:精密称取38.41 mg ABTS,用0.02 mol/L醋酸盐缓冲液溶解并定容至10 mL容量瓶中,配成浓度为7 mmol/L的 ABTS溶液。
过硫酸钾溶液的制备:准确称取过硫酸钾66.24 mg,加0.02 mol/L醋酸盐缓冲液溶解并定容至100 mL,配成浓度为2.45 mmol/L的过硫酸钾溶液。
ABTS工作液的制备:将5 mL 7 mmol/L的ABTS溶液和5 mL 2.45 mmol/L的过硫酸钾溶液混合,黑暗中常温静置反应12~16 h备用。使用前,用0.02 mol/L醋酸盐缓冲液稀释至在734 nm波长下的吸光度为0.700±0.002,现用现配。
1.2.2.4 FRAP工作液的制备[13-14]
0.3 mol/L醋酸盐缓冲液的配制:精密称取1.36 g三水合乙酸钠,加8 mL冰乙酸溶解,再加蒸馏水定容至500 mL,配成浓度为0.3 mol/L的醋酸盐缓冲液。
TPTZ溶液的配制:精密称取TPTZ 31.20 mg,用40 mmol/L的HCl溶解并定容到10 mL容量瓶中,配成浓度为10 mmol/L的TPTZ工作液。
FeCl3溶液的配制:精密称取FeCl3·6H2O 54.10 mg,加蒸馏水溶解并定容到10 mL容量瓶中,配成浓度为20 mmol/L 的FeCl3溶液。
FRAP工作液的制备:分别量取50 mL 0.3 mol/L醋酸盐缓冲液、5 mL 10 mmol/L TPTZ工作液、5 mL 20 mmol/L FeCl3溶液,混合摇匀,避光保存备用, 现用现配。
1.2.3 11种植物油抗氧化活性测定
1.2.3.1 DPPH法
参照 Mukazayire等[11]的方法并略加改动。于96孔板中依次加入100 μL DPPH工作液和100 μL不同质量浓度的全油样品溶液,平行操作两组,混匀,室温下避光静置30 min,空白组用甲醇代替DPPH工作液,对照组用甲醇代替样品溶液,于517 nm处测定吸光度,分别记为A样、A空、A对。计算DPPH·清除率:DPPH·清除率= [1- (A样-A对)/A空]×100%。应用SPSS17.0软件进行数据处理,结果以IC50值表示。以质量浓度为0.01~0.1 mg/mL的Trolox乙酸乙酯溶液为阳性对照。
1.2.3.2 ABTS法
参考Ozgen 等[15]的测定方法进行。于96孔板中依次加入200 μL ABTS工作液和10 μL不同植物油的极性萃取液,对照组用甲醇代替样品溶液,于30℃反应20 min,室温下测定734 nm波长处的吸光度,分别记为A0和A1。计算ABTS+·清除率:ABTS+·清除率=(A1-A0)/A1×100%。同时配制质量浓度为0.20 mg/mL(799 μmol/L)的Trolox甲醇溶液,并稀释成质量浓度分别为0.15 mg/mL(599 μmol/L)、0.075 mg/mL(300 μmol/L)、0.05(200 μmol/L)、0.037 5 mg/mL(150 μmol/L)的系列溶液,按上述方法测定不同浓度 Trolox溶液(X)对ABTS+·的清除率(Y),绘制量效曲线,得到的线性回归方程为Y= 0.111 3X+0.216 3,R2= 0.999 1。将11种植物油极性萃取液对ABTS+·的清除率代入方程,得到该清除率所相当的Trolox的浓度,结果以ABTS+·清除率对应的Trolox当量值表示(单位:μmol/100 g)。
1.2.3.3 FRAP法
参考Zhang等[16]的测定方法并略加改动。于96孔板中精密加入20 μL甲醇与180 μL FRAP工作液混合作为空白对照组,以20 μL各植物油极性萃取液与180 μL FRAP工作液混合为样品组,于37℃孵育反应10 min后593 nm测定吸光度。同时配制成质量浓度为0.375 mg/mL(1 498 μmol/L)的Trolox甲醇溶液,并稀释成质量浓度分别为0.300 mg/mL(1 199 μmol/L)、0.225 mg/mL(899 μmol/L)、0.150 mg/mL(599 μmol/L)、0.075 mg/mL(300 μmol/L)、0.037 5 mg/mL(150 μmol/L)的系列溶液,按上述方法测定不同浓度Trolox溶液(X)与FRAP工作液反应后的吸光度(A),绘制量效曲线,得到的线性回归方程为A=0.000 9X+0.014 4,R2=0.999 3。根据11种植物油与FRAP工作液反应后的吸光度,在量效曲线上求出其对应的Trolox浓度,结果以还原能力对应的Trolox当量值表示(单位:μmol/100 g)。
2 结果与讨论
2.1 11种植物油的脂肪酸组成(见表1)
由表1可以看出,在脂肪酸种类上,菜籽油、牡丹籽油中脂肪酸种类最多,前者仅未检测到十七碳烯酸,后者未检测到木蜡酸,茶叶籽油的脂肪酸类型最少,为11种。花生油、大豆油、葵花籽油和玉米油中所含的脂肪酸类型完全相同。
从脂肪酸含量上看,新资源食品油(除茶叶籽油外)中多不饱和脂肪酸含量更高,且饱和脂肪酸含量明显低于除菜籽油外其他7种植物油。美藤果油、杜仲籽油、牡丹籽油、葵花籽油、大豆油、玉米油中以多不饱和脂肪酸为主,而茶叶籽油、橄榄油、牛油果油和菜籽油的单不饱和脂肪酸含量占很大比例。所有样品中,杜仲籽油亚麻酸的含量最高,其次是美藤果油、牡丹籽油。
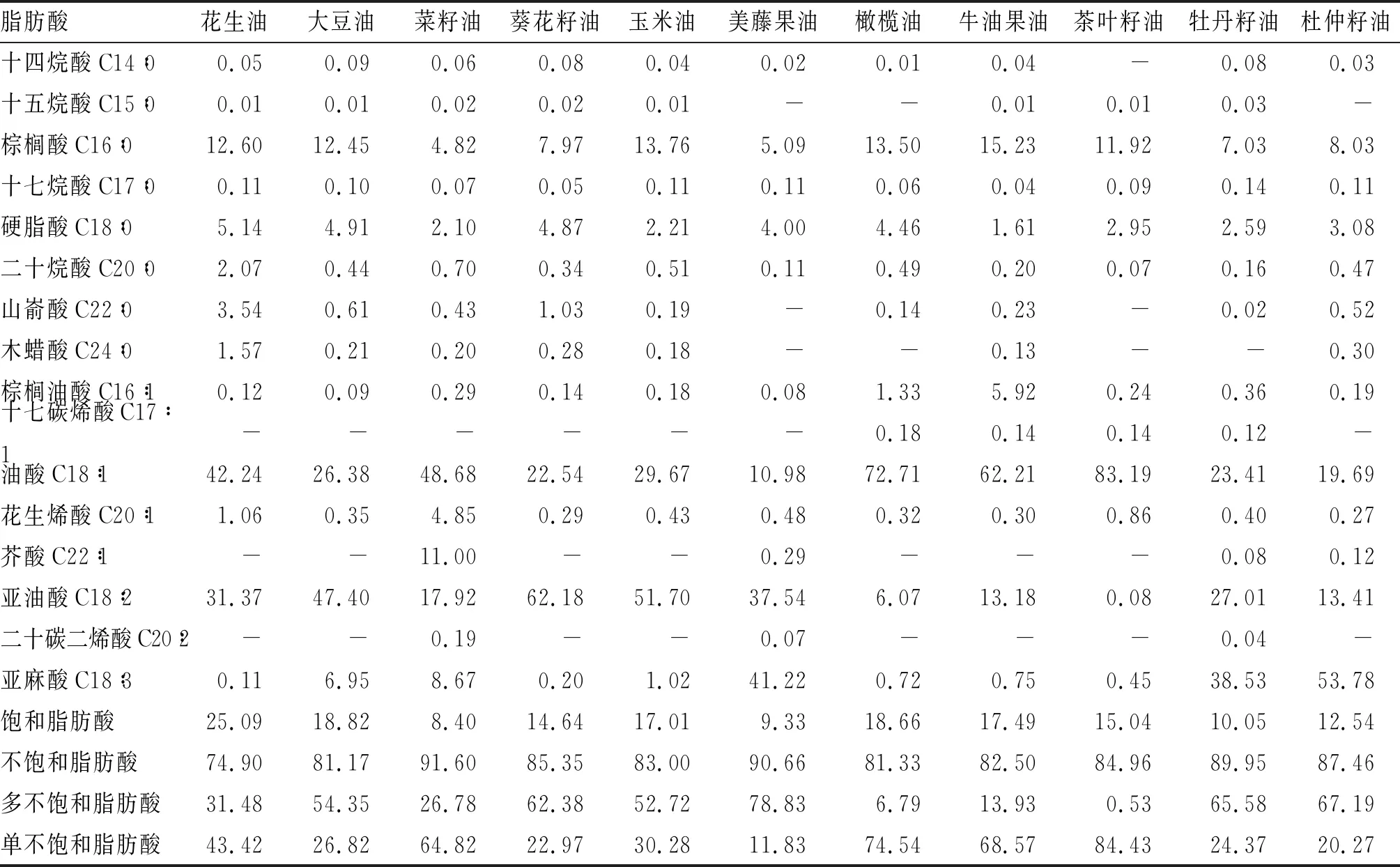
表1 11种植物油中主要脂肪酸组成及含量 %
2.2 11种植物油的抗氧化活性
2.2.1 DPPH试验(见表2)

表2 11种植物油全油对DPPH·的清除能力 (g/mL)
IC50值越小,表明对DPPH·的清除能力越好。由表2可看出,11种植物油对DPPH·的清除能力从大到小排序为杜仲籽油>美藤果油>玉米油>大豆油>葵花籽油>牡丹籽油>菜籽油>橄榄油>牛油果油>花生油>茶叶籽油。
2.2.2 ABTS试验(见图1)

图1 植物油极性部位对ABTS+·清除能力
Trolox当量值越大,样品对ABTS+·清除能力越好。由图1可以看出,11种植物油对ABTS+·的清除能力从大到小依次为橄榄油>菜籽油>杜仲籽油>大豆油>玉米油>美藤果油>花生油>牛油果油>茶叶籽油>牡丹籽油>葵花籽油。其中橄榄油和菜籽油的ABTS+·清除能力较高,可能与橄榄油和菜籽油中含有较多的多酚类物质有关[17]。
2.2.3 FRAP试验(见图2)
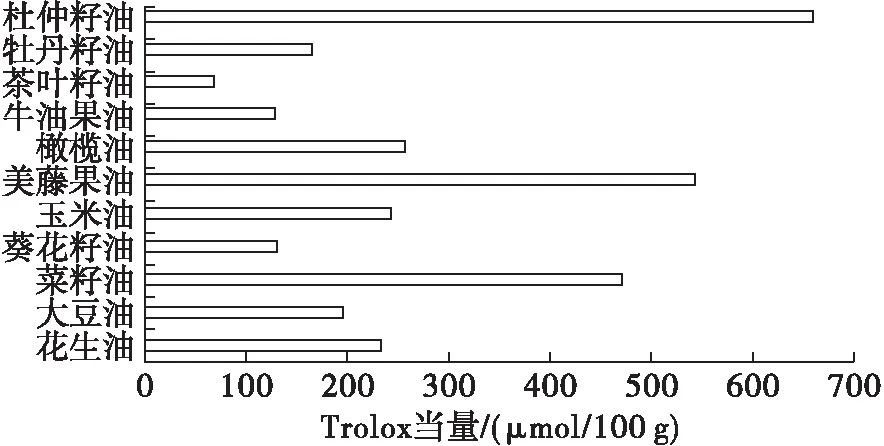
图2 植物油极性部位对Fe3+-TPTZ还原能力
Trolox当量值越大,样品对Fe3+-TPTZ的还原能力越强。由图2可看出,11种植物油对Fe3+-TPTZ还原能力的Trolox当量从高到低依次为杜仲籽油>美藤果油>菜籽油>橄榄油>玉米油>花生油> 大豆油>牡丹籽油>葵花籽油>牛油果油>茶叶籽油。
2.3 讨论
采用3种经典的抗氧化试验进行11种植物油抗氧化能力比较时,试验初期全部采用全油进行,结果发现其用于ABTS法和FRAP法试验时的测定值极不稳定,无法重复,分析原因可能与油水不互溶有关[18-19]。鉴于植物油的许多微量活性成分存在于其极性部位中[18],故选择甲醇萃取全油的极性成分用于ABTS和FRAP试验,结果发现效果良好。因此,本研究最终选择不同浓度的全油乙酸乙酯溶液用于DPPH试验,而各植物油的甲醇萃取物用于ABTS和FRAP试验,以达到相同自由基清除率或吸光度相当的Trolox的量表示其自由基清除能力。在抗氧化试验中,许多文献所使用的样品和工作液比例不一,导致最后的结果不同。本研究考察了抗氧化试验中不同比例的样品和工作液,选择能够反应完全,吸光度在合适范围内,量效曲线的相关系数好的比例作为本试验中工作液和样品的比例,最后所有样品在相同条件下进行试验。
3种抗氧化试验评价出的各植物油的抗氧化能力的排序有所不同,一是因为DPPH试验的样品为全油,而ABTS和FRAP试验的样品为植物油甲醇萃取物;二是不同植物油中微量成分的含量不一,植物油中的微量成分主要有植物甾醇、多酚、维生素E等,这些成分具有较好的抗氧化性,如黄健花等[17]研究发现,ABTS+·清除能力与植物油多酚含量在P<0.01水平上显著相关,DPPH·清除能力和FRAP法Fe3+-TPTZ还原能力与植物油多酚含量、生育酚含量均在P<0.05水平上显著相关。由试验结果可知,植物油的抗氧化活性强弱与不饱和脂肪酸含量有一定的关系,但并不完全正相关,提示我们在今后的研究中,要同样重视植物油中的不饱和脂肪酸和微量成分的组成和含量,使评价更加客观全面。
3 结 论
大部分新资源食品油在脂肪酸组成和抗氧化能力方面,都有其独特的优势,人体必需不饱和脂肪酸超过其他食用油,极具食用和保健价值。建议有条件的家庭和一些身体有特殊需要的人群可增加新资源食品油的摄入,如杜仲籽油等。大部分普通居民在选择常见的食用油时,可以考虑菜籽油、葵花籽油、玉米油等普通食用油。
