巨细胞病毒肝损害患儿外周血IL-17、IL-35与Th17/Treg的表达及临床意义
2020-10-15杨泽民张阵王文辉冷建刚刘虎桑旭
杨泽民,张阵,王文辉,冷建刚,刘虎,桑旭
巨细胞病毒感染是常见病毒感染性疾病之一,其病原体是人巨细胞病毒(HCMV),婴儿的免疫系统相对低下,属易感人群。HCMV可造成全身各个系统的损害,肝脏是婴儿期最易受到损害的器官之一。HCMV导致的肝功能损害主要的临床表现有肝功能异常、肝脾肿大和黄疸,主要是由免疫、遗传、环境等许多方面因素造成的[1]。目前,HCMV发病机制尚不十分清楚,一方面与病毒直接感染导致的,另一方面可能与机体免疫应答相关。HCMV感染一般为慢性感染,期间存在着免疫功能紊乱,是多种细胞因子和相关免疫细胞共同作用的免疫应答过程,其中CD4+T细胞尤为重要。研究发现[2],CD4+CD25+调节性T细胞(CD4+CD25+regulatoryT cells,Treg)与IL-17A的CD4+T 细胞(helper T cells 17,Th17),不同于传统的Th1/Th2细胞应答模式,IL-35在抑制Treg细胞免疫中发挥着重要作用。关于巨细胞病毒感染合并肝功能损害后IL-17、IL-35及Th17/Treg 比例变化在国内外研究甚少。本资料通过检测HCMV感染肝损害组、HCMV感染无肝损害组和健康组婴儿的外周血中Th17、Treg细胞比例和IL-17、IL-35含量,探讨其在HCMV合并肝功能损害中的表达及意义,为临床诊断和治疗提供依据。
1 资料与方法
1.1 一般资料 选取2019年1月—2019年12月在我院儿科确诊为巨细胞病毒感染的婴儿为研究对象,根据肝损害与否,将HCMV感染的婴儿分为肝损害组20例和无肝损害组18例。肝损害诊断依据为:2015年中华医学会肝病学分会药物性肝病学组制定的《药物性肝损伤诊治指南》[3]。另随机抽取同一时间段20例儿科保健门诊体检正常婴儿且明确排除了HCMV感染为健康组。入选标准:年龄均小于1岁;诊断标准:根据2012年中华医学会儿科学分会感染学组制定的制定的《巨细胞病毒感染诊断方案》[1],通过PCR-DNA方法检测患儿尿液,HCMV-DNA拷贝数高于正常;排除标准:排除肝炎病毒、相关呼吸道病毒、EB病毒等其他病毒感染造成的肝脏损害,排除药物性肝炎、遗传代谢性疾病、先天性畸形等。均详细告知家长本次研究的内容,取得家长同意后,签订知情同意书。3组受试婴儿一般资料比较,差异无统计学意义(P>0.05)。见表1。

表1 3组受试婴儿一般资料比较
1.2 方法
1.2.1 主要实验器材和试剂 APC-CD25抗体、CD4-BB515抗体、IL-17A-PE抗体、PE-Foxp3抗体、白细胞激活剂组合、Transcrip-tion Factor Buffer Set、人IL-17、IL-35 ELISA试剂盒均来自上海优宁维生物科技股份有限公司;COBAS-C-701全自动生化分析仪购自德国罗氏公司;BD FACSCantoTMⅡ流式细胞仪从美国BD公司购买。
1.2.2 测定外周血中IL-17、IL-35浓度 抽取婴儿2 mL外周血置于EDTA抗凝管中,以3 000 r/min的速度离心10 min,使用EP管将血清标本分装。IL-17、IL-35含量检测严格按ELISA试剂盒说明书进行。
1.2.3 尿HCMV-DNA定量、谷丙转氨酶测定 所有患儿均于入院后次日清晨、空腹状态下,抽取血清,采用全自动生化仪测定谷丙转氨酶(ALT);并充分清洗外阴后留取新鲜尿液5 mL置于无菌清洁的试管中,运用FQ-PCR方法检测尿HCMV-DNA定量。
1.2.4 检测Treg细胞和Th17细胞比例 用同等容积的PBS液稀释剩余血标本后,以1 500 r/min的速度离心20 min淋巴细胞分离液,舍弃上层清液,将2 μl白细胞激动剂与外周血单核细胞(PBMC)加至24孔板中,待均匀分布,置于37 ℃培养箱孵育4 h后离心,标记管内剩余沉渣,并向内加入50 μl的PBS液,吹打混匀,分别用2 μl CD4-BB515抗体、APC-CD25标记为Treg管及对照管,震荡摇匀以后,在避光状态下室温孵育30 min加入1 mL PBS液,离心后对照管中加入200 μl甲醛于Th 17对照管内重悬,将标本保存在4 ℃冰箱中;把1 mL细胞固定液加入Th17管中重悬,室温避光孵育1 h,注意使用Wash破膜剂固定,以1 500 r/min的速度离心5 min弃上清液,用缓冲液洗涤细胞;IL-17 A抗体及2 μl PE-Foxp3抗体用2 μl P标记后加入相关试管中,对照管加入相应的对照抗体染色,再次室温避光孵育1 h;洗涤后离心,使用流式细胞仪测定Treg细胞/Th17细胞数值。
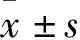
2 结果
2.1 3组受试婴儿尿HCMV-DNA定量及谷丙转氨酶指标比较 肝损害组与无肝损害组尿HCMV-DNA定量比较,差异无统计学意义(P>0.05),肝损害组与健康组比较,肝损害组高于健康组(P<0.05);肝损害组ALT指标明显高于无肝损害组和健康组(P均<0.05),无肝损害组和健康组ALT比较,差异无统计学意义(P>0.05)。见表2。

表2 3组受试婴儿尿HCMV-DNA定量和ALT分析
2.2 3组受试婴儿相关细胞因子浓度及外周血Th17细胞比例、Treg细胞比例比较 肝损害组IL-17含量、Th17所占比例、及Th17/Treg高于无肝损害组、健康组,而无肝损害组亦明显高于健康组(P<0.05)。肝损害组IL-35含量、Treg所占比例低于无肝损害组和健康组(P均<0.05),而无肝损害组IL-35值、Treg亦明显低于健康组(P<0.05)。见表3。

表3 3组受试婴儿IL-17、IL-35浓度及Th17、Treg细胞比例比较
2.3 相关性分析 IL-17含量与血清Th17所占比例呈正相关(r=0.83,P<0.05);IL-35含量与血清Treg所占比例呈正相关(r=0.62,P<0.05)。
3 讨论
巨细胞病毒感染是常见的病毒感染性疾病,在发展中国家发病率尤为显著;中国作为巨细胞病毒感染高发地区,相关文献显示孕产妇检测到的抗体的阳性率可达95%以上[4-5]。孕妇感染后,巨细胞病毒可造成宫内感染,导致死胎、宫内生长发育迟缓等,而且可使新生儿出现肝胆系统、血液系统、神经系统等多器官、多系统的损伤[6],严重损害孕产妇、胎儿及新生儿的身心健康。婴儿的巨细胞病毒感染的发生率2%左右[7-8],且缺乏特异性的临床表现,故增加了早期诊断的难度。
在全身各个器官中,肝脏是最易受到HCMV感染靶器官之一。文献显示,在婴儿肝炎综合征(IHS)中,HCMV检测阳性率可高达60%,可作为主要的病原体。HCMV多定植在肝胆管上皮及内皮细胞中,经白细胞黏附、吞噬及抗原提呈等一系列复杂的过程后,期间有多种细胞因子、免疫介质共同作用,最终发生免疫炎症反应,损害肝脏[9-10]。唾液、血液、尿液等许多途径均可排出巨细胞病毒,目前检验科多采用血液或尿液标本进行检测。ELISA试剂盒与PCR相互配合,可提高早期诊断的准确率[11-14]。
Th17细胞是由胸腺合成的辅助细胞,可以激活T细胞,分泌IL-17、IL-22和IL-23等抗炎细胞因子,参与机体的炎症反应及免疫反应,达到抵御病原微生物感染的目的[15-16]。IL-17结合相应的信号I型跨膜蛋白质受体(IL-17R)后,可诱导MAP激酶发生磷酸化,聚集大量的炎症介质,使T细胞活性增加[17]。HCMV感染后,相应的细胞分泌大量的细胞因子,活化、聚集白细胞,并激活Th17细胞产生IL-17,对炎症刺激引起的肝脏反应,有较高的参与度[18]。因此,国外学者提出当发生急性肝损害时,可选取IL-17作为标志物[19]。在本资料中,HCMV感染导致的肝脏损害的患儿,检测其外周血中IL-17含量明显高于无肝损害组和健康组,与国内外研究结果一致,所以本次实验推测IL-17可以成为HCMV引起肝脏损伤的一项参考指标。
Treg细胞是人体重要细胞亚群,具有负反馈调节免疫应答的作用,机体在遭受到病原体感染后,细胞因子(如TCF-β、IL-10等)的浓度增加,使NK细胞和T淋巴细胞等的增殖分化受到抑制。Treg细胞可以分泌与传统抗炎因子作用机制不同的新型因子,尤以IL-35为代表,其在心脑血管系统疾病、MDS、肿瘤等疾病中起到了重要免疫调控作用。IL-35既可以促进Treg细胞增殖分化,亦能够将T细胞转化成,而调节性T细胞则有着强抑制炎症反应作用,达到调控免疫应答的目的。在巨细胞病毒感染的动物模型中发现,IL-35在急性感染早期可抑制炎症反应,并在持续损伤的过程中,起到了维持细胞稳定,保护重要器官功能的作用[20]。在本资料中发现,IL-35含量和Treg细胞比例在巨细胞病毒感染引起肝脏损害后显著降低,与动物模型中的结果类似,所以,婴儿感染HCMV后,IL-35和Treg可能具有保护机体细胞和器官的作用。本资料显示,与健康组比较,肝损害组的Treg细胞比例显著降低,使Th17/Treg之间的比例失去平衡,导致IL-17含量迅速增加,加重炎症反应程度,并诱发免疫应答反应,损伤机体免疫系统功能。Treg细胞和Th17细胞关系密切,首先,二者均来自于CD4+T细胞,在IL-6浓度较高时,Treg细胞可转化形成Th17细胞;此外,Treg细胞可结合ROR-γt,可影响IL-17RNA转录效率,使Th17细胞功能降低[21]。Treg细胞、Th17细胞具有保护机体内环境及调节免疫功能等重要作用,在慢性病毒感染的患者中,Treg细胞含量增加,而在肝脏出现了明显的炎症时,Th17细胞表达增加,研究显示,重度肝脏损害时,Th17细胞浓度及IL-17含量明显升高,而在此时,Treg细胞的分化能力也显著加强,抑制免疫应答,降低肝脏损害程度[22]。而IL-35能够降低Th17细胞的功能,减少分泌IL-17,达到保护机体,避免严重免疫损伤的作用[23]。
综上所述,有很多细胞和炎症介质参与到HCMV导致肝功能损害的过程中。例如Treg细胞、Th17细胞及IL-17、IL-35等,它们之间的动态平衡在保持机体免内环境稳定和免疫调节的过程中发挥了重要的作用。相信随着研究的进一步深入,这些细胞、细胞因子及炎症介质将广泛应用于临床。
