Ⅰ群禽腺病毒FAdV-4和FAdV-8灭活疫苗的制备及免疫效果
2020-10-14张林吉李心海王玉燕任士飞张小荣吴艳涛
张林吉,迟 兰,李心海,王玉燕,任士飞*,张小荣,吴艳涛
(1.徐州生物工程职业技术学院,江苏 徐州 221006;2.扬州大学 兽医学院,江苏 扬州 225009)
鸡心包积液-肝炎综合征(HHS)又称安卡拉病,近几年在我国华北地区非常流行,其病原为Ⅰ群禽腺病毒血清4型(fowl adenovirus group Ⅰ serum type 4,FAdV-4)[1]。本病主要发生在20~60日龄的育雏鸡和育成期肉鸡,300日龄的蛋鸡也会发病。FAdV-4具有明显的致病年龄段,对雏鸡的致病力最强,死亡率可以到达100%,日龄越大死亡率越低,病毒可通过垂直传播和水平传播。本病的主要特征性病理变化是死亡鸡的心包腔积有清亮或淡黄色的水样或果冻样液体,心肌疲软。
鸡包涵体肝炎(IBH)是我国禽类养殖业中流行的一种病毒性疾病,其病原为 FAdV-Ⅰ,IBH常发生于3~7周的肉鸡,发病后3~4 d死亡率达到顶峰,1周回复到正常,死亡率在10%~30%之间[2]。澳大利亚在1998年大面积暴发IBH,流行十分严重,鸡的死亡率达到30%,经检测本次暴发流行的病原是FAdV-6,7和8型;第2年,新西兰也暴发了IBH,其致病病原为FAdV-8型[3]。FAV-8是目前最为常用的FAV载体,其致病性较低,可作为疫苗安全应用,能够刺激机体产生系统免疫和良好的黏膜免疫[4]。
HHS和IBH的病原都属于FADV-I,近年来,这2种疾病在我国养禽业的发病率呈上升趋势,造成巨大的经济损失,已严重危害我国养禽业的发展。因此,研制FAdV-4和FAdV-8安全有效的双价灭活油乳剂疫苗,评价疫苗的免疫效果和保护效果,为我国流行的HSS和IBH疫病的防控提供有效手段。
1 材料与方法
1.1 试验材料FAdV-4 SN2016株由本院实验室分离;FAdV-8标准毒株由扬州大学兽医学院吴艳涛教授惠赠;Tween-80和司本-80购自广东光华科技有限公司;甲醛购自Alfa Aesar化学品有限公司;10#药用级白油购自杭州福达物资石化有限公司;培养基购自青岛海博;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;白羽雏鸡由学院实验室自行孵化,饲养于清洁级环境;ANgni乳化机购自上海昂尼仪器仪表有限公司;FADV-Ⅰ和酶联免疫试剂盒购自Biostoneah公司。
1.2 病毒增殖条件的优化
1.2.1最佳接种剂量 取基础种子批病毒FAdV-4 SN2016为104.8,105.8,106.8,107.8和108.8TCID50/mL,FAdV-8 为103.6,104.6,105.6,106.6和107.6TCID50/mL,卵黄囊接种6~8日龄SPF鸡胚,接种量为0.1 mL/胚,收集24~120 h内死亡鸡胚的尿囊液,提取DNA,SYBR Green I实时荧光定量PCR检测方法测定尿囊液中的病毒粒子含量[5]。
1.2.2最佳收获时间 按照确定的最佳接种剂量,取基础种子批病毒FAdV-4 SN2016和FAdV-8,卵黄囊接种SPF鸡胚,37℃孵育,分别收取36,48,72,96和120 h各时间段鸡胚的尿囊液,测定尿囊液体积及病毒粒子含量。
1.3 灭活疫苗的制备
1.3.1灭活浓度和灭活时间的测定 过滤收获的尿囊液,抗原液按照3∶1比例混合。取混合抗原液分别加入终浓度为0.5,1.0,1.5和2.0 mL/L的甲醛,37℃灭活16,24和36 h。将不同灭活浓度和不同灭活时间的抗原液接种SPF鸡胚,收集尿囊液,盲传2代后收集尿囊液抽提DNA,PCR检测是否有病毒增殖,如检测结果为阴性,则表明抗原液灭活完全。
1.3.2灭活疫苗的乳化制备 灭活的混合抗原液与灭菌Tween-80按照96∶4的比例混合制备成水相;白油与司本-80按照94∶6的比例混合,加入终浓度为1%的硬脂酸铝,充分搅拌混匀,121℃高压灭菌30 min,为油相。水相和油相以1∶3的比例使用ANgni乳化机进行乳化,8 000 r/min高速匀浆3 min,间隔3 min,重复3次,即制备油乳剂灭活疫苗成品。
1.4 疫苗性状检验
1.4.1剂型检验 观察油乳剂灭活疫苗的外观,将疫苗滴入盛有室温蒸馏水的平皿表面,观察疫苗扩散情况。如呈规则圆形则为油包水剂型,若迅速散开则为水包油剂型。
1.4.2稳定性检验 取油乳剂灭活疫苗10 mL,3 000 r/min 离心15 min。观察其是否出现分层和破乳等现象。
1.4.3黏度测定 用上口径为2.7 mm,下口径为1.2 mm的玻璃吸管,记录在室温(25℃)下吸满1 mL 油乳剂灭活疫苗垂直流出0.4 mL所需的时间,重复3次取平均值。
1.4.4无菌检验 按照现行《中华人民共和国药典》的方法,将油乳剂灭活疫苗分别接种于硫乙醇酸盐培养基、酪胨琼脂培养基和葡萄糖蛋白胨培养基,分别置于25℃培养7 d和37℃培养24 h,观察有无微生物生长。同时,将疫苗接种到改良的Frey固体培养基上,37℃培养1个月,观察有无支原体生长。
1.4.5保存期检测 取3个批次的油乳剂灭活疫苗,分别保存于4,20及37℃,观察12个月。逐月定期检查疫苗是否有分层、破乳等现象。
1.5 疫苗免疫抗体水平的监测70只7日龄的白羽肉鸡分为5组。第1~4组为疫苗免疫组,每组15只;第5组为空白对照组,10羽。第1组每只免疫双价油乳剂灭活疫苗0.25 mL;第2组每只免疫灭活疫苗0.50 mL;第3组每只免疫灭活疫苗0.75 mL;第4组每只免疫灭活疫苗1.00 mL;第5组每只注射生理盐水0.5 mL。采用颈背部皮下注射,免疫前及免疫后7,14,21,28,35和42 d采血分离血清,用FADV-Ⅰ酶联免疫试剂盒检测血清中免疫抗体水平[6]。
1.6 免疫功毒保护试验160只7日龄的白羽肉鸡随机分为7组。1~3组为免疫攻毒组,采用颈背部皮下注射灭活疫苗0.5 mL;4~6组为攻毒对照组,7组为空白对照组。免疫后第22天,分别用FAdV-4 SN2016株(106.6TCID50/mL)和FAdV-8 (106.6TCID50/mL)经肌肉注射病毒液0.2 mL/只(表1)。攻毒后第3,5,7和14天采集鸡的肛门及咽喉棉拭子,PCR检测是否有排毒现象。

表1 分组免疫及攻毒情况表
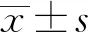
2 结果
2.1 最佳增殖条件不同接种剂量和收获时间段尿囊液的测定结果显示:FAdV-4 SN2016接种剂量为105.8TCID50/mL时,尿囊液中病毒粒子含量达到最高,为4.6×108拷贝/mL,最佳收获时间段是72~96 h,平均尿囊液收获体积为8.6 mL。FAdV-8接种剂量为105.6TCID50/mL时,尿囊液病毒粒子含量达到7.8×107拷贝/mL,最佳收获时间段是48~72 h,平均尿囊液收获体积为9.1 mL。
2.2 甲醛的最佳灭活浓度和时间将不同组别灭活后的抗原接种SPF鸡胚盲传2代,PCR检测第2代尿囊液(表2)。本试验确定的最佳甲醛灭活浓度为1.50 mL/L,37℃灭活24 h。
2.3 疫苗性状检验结果制备的油乳剂灭活疫苗为白色乳液,镜检质地均一,无颗粒状杂质,漂浮于蒸馏水表面,呈规则圆形,边缘圆滑规整,表明该制剂为油包水剂型。疫苗经3 000 r/min离心15 min后,没有出现分层、破乳现象,疫苗稳定性良好。疫苗自然垂直流出0.4 mL的平均时间为4.4 s(4.6,4.5,4.1 s),符合油乳剂灭活疫苗的黏度要求(2~8 s)。将油乳剂灭活疫苗接种到各培养基,经培养后无细菌、霉菌及支原体等微生物生长,疫苗无菌检验合格。将灭活疫苗分别保存于4,20及37℃不同储存温度下,结果表明,疫苗在4℃保存下疫苗稳定,保存期可达12个月;20℃保存下,8个月出现分层析出现象,保存期为7个月;37℃保存下,2个月即出现分层析出现象。
2.4 疫苗免疫抗体水平的监测结果免疫后7~21 d,免疫组抗体水平逐渐升高,免疫组的抗体水平在第21~28 d达到峰值,然后抗体水平开始缓慢降低,至免疫后42 d时依然维持在较高水平。从14 d开始,免疫组与空白对照组的抗体水平存在显著性统计学差异(P<0.01);免疫组1和免疫组2,3,4在免疫后的21~42 d抗体水平存在统计学差异(P<0.05),免疫组2,3,4免疫后的抗体水平未见统计学差异(图1)。
2.5 免疫功毒保护试验结果观察鸡群临床表现,3个免疫攻毒组的雏鸡在攻毒后2 d左右出现短暂的食欲降低和精神沉郁,但未表现出HHS和IBH的临床症状且很快恢复正常。免疫攻毒组2在攻毒后第5天有2只鸡出现临床症状并死亡,其他免疫攻毒组鸡没有出现死亡。攻毒对照组4,5,6在攻毒后5 ~ 10 d内全部死亡。空白对照组未见临床症状,全部存活。
PCR检测结果显示,免疫攻毒组仅有少量雏鸡出现排毒现象(表3),攻毒对照组在攻毒后的3~5 d 出现排毒现象,7 d到达峰值,经呼吸道排毒的时间和高峰期要早于消化道,但病毒经消化道排毒较呼吸道严重。
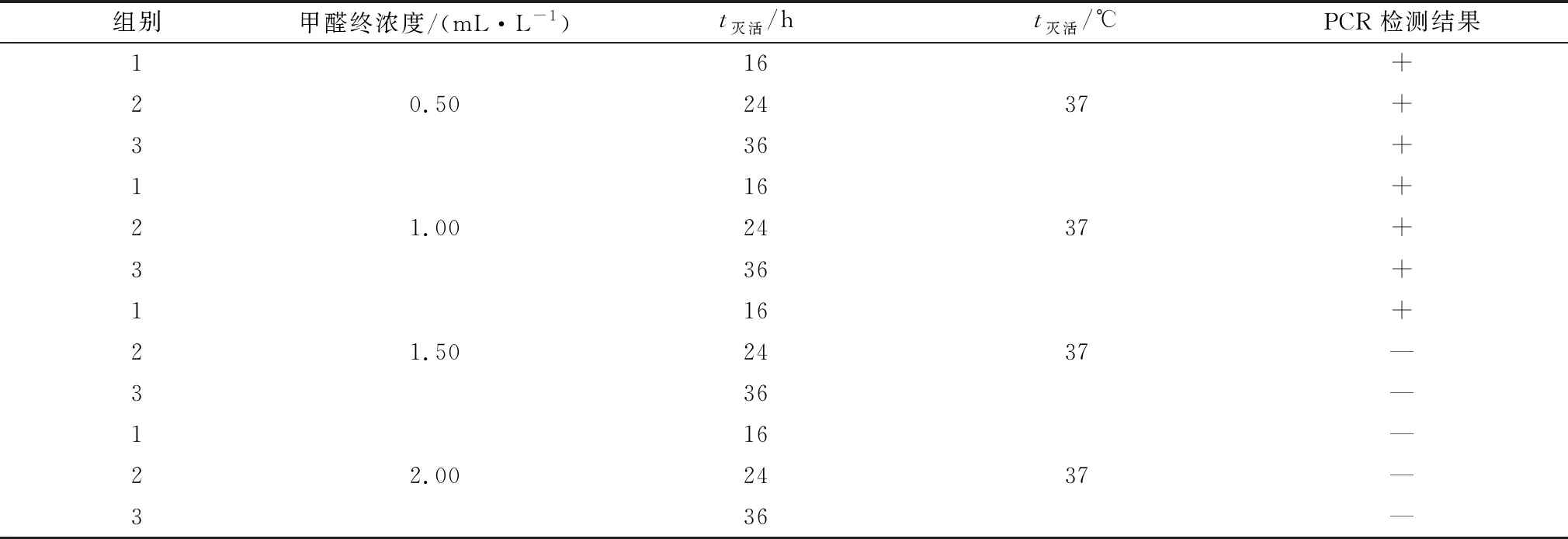
表2 最佳灭活浓度和灭活时间测定结果

图1 免疫抗体水平ELIA检测结果 注:与空白对照组比较,**P<0.01;免疫组间比较#P<0.05
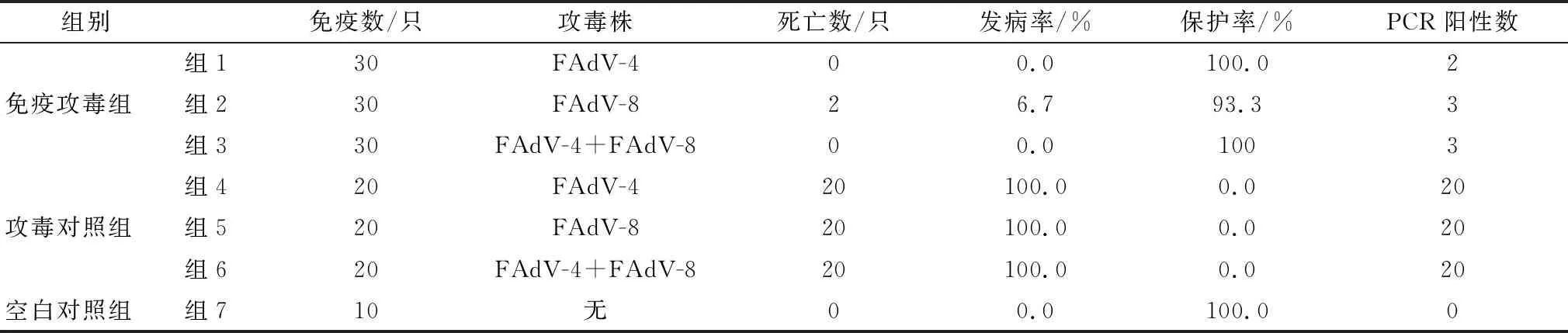
表3 免疫攻毒试验结果
3 讨论
目前国内未见任何可用于预防FADV-Ⅰ的商品化疫苗,常规治疗方法对临床发病鸡效果不理想,导致对FADV-Ⅰ的防控存在漏洞。因此,本研究制备的油乳剂灭活双价疫苗具有重要的应用价值。
甲醛是国内兽用灭活疫苗最为常用的一种灭活剂,具有成本低、灭活效果好等优点,但也存在对机体刺激性大,本身带有毒性,易导致动物甲醛中毒。所以,在灭活病毒时建议灭活使用浓度不要超过1.50 mL/L,与赵勐尧等[7]研究结果一致。可进一步研究甲醛去除技术,或使用更有效的灭活剂。β-丙内酯(BPL)是目前国外广泛使用的灭活剂,对病毒具有很强的灭活作用,直接作用于病毒的核酸,保持蛋白的免疫原性,极易水解,且水解产物无毒无害刺,接种反应轻,后续研究将探究BPL的灭活浓度及时间,优化病毒的灭活方法[8]。
本研究制备的油乳剂灭活疫苗能很好的诱导鸡产生的较高免疫抗体水平。从抗体变化趋势中可以看出,4个免疫剂量组,在免疫后21 d左右,抗体水平达到最高,至免疫后42 d,抗体水平依然维持在较高水平。本试验结果与韦悠等[9]报道的结果基本一致。对不同免疫剂量组数据分析,可以看出免疫抗体水平不随着剂量的增加而呈现倍比增加,说明过多的抗原亦不能使鸡体产生更多的抗体,而被机体分解代谢,造成抗原的浪费和费用的增加。本研究制备的油乳剂灭活疫苗免疫鸡群能够有效增强机体的体液免疫,但对是否能够增强机体的细胞免疫还需要做进一步研究。而且该疫苗在蛋鸡上的应用,还需要对免疫程序等进行研究优化以达到最佳免疫保护效果。
根据免疫攻毒保护试验结果,该疫苗能够有效的抵抗单个或双病毒的攻击,临床保护率达100%。MYEONG等[10]研究表明,FAdV-4灭活疫苗能提供对多种血清型FAdV的交叉防护。虽然免疫攻毒组2有2只鸡出现了临床症状并死亡,临床保护率为93.3%,没有实现完全保护,推测可能是由于灭活疫苗中FAdV-8抗原剂量偏低,抗原混合液是按照3∶1比列配制,从而导致机体抗体水平不能产生完全保护。胡亚歌等[11]研究结果显示,雏鸡在免疫血清4型和8b型FADV-Ⅰ二价油乳剂灭活疫苗后,用FAdV-8b QD2016株病毒攻击,雏鸡没有出现全部死亡,两者的研究结果基本一致。
排毒检测结果显示,疫苗虽然能很好的产生保护率,却不能完全阻断病毒的侵袭和排毒现象,可能与病毒感染途径有关,自然感染主要以呼吸道和消化道为主,而试验采用的是肌肉注射。有文献报道鸡群在感染FAdV-8b后会出现严重的排毒现象,本试验结果与文献报道基本相符[12-13]。
本研究选用实验室分离的FAdV-4 SN2016株和FAdV-8标准株研制二价油乳剂灭活疫苗,4℃的保存期可达12个月,能有效的增强机体的体液免疫,免疫保护期在6周以上,对FAdV-4 SN2016和FAdV-8的攻击免疫保护率为100%,对FAdV-8的攻击免疫保护率可到达90%以上。FADV-Ⅰ已经确定的血清型有12种,血清型比较复杂。由于不同地区、不同时间流行的毒株和血清型存在差异,该疫苗对其他血清型的防控效果还需要进一步的临床试验得以验证。
