5种分子伴侣对水貂阿留申病毒核衣壳蛋白VP2部分基因可溶性表达的影响
2020-10-14朱言柱吕甜甜
柏 玲,朱言柱,潘 悦,吕甜甜,张 蕾*
(1.中国农业科学院 特产研究所 农业部经济动物疫病重点实验室,吉林 长春 130112;2.吉林大学 人兽共患病研究所 人兽共患病教育部重点实验室,吉林 长春 130112)
水貂阿留申病(Aleutian disease,AD)是由水貂阿留申病毒(Aleutian disease virus,ADV)引起的一种免疫抑制性疾病[1-2]。AD依病毒的种类和宿主的年龄而感染情况不同,新生仔貂感染因患急性肺炎死亡,成年水貂多呈现带毒慢性感染,成年母貂多呈现空怀、流产,感染公貂的毛皮质量差[3],该病是水貂养殖业的三大疫病之一。目前,无疫苗防控此病,每年打皮期诊断筛查淘汰病貂是防控该病的重要手段。
ADV是细小病毒科、细小病毒亚科、阿留申病毒属成员[4]。ADV全长4.8 kb,ADV基因组主要有2个开放阅读框(ORF):L-ORF和R-ORF。L-ORF编码3种非结构蛋白(NS1、NS2、NS3),R-ORF编码2种结构蛋白(VP1和VP2)[5-7]。VP2是主要的结构蛋白,VP2占病毒衣壳的90%[8-9]。疫苗是防控疫病的重要手段,但是由于抗体依赖性感染增强(ADE)作用,不能通过常规减毒和灭活的方法制备ADV疫苗,国内外学者尝试通过基因工程方法制备新型疫苗,但目前尚无有效的疫苗问世。BLOOM等[10]发现VP2蛋白428~446 aa及487~501 aa为抗原抗体复合物主要的结合位置,介导ADE作用。分子伴侣蛋白是一类可将错误折叠蛋白去折叠、降解、标记从而维持蛋白质内稳态的一类蛋白质[11-12]。本研究通过分子克隆构建pET-30a-M原核表达质粒,尝试改变温度及IPTG浓度增加可溶性蛋白表达量,但效果不显著,为了尝试改变蛋白的表达状态,将分子伴侣pG-KJE8、pGro7、pKJE7、pG-Tf2、pTf16与pET-30a-M共表达,期待促进外源蛋白在原核细胞中正确折叠,增加外源蛋白的溶解性,以期获得大量可溶性蛋白,进而探究该蛋白的生物学功能。
1 材料与方法
1.1 主要材料与试剂pVAX1-M质粒、pET-30a(+)表达载体质粒、ADV阳性血清为本实验室保存;DH5α感受态细胞、Prime STAR Max Polymerase高保真酶和Chaperpone Plasmid Set 购自TaKaRa公司;Easy-Blunt Zero Cloning Vector、DNA Marker、IPTG、氯霉素(Cm)、卡那霉素(Kana)、四环素(Tetracycline)、BL21(DE3)感受态细胞、ECL显色液和蛋白Marker(14 000~10 000)购自北京全式金生物技术有限公司;质粒小量提取试剂盒和凝胶回收试剂盒购自Axygen公司;LB培养基购自生工生物工程(上海)股份有限公司;T4连接酶、限制性内切酶EcoRⅠ、XhoⅠ和蛋白Marker(15 000~180 000)购自Thermo Fisher有限公司;硝酸纤维素膜购自武汉博士德生物工程有限公司;考马斯亮蓝染色剂、脱色剂和聚丙烯酰胺凝胶配置试剂盒购自碧云天公司;可溶性蛋白纯化试剂盒购自康为世纪公司;Mouse anti-6×His tag antibody购自Abcam公司;山羊抗小鼠HRP-IgG、山羊抗猫HRP-IgG购自KPL公司。
1.2 引物设计与合成根据本实验室保存的含ADV核衣壳蛋白VP2部分基因的真核表达质粒pVAX1-M,设计原核表达引物,依据原核表达载体pET-30a(+)序列,在上游引物5′端添加酶切位点EcoRⅠ,在下游引物5′端添加酶切位点XhoⅠ,引物交由上海生工生物公司进行合成(表1)。
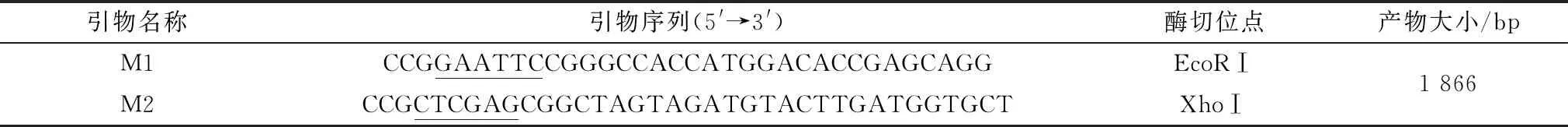
表1 引物序列
1.3 重组表达质粒pET-30a-M构建
1.3.1核衣壳蛋白VP2部分基因扩增 以含ADV核衣壳蛋白VP2部分基因的pVAX1-M质粒为模板,利用M1、M2引物扩增VP2部分基因。PCR反应体系:PrimeSTAR Max Polymerase,上下游引物各0.2 mmol/L 1.5 μL,模板50 ng,ddH2O补齐至50 μL。PCR扩增程序为:95℃预变性10 min,95℃变性45 s,55℃退火45 s,72℃延伸1 min,35个循环;72℃延伸10 min。PCR产物经1.0% 琼脂糖凝胶电泳鉴定。
1.3.2重组表达质粒pET-30a-M的构建及鉴定 PCR产物经胶回收纯化后连接至克隆载体pEasy-Blunt Zero Cloning Vector,经测序鉴定正确,成功构建克隆质粒pEasy-M。将pEasy-M及原核表达载体pET-30a(+)用EcoR I、Xho I双酶切,胶回收纯化双酶切产物,使用T4连接酶25℃连接2 h后,转化入大肠杆菌DH5α感受态细胞,涂布于Kana抗性的LB琼脂平板上,37℃培养12~16 h。收集菌体进行质粒提取,重组质粒经双酶切鉴定正确后,送至吉林省库美生物有限公司测序。将鉴定正确的重组质粒转化至大肠杆菌BL21(DE3)中,涂布于Kana抗性的LB琼脂平板,次日挑取单菌落接种至含有Kana抗性的LB液体培养基中,将测序正确的重组表达菌株命名为pET-30a-M,保留菌种。
1.4 重组表达菌pET-30a-M的诱导表达及优化
1.4.1重组表达菌pET-30a-M的诱导表达 将重组表达菌pET-30a-M及空载体pET30a(+)按照1∶1 000比例接种于含Kana的LB培养基中进行菌种复苏,过夜培养,次日取新鲜菌液按照1∶100的比例接入含Kana的LB培养基中,于37℃、200 r/min培养至D600值达到0.4~0.6,加入IPTG(终浓度为1.0 mmol/L),37℃诱导4 h后取出菌液,4℃、9 000 r/min离心20 min收集菌体沉淀,加入5倍体积的PBS重悬,将重悬后的菌液低温超声裂解(4℃,超声5 s,间隔5 s,功率220 W),冰上超声至菌液由黏稠变为澄清,4℃、12 000 r/min 离心30 min,收集上清及沉淀进行SDS-PAGE分析,确定蛋白表达情况。
1.4.2不同诱导温度对pET-30a-M可溶性蛋白表达的影响 将重组表达菌株pET-30a-M按照1∶100的比例接入含Kana的LB液体培养基中,以37℃、200 r/min培养至D600值达到0.4~0.6,加入IPTG(终浓度为1.0 mmol/L),分别以37,30,25和16℃诱导表达,诱导4 h后取出菌液,按1.4.1方法离心,收集菌体并低温超声破碎,SDS-PAGE分析可溶性蛋白表达量。
1.4.3不同浓度IPTG对pET-30a-M可溶性蛋白表达量的影响 将重组表达菌株pET-30a-M按照1∶100的比例接入含Kana的LB液体培养基中,以37℃、200 r/min培养至D600值为0.4~0.6,加入IPTG(终浓度分别为0.1,0.2,0.4,0.6,0.8和1.0 mmol/L),37℃诱导4 h后取出菌液,按1.5.1方法离心,收集菌体并低温超声破碎,进行SDS-PAGE分析可溶性蛋白表达量。
1.5 与伴侣蛋白的共表达试验
1.5.1含分子伴侣的感受态细胞的制备 从-80℃ 冰箱中取出E.coliBL21(DE3)感受态细胞于冰上融化。加入50 ng分子伴侣质粒于解冻的感受态细胞中,冰上轻轻混匀,放置30 min。将感受态细胞于42℃恒温水浴锅中热激90 s后迅速置于冰上5 min。加入800 μL 37℃预热的SOC液体培养基,在37℃、200 r/min的摇床中恢复培养50 min。取100 μL上述复苏培养液,涂布到含氯霉素抗性(Cm)的LB平板上,倒置于37℃恒温培养箱培养12~16 h,挑取单克隆菌落接种于含Cm抗性的LB培养基中,37℃、200 r/min 振荡培养12~16 h,加入甘油进行保菌,置于-80℃冰箱保存。
取含分子伴侣质粒的甘油冻存菌E.coliBL21(DE3)解冻,在Cm抗性的LB固体培养基上划线,37℃倒置培养12~16 h。挑取单菌落于5 mL含Cm抗性的LB液体培养基中,37℃、200 r/min培养过夜。按1∶100接种至50 mL含Cm抗性的LB液体培养基中,37℃、200 r/min条件下,培养至D600为0.4~0.5后,将三角瓶置于冰上15~20 min。将冷却的培养物快速分装于预冷的50 mL无菌离心管中,4℃ 5 000 r/min离心10 min,收集沉淀菌体。上述沉淀菌体加入30 mL预冷的过滤除菌的80 mmol/L的MgCl2及20 mmol/L的CaCl2,使菌体充分重悬,于4℃ 5 000 r/min条件下离心10 min。弃上清,加入0.8 mL 0.1 mmol/L的CaCl2和0.2 mL 60%甘油,使菌体充分重悬。将感受态细胞分至1.5 mL的无菌离心管中,每管50 μL,液氮速冻后于-80℃保存。
1.5.2共表达体系的构建 将pET-30a-M质粒转化到含伴侣分子的感受态细胞中,用含有Kana(100 mg/L)和Cm(20 mg/L)的琼脂平板筛选阳性克隆单菌落,将筛选的阳性菌分别命名为pET30a-M-pGKJE8、pET30a-M-pKJE7、pET30a-M-pGro7、pET30a-M-pGTf2和pET30a-M-pTf16,37℃ 200 r/min条件下,培养12 h后,加入甘油于-20℃保存。
1.5.3SDS-PAGE筛选伴侣蛋白 向20 mL的LB液体培养基中加入Kana、Cm和相应的诱导剂L-Arabinose(除pTf16为2.0 g/L,其余均为0.5 g/L)和Tetracycline(5 μg/L),加入1%体积的转化子,同步向20 mL的LB液体培养基中加入Kana及1%体积的pET-30a-M,培养至D600值达到0.4~0.6,加入IPTG并使其终浓度为0.5 mmol/L。37℃、200 r/min于培养箱中振荡培养4 h。4℃ 9 000 r/min 离心20 min收集菌体沉淀,加入5倍体积的PBS重悬,将重悬后的菌液进行低温超声裂解(4℃超声5 s,间隔5 s,功率220 W),冰上超声至菌液由黏稠变为澄清,4℃ 12 000 r/min 离心30 min,收集上清及沉淀。分别取诱导后的空载体及各共表达菌株的上清和沉淀,按比例加入6× protein loading buffer,煮沸5 min,SDS-PAGE观察并确定有效的伴侣蛋白。
1.6 Western blot分析分别取pET-30a-M及与有效的伴侣蛋白共表达后的上清和沉淀样品,SDS-PAGE电泳后,转印至NC膜,用含5%脱脂乳的TBST缓冲液封闭,4℃过夜。重组蛋白N端和C端均带有6×His标签,分别以Mouse anti-6×His tag antibody(1∶1 000稀释)和ADV阳性血清(1∶200稀释)作为一抗,其中Mouse anti-6×His tag antibody的孵育条件为4℃过夜,ADV阳性血清的孵育条件为37℃作用1 h,TBST清洗3次,每次10 min,山羊抗小鼠HRP-IgG(1∶10 000)和山羊抗猫HRP-IgG(1∶4 000)作为二抗,37℃作用1 h,TBST清洗3次,每次10 min,加入ECL显色液,进行分析,验证重组蛋白的反应原性。
1.7 共表达体系条件的优化从温度和诱导剂的浓度两方面筛选共表达的最佳条件,诱导温度选取25、30和37℃,诱导剂L-Arabinose质量浓度选取0.5和2.0 g/L,保证单一变量进行诱导表达,诱导20 h后,收集菌体,用5倍体积的PBS重悬,进行低温超声裂解(4℃超声5 s,间隔5 s,功率220 W),冰上超声至菌液由黏稠变为澄清,4℃ 12 000 r/min 离心30 min,收集上清,通过SDS-PAGE观察可溶性蛋白表达量的变化。
1.8 可溶性重组蛋白的纯化大量表达可溶性蛋白,取出菌液,4℃ 9 000 r/min 离心20 min收集菌体沉淀,用5倍体积纯化用的Binding Buffer重悬菌液。将重悬后的菌液进行低温超声裂解(4℃超声5 s,间隔5 s,功率220 W),将收集到的超声上清用0.45 μm的滤器过滤,去除不溶物待用,将Ni-NTA His-Bind亲和层析柱安装好,利用重力使酒精流出,加入5倍体积的去离子水清洗柱子,加入10倍体积的Binding Buffer平衡柱子后,将蛋白上清液加入柱子中,为使目的蛋白挂柱充分以缓慢的流速流出上样液,加入15倍体积的Wash Buffer洗净杂蛋白,最后用Elution Buffer洗脱蛋白。
2 结果
2.1 重组表达质粒的鉴定以pVAX1-M质粒为模板扩增部分VP2基因,琼脂糖凝胶电泳结果显示,得到与预期大小一致的条带,约1 866 bp(图1);重组表达质粒pET-30a-M经EcoRⅠ及XhoⅠ双酶切后,得到2条带:1条为表达载体pET-30a(+)(约5 422 bp),另1条为部分VP2基因(约1 866 bp)(图2),测序结果显示:与去除导致抗原抗体结合及抗体依赖性增强的2个肽段的VP2部分基因同源性为100%,表明原核表达重组质粒pET-30a-M构建成功。
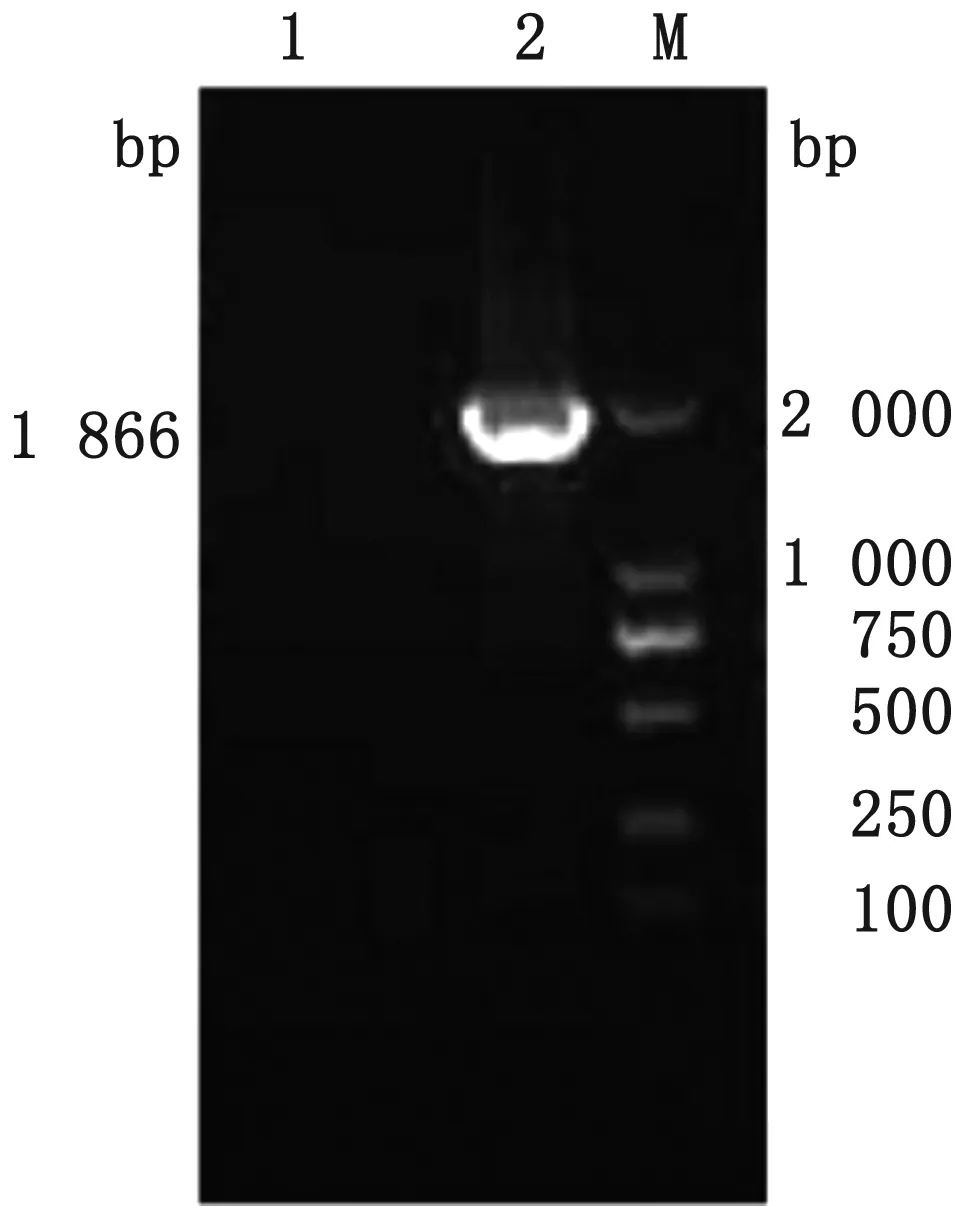
图1 VP2部分基因片段的PCR扩增鉴定结果 M.DL2000 DNA Marker;1.空白对照;2.PCR扩增产物
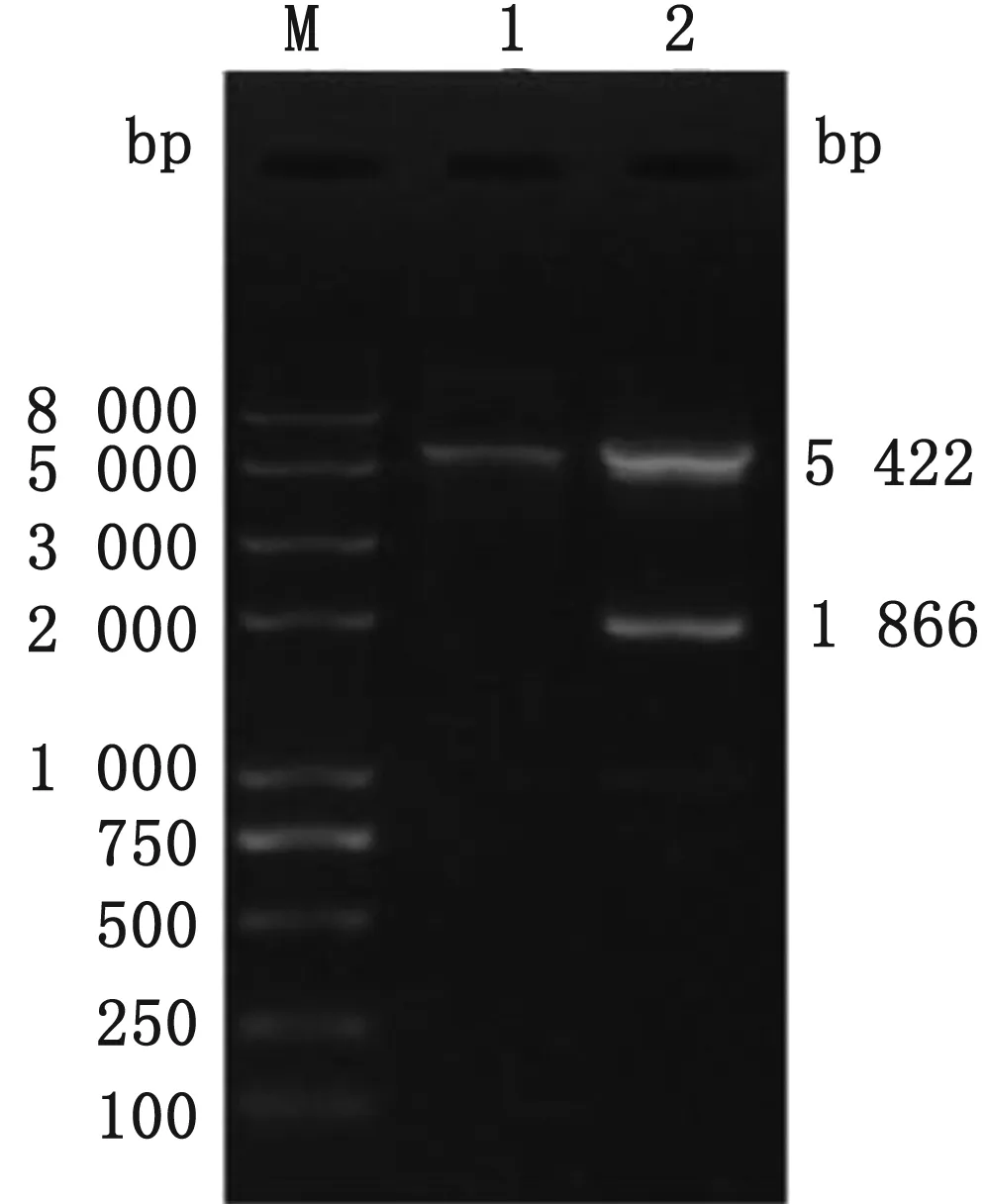
图2 重组质粒的双酶切鉴定结果 M.Trans2K plus Ⅱ DNA Marker;1.pET-30a(+)空载体;2.EcoRⅠ/XhoⅠ双酶切重组质粒
2.2 重组表达菌pET-30a-M表达及优化在37℃、IPTG 1.0 mmol/L、诱导4 h的条件下,分析蛋白表达情况,SDS-PAGE结果显示,与空载体全菌及诱导前的全菌相比,诱导后的全菌在约70 000处有明显条带,与预期的蛋白大小一致(图3),蛋白主要以包涵体形式存在;在相同诱导时间(4 h)和IPTG诱导剂浓度(1.0 mmol/L)的条件下,分别以不同温度16,25,30和37℃进行诱导表达,诱导4 h后,取出菌液,超声破碎后,将超声后的上清通过SDS-PAGE分析,结果显示,温度改变并不能有效增加可溶性蛋白表达(图4)。在相同诱导时间(4 h)和诱导温度(37℃)条件下,分别以0.1,0.2,0.4,0.6,0.8和1.0 mmol/L的IPTG进行诱导表达,利用SDS-PAGE分析诱导表达后超声破碎的上清,结果显示IPTG浓度的改变并不能有效增加可溶性蛋白的表达(图5)。
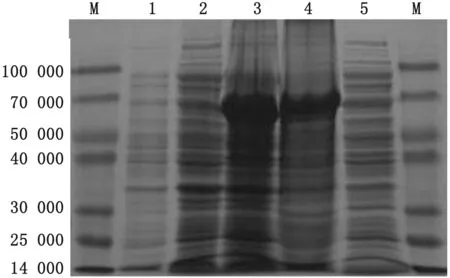
图3 重组蛋白的诱导表达 M.蛋白Marker;1.空载体;2.诱导前全菌;3.诱导后全菌;4.诱导后包涵体;5.诱导后上清

图4 不同诱导温度对蛋白表达的影响 M.蛋白Marker;1~4.诱导温度分别为16,25,30和37℃
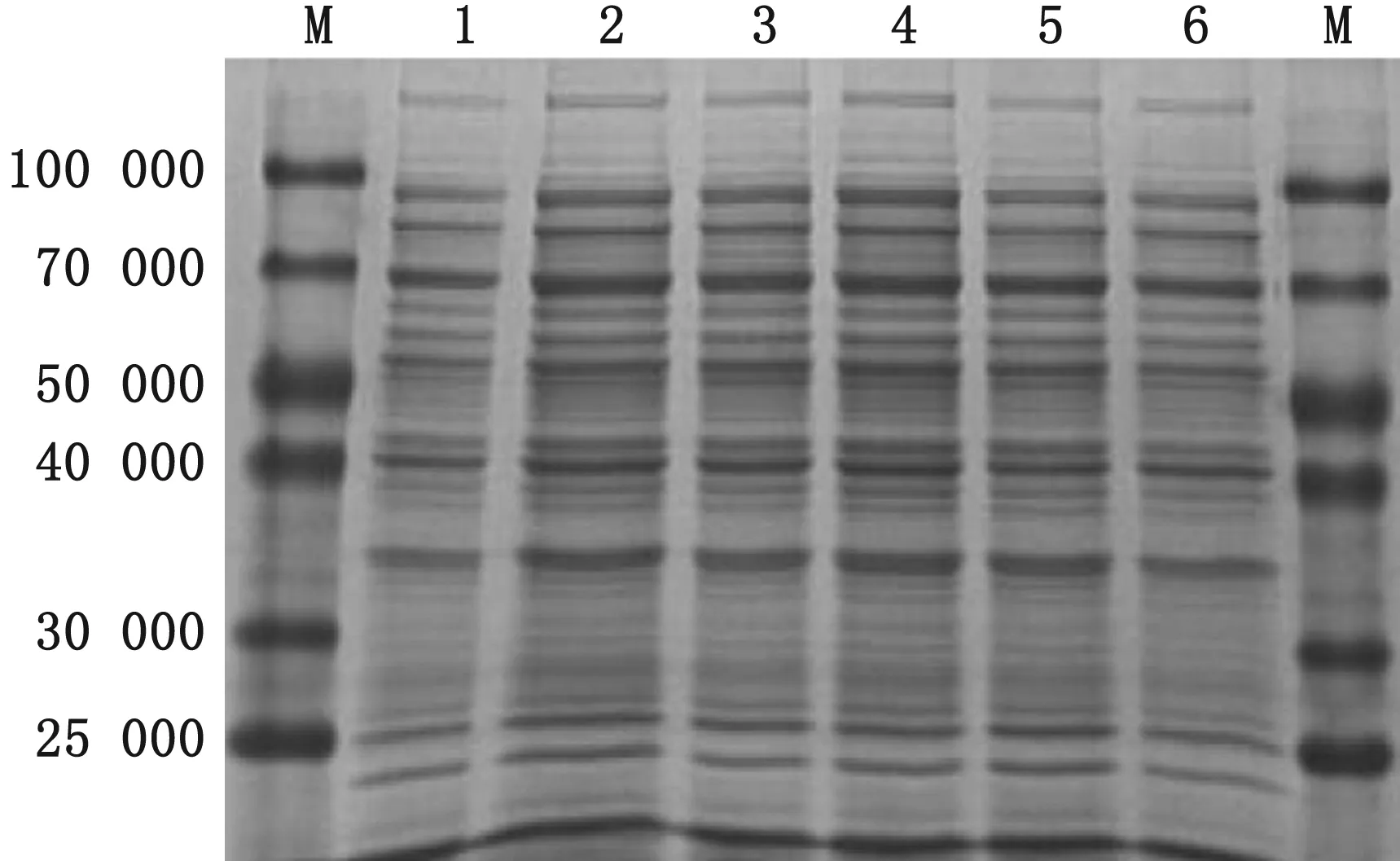
图5 不同诱导剂浓度对蛋白表达的影响 M.蛋白Marker;1~6.IPTG浓度分别为0.1,0.2,0.4,0.6,0.8 和1.0 mmol/L
2.3 共表达体系的建立和SDS-PAGE筛选将pET-30a-M分别与5种分子伴侣pGKJE8、pGro7、pKJE7、pGTf2和pTf16共同诱导表达,SDS-PAGE结果显示(图6),5种伴侣蛋白质粒所表达的各伴侣蛋白(除相对分子质量最小的10 000的GroES外)均成功表达,证明共表达体系构建成功,但除pET30a-M-pKJE7外,其余4种共表达菌株诱导表达后的包涵体均比上清的蛋白多,虽然pET30a-M-pKJE7表达伴侣蛋白DnaK与目的蛋白大小(70 000)重合,但包涵体表达量明显降低,可溶性上清比与其他分子伴侣共表达的表达量高。
2.4 Western blot分析以Mouse anti-6×His tag antibody及ADV阳性血清作为一抗,Western blot结果显示,pET-30a-M及共表达pET30a-M-pKJE7的包涵体及上清均可与His标签的单抗特异性结合,目的蛋白位于70 000(图7),在与伴侣蛋白共表达后,目的蛋白在上清中的可溶性表达增加,且目的蛋白可与ADV阳性血清特异性结合(图8)。

表2 各质粒编码的伴侣蛋白质及相应的诱导物
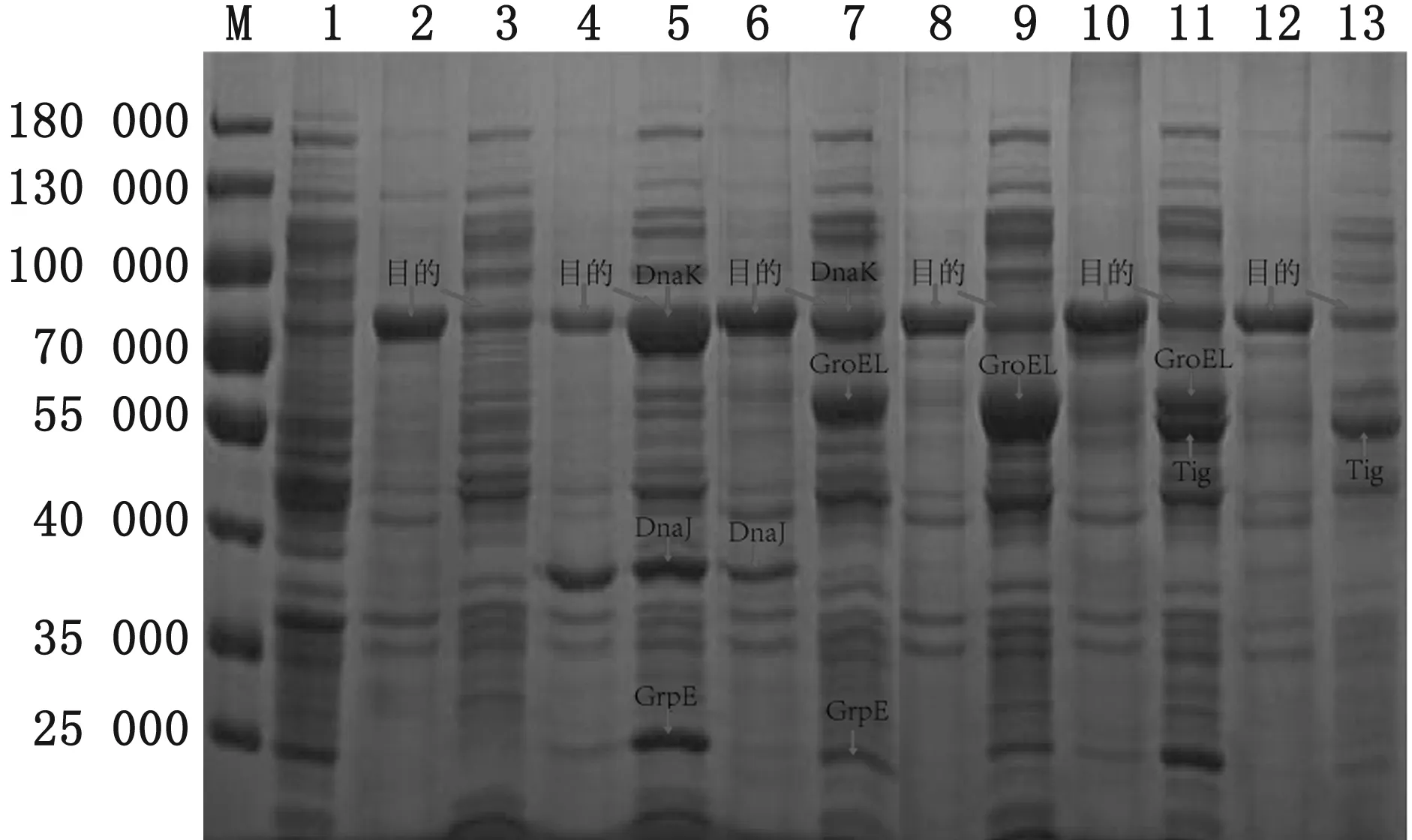
图6 SDS-PAGE筛选有效的伴侣蛋白 M.蛋白Marker;1.pET-30a(+)空载体;2.pET-30a-M包涵体;3.pET-30a-M上清;4.pET30a-M-pKJE7包涵体;5.pET30a-M-pKJE7上清;6.pET30a-M-pGKJE8包涵体;7.pET30a-M-pGKJE8上清;8.pET30a-M-pGro7包涵体;9.pET30a-M-pGro7上清;10.pET30a-M-pGTf 2包涵体;11.pET30a-M-pGTf 2上清;12.pET30a-M-pTf16包涵体;13.pET30a-M-pTf16上清
2.5 pET30a-M-pKJE7共表达条件的优化从温度和诱导剂的浓度两方面筛选表达最佳条件,诱导温度选取25,30和37℃,诱导剂L-Arabinose质量浓度选取0.5和2.0 g/L。诱导表达后收集菌体超声破碎,取上清进行SDS-PAGE分析,结果显示30℃与25℃比37℃上清中的可溶性蛋白表达量有所增高,此次选择25℃(图9),0.5与2.0 g/L两种不同质量浓度的L-Arabinose诱导剂对可溶性蛋白的表达量的影响差异不显著。
2.6 pET30a-M-pKJE7共表达蛋白纯化将纯化后的产物经SDS-PAGE检测(图10),结果显示,经镍柱纯化后,蛋白条带单一,大小约为70 000。
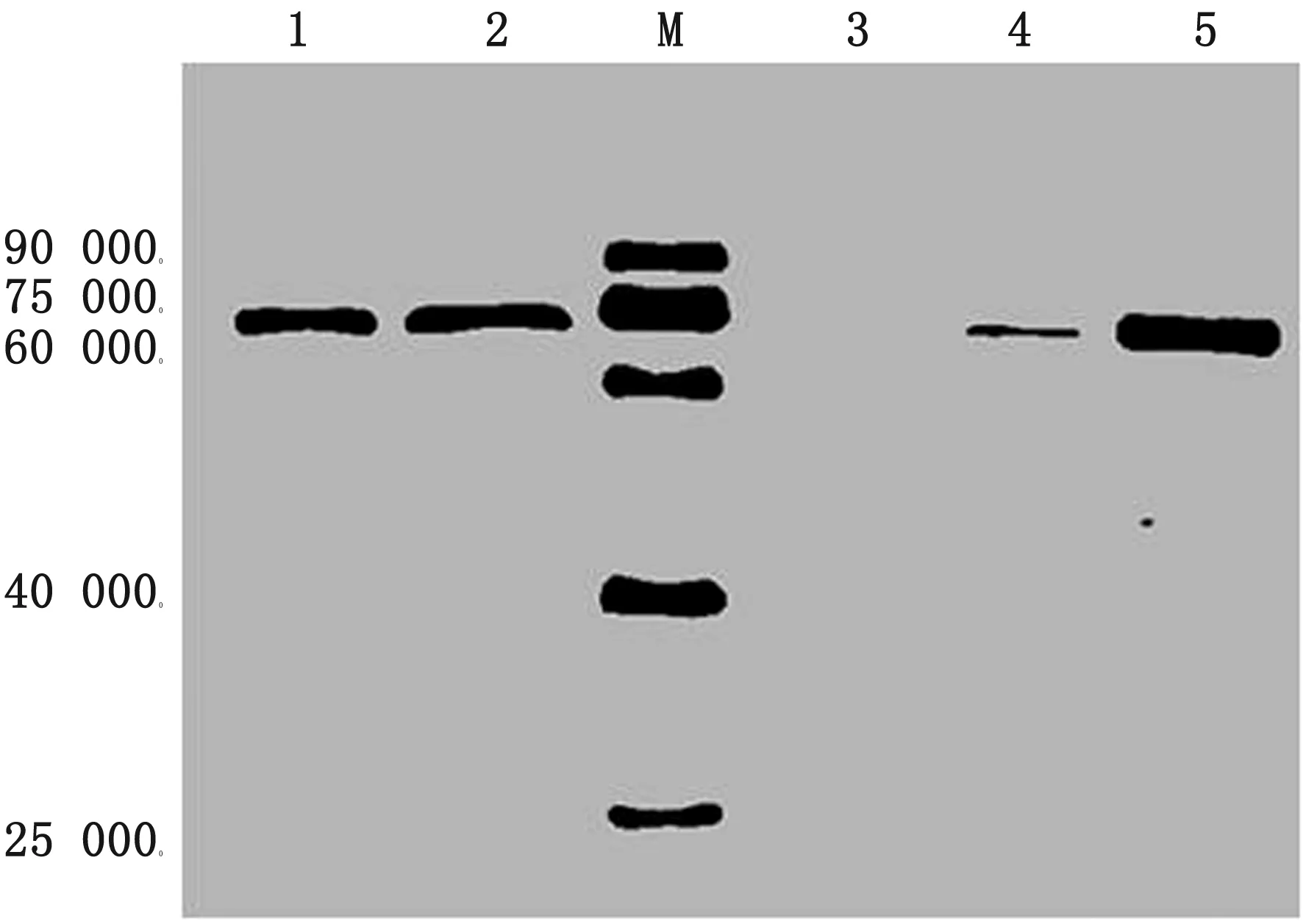
图7 pET-30a-M表达产物及pET30a-M-pKJE7共表达产物Western blot分析 M.曝光蛋白Marker;1.pET30a-M-pKJE7包涵体;2.pET30a-M-pKJE7上清;3.pET-30a(+)空载体对照;4.pET-30a-M上清;5.pET-30a-M包涵体

图8 pKJE7共表达产物Western blot分析 1.pET-30a(+)空载体对照;2.pET30a-M- pKJE7上清
3 讨论
由于外源蛋白主要在大肠杆菌中胞内表达,胞内环境呈还原性,不利于蛋白二硫键的形成,且目的蛋白分子较大且疏水性碱基较多,在原核表达系统中常会错误折叠而以包涵体存在,前期试验曾尝试降低诱导温度及诱导剂浓度使蛋白在胞内合成速度降低,但并不能有效增加可溶性蛋白的表达。不溶包涵体为后期的纯化复性造成困难,并且复性得到的蛋白很难保证其活性。为改变蛋白的表达形式,可利用与伴侣蛋白分子共表达,实现蛋白的正确折叠。在大肠杆菌表达系统中,与蛋白质折叠密切相关的主要有3种伴侣分子:触发因子(TF)、DnaK/DnaJ/GrpE系统和 GroEL/GroES系统。TF是细菌中唯一与核糖体结合起作用的伴侣蛋白,能够阻止新生肽链的过早折叠从而保证其正确折叠[13]。GroEL分子利用疏水作用力与蛋白质结合,诱导其正确折叠;GroES为GroEL的辅助分子,促进蛋白质释放[14-15]。DnaK参与蛋白质的解聚及折叠从而促进蛋白正确折叠[16]。DnaK具有两个功能结构域,即ATP酶结构域和底物结合结构域。而DnaJ和GrpE为DnaK发挥功能的共伴侣蛋白,DnaJ先与底物蛋白结合形成复合物,然后将底物递送至已与ATP结合的DnaK,同时刺激ATP水解成ADP,DnaK底物结合域的α-螺旋盖子关闭,使其与底物结合更紧密[17];而GrpE蛋白结合复合物,促进ADP解离及ATP的再次结合,从而使α-螺旋盖子打开,释放正确折叠蛋白[18-19]。本研究尝试将表达分子伴侣蛋白的5种质粒:pG-KJE8(表达分子伴侣DnaK、DnaJ、GrpE、GroES和GroEL)、pGpro7(表达分子伴侣GroES 和GroEL)、pKJE7(表达分子伴侣DnaK、DnaJ和GrpE)、pG-Tf2(表达分子伴侣Tig、GroES和GroEL)及pTf16(表达分子伴侣Tig)转入BL21(DE3)感受态细胞制备含伴侣蛋白的感受态细胞,随后转入pET-30a-M质粒,将5种共表达菌株诱导表达后,发现只与pKJE7共表达,可以增加上清中目的蛋白的表达,但由于该质粒表达的DnaK分子的蛋白与目的蛋白大小一致,确定上清中的蛋白确为目的蛋白,将表达产物经Western blot进一步分析,发现与pKJE7共表达,且可增加目的蛋白的可溶性表达。
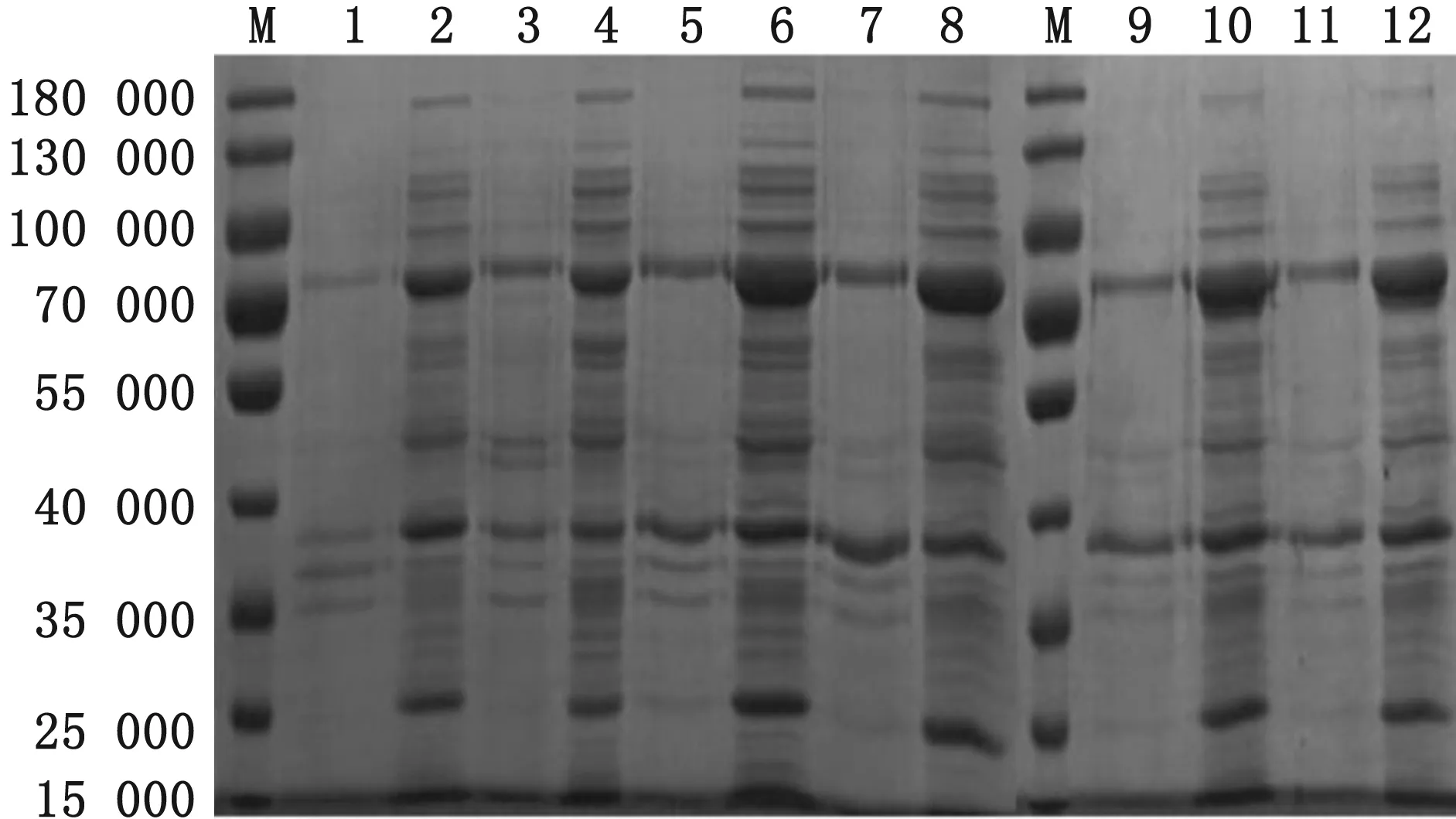
图9 pET30a-M-pKJE7共表达条件优化 M.蛋白Marker;1.37℃ 0.5 g/L包涵体;2.37℃ 0.5 g/L上清;3.37℃ 2.0 g/L 包涵体;4.37℃ 2.0 g/L上清;5.30℃ 0.5 g/L包涵体;6.30℃ 0.5 g/L上清;7.30℃ 2.0 g/L包涵体;8.30℃ 2.0 g/L上清;9.25℃ 0.5 g/L包涵体;10.25℃ 0.5 g/L上清;11.25℃ 2.0 g/L包涵体;12.25℃ 2.0 g/L上清
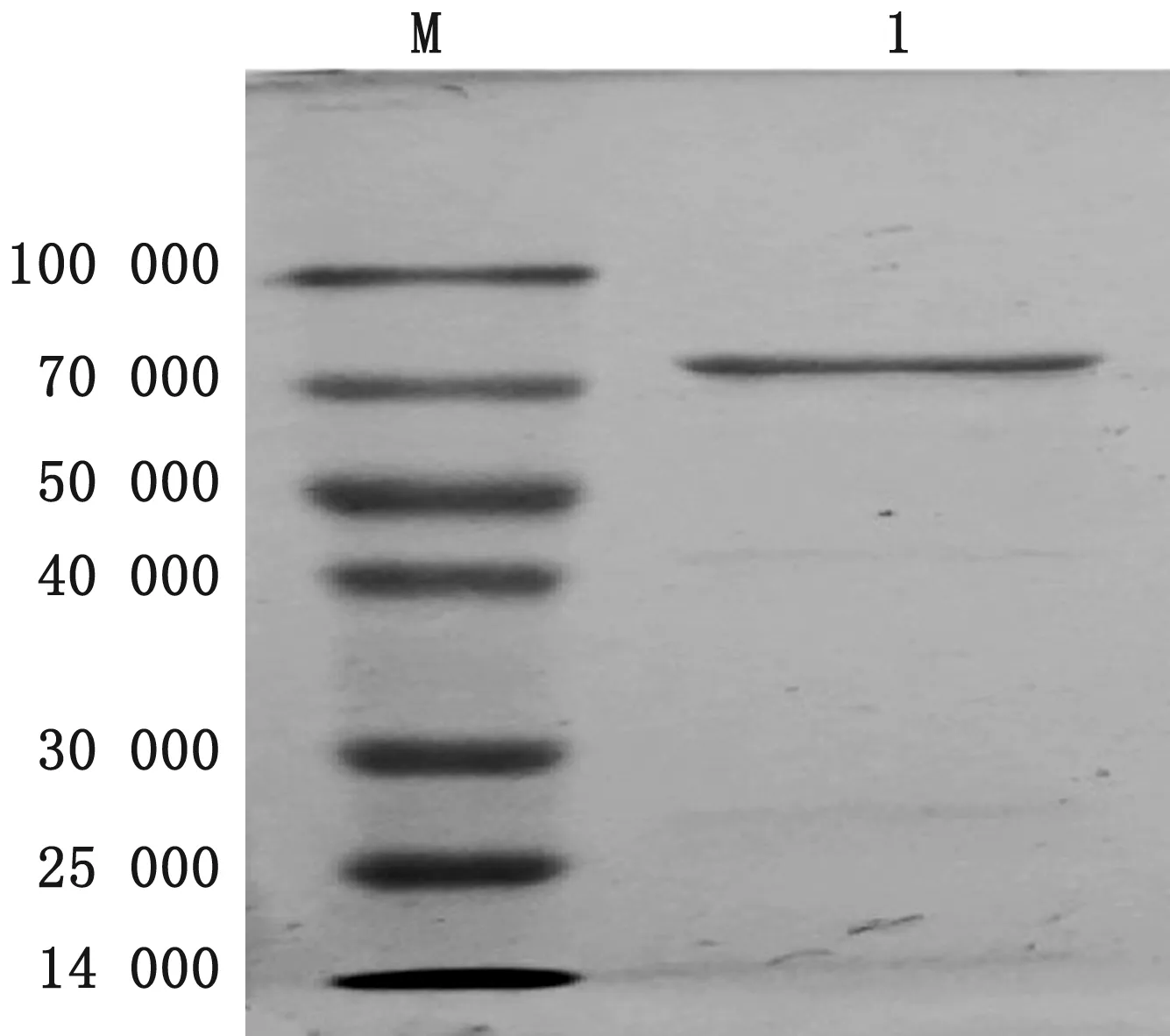
图10 纯化后产物分析 M.蛋白Marker;1.纯化后产物
在大肠杆菌中能有效增加外源蛋白可溶性表达的伴侣蛋白种类及诱导表达条件随不同的目的外源蛋白而不同,本研究在伴侣的种类、诱导剂及诱导温度上进行了优化筛选。结果表明,伴侣蛋白的种类对目的蛋白的可溶性表达起着关键作用,低温有利于可溶性蛋白表达,L-Arabinose浓度对蛋白可溶性表达影响不大。5种质粒pG-KJE8、pGpro7、pKJE7、pG-Tf2及pTF16与目的蛋白共表达,4种质粒对可溶性蛋白的表达均无影响,并不能促进可溶性蛋白成分的增加,只有pKJE7质粒有效增加可溶性蛋白。pET系列载体推荐的诱导温度为30~37℃,而低温有利于可溶性蛋白表达,在探究温度对共表达的影响时,选择了37,30和25℃,结果发现随着温度的降低,可溶性蛋白表达量有所增加,此次选择25℃。L-Arabinose为伴侣蛋白的诱导剂,影响着伴侣蛋白的表达,说明书推荐L-Arabinose质量浓度为0.5~4.0 g/L,故本研究选用了0.5和2.0 g/L,发现L-Arabinose质量浓度对与pKJE7共表达的可溶性蛋白表达无影响,但对于pTf16质粒,L-Arabinose质量浓度对其表达影响很大,0.5 g/L无法诱导pTf16分子伴侣的表达;对L-Arabinose加入时间及IPTG浓度也做了探究,发现对诱导表达无影响,这部分结果由于篇幅有限未写入。
AD是典型的免疫复合物疾病,动物在感染AD后,机体会产生高水平抗体,但却不能中和病毒,反而会与抗原形成复合物,沉积于肾脏上皮或动脉并发炎症,抗体进一步介导ADV侵染,产生ADE作用。目前,ADV的防控主要依赖于每年打皮期的诊断筛查,尚无疫苗防控。
AASTED等[20]通过表达ADV病毒结构蛋白VP2及非结构蛋白NS1,将纯化的蛋白免疫动物,发现VP2免疫并无保护作用,反而导致动物死亡,这主要是由于该病会引起ADE作用;NS1免疫只有部分保护作用;2005年,CASTELRUIZ等[21]将ADV的NS1基因连接至真核表达载体Pvr1012,将构建核酸疫苗免疫水貂,仅起到部分保护作用。VP2作为ADV衣壳蛋白的主要构成蛋白,虽然表面有丰富的抗原决定簇,但由于ADE作用,将VP2免疫动物,并不能起到期望的保护力。
BLOOM等[10]研究发现抗原抗体复合物结合和产生ADE作用的主要位置为VP2蛋白428~446 aa及487~501 aa。去掉该两部分肽段,将降低VP2的ADE作用。原核表达具有简便、高效、成本低的优点,被广泛应用;pET表达载体作为原核表达系统中表达外源蛋白效率最高、蛋白产量最大的表达系统,被研究者青睐;但由于表达速率过快,蛋白常会错误折叠成包涵体,本试验通过与伴侣蛋白共表达,成功表达去除以上两肽段的VP2部分基因的可溶性蛋白,SDS-PAGE及Western blot结果表明,蛋白大小与预期一致,且能与ADV阳性血清特异性结合,证明其具有反应原性,这为今后探究其生物学功能奠定了基础。
