酶解对紫苏蛋白乳化特性的影响
2020-10-14王丽娜孙洪蕊李凤林刘香英田志刚康立宁
王丽娜,孙洪蕊,李凤林,刘香英,田志刚,康立宁,*
(1.吉林省农业科学院农产品加工研究所,吉林长春130022;2.吉林农业大学食品科学与工程学院,吉林长春130118)
紫苏[Perilla frutescens(L.)Brit]别名赤苏、香苏、红苏、红紫苏,系唇形科紫苏属一年生草本植物[1]。紫苏是营养价值较高的食药两用型植物,紫苏籽中的油脂含量很高,其中又以α-亚麻酸含量居多[2-3],紫苏籽粒中蛋白含量为20%~25%,其脱脂后的副产物(紫苏饼粕)蛋白含量高达28%~45%[4-5]。紫苏蛋白具有丰富的营养价值,可以作为新兴植物蛋白资源应用于食品工业中[6]。
作为一种新的植物蛋白资源,人们对紫苏蛋白在食品加工中功能特性的研究还不够深入。吴锦波等[7]研究认为紫苏浓缩蛋白溶解特性和乳化特性受pH值、离子强度、温度、蛋白质质量浓度等影响。姜文鑫[8]、刘宁等[9]研究表明紫苏蛋白中不同蛋白组分的功能性质不同。盛彩虹等[10]研究认为中性条件下紫苏分离蛋白的乳化性、起泡性和凝胶性均不及大豆分离蛋白。乳化性作为植物蛋白的基本特性之一,对饮料、奶油、焙烤等乳制品的品质和稳定性产生重要影响。
酶法改性是提高植物蛋白乳化性的重要手段,它具有催化反应条件温和而且专一、无副产物等优点,已成为分离蛋白改性的主要研究方向,通过酶解改性提高植物蛋白功能特性是近来食品科学领域关注的重点。应用酶法改性可以明显提高大豆蛋白[11-12]、核桃蛋白[13]、甘薯蛋白[14]、米渣蛋白[15]等常见植物蛋白的乳化特性。但酶法改性在提高紫苏蛋白乳化特性方面的研究还较为少见。
本文以提高紫苏蛋白乳化性为目的,采用碱性蛋白酶对紫苏分离蛋白进行酶解改性,研究不同酶解程度和改性工艺对乳化特性的影响,并对改性的紫苏蛋白的结构性质进行了分析,以期为紫苏蛋白在食品工业中的应用提供理论依据和数据支持促进紫苏产业的发展。
1 材料与方法
1.1 材料
紫苏粕:吉林沃达食品有限公司;碱性蛋白酶(1.7×105U/g):吉林奥博星生物有限公司;木瓜蛋白酶(4.2×104U/g)、胰蛋白酶(7.4×104U/g):北京沃尔康星技术有限责任公司。
1.2 仪器和设备
紫外可见分光光度计(UV2300):上海美天仪器有限公司;数显pH计(pHS-25):上海精密科学仪器有限公司;高压均质机(APV-1000):丹麦APV公司。
1.3 试验方法
1.3.1 紫苏分离蛋白的制备
紫苏分离蛋白采用碱溶酸沉的方法提取[16-17]。用乙腈将放在索氏抽提中的紫苏饼粕进行脱脂6 h,通风橱内晾干,脱脂粉装入聚乙烯袋中,在-20℃储存备用。脱脂紫苏粉与蒸馏水1∶20(g/mL)混合,2 mol/L NaOH调节pH值为10,60℃水浴1 h,5 000 r/min离心10 min,取上清液,1 mol/LHCL调至等电点pH为4.4,5 000 r/min离心10 min。沉淀水洗3次,用1 mol/L NaOH调至pH值为7,冷冻干燥,即得分离蛋白,过60目筛4℃储存备用。
1.3.2 蛋白酶活力的测定
蛋白酶活力的测定,参考GB/T28715-2012《饲料添加剂酸性、中性蛋白酶活力的测定分光光度法》。
1.3.3 紫苏蛋白酶的酶解处理
1.3.3.1 各蛋白酶的酶解条件
3种蛋白酶的最适酶解条件见表1。

表1 各蛋白酶酶解条件Table 1 Enzymatic conditions of each protease
1.3.3.2 蛋白水解度的测定
本研究中采用pH-stat法[18-19],此法操作简便,可以连续测定。公式如下:

式中:B为水解过程中消耗氢氧化钠溶液的体积,mL;Nb为氢氧化钠溶液的浓度,mol/L;α 为 α-氨基解离度;MP为底物蛋白质含量,g;htot为蛋白质中总的可被水解的肽键数(紫苏蛋白为7.219 mmol/g)。
1.3.4 紫苏蛋白的功能性质测定
1.3.4.1 乳化性测定
参考WANG[20]方法并做适当改动。精确称取1g左右样品,溶解于100 mL水中,室温25℃下1 000 r/min搅拌1 h,取15 mL蛋白溶液与5 mL紫苏油混合,在高速乳化均质机下13 500 r/min乳化2 min后倒入25 mL烧杯中,分别于0 min,10 min在烧杯底部取20 μL与5 mL 0.1%的十二烷基硫酸钠(sodium dodecyl sulfate,SDS)溶液均匀混合,在500 nm处测定吸光度值。

式中:T=2.303为固定常数;N为稀释倍数,取250;C为乳化液形成前蛋白质水溶液中蛋白质浓度,g/mL;φ为乳化液中油相体积分数0.25;A0为0 min的吸光度值;A10为10 min的吸光度值。
1.3.5 紫苏蛋白结构性质测定
1.3.5.1 扫描电镜
利用扫描电镜观察原料蛋白与碱性蛋白酶改性样品的表面结构变化情况。
1.3.5.2 傅里叶红外光谱测试
将冷冻干燥后的紫苏蛋白样品处理后称取1 mg,加入适量的溴化钾进行研磨,使溴化钾与蛋白充分混匀后再进行压片处理,而后进行傅里叶红外光谱仪(fourier transform infrared spectrometer,FTIR) 分析测试。通过持续充入N2进入测量室以避免水蒸气的干扰,并排除空气背景。分析测试的波数范围为4 000 cm-1~400 cm-1,分辨率 4 cm-1,波数精度 0.01 cm-1、扫描次数64次,环境温度25℃[21-22]。
1.3.6 碱性蛋白酶的酶解条件优化
在单因素试验基础上,利用Design-Expert 8.0.6软件对试验进行过程优化。以紫苏分离蛋白的乳化活性为响应值,A酶添加量、B酶解时间、C酶解温度、D酶解底物浓度、E酶解pH值为影响因素,根据响应面法试验设计原理,设计五因素三水平的二次回归方程来拟合因素和指标(响应值)之间的函数关系,确定最优工艺参数。其因素和水平编码表见表2。

表2 因素水平编码Table 2 Factor level coding table
1.4 数据处理
采用Origin 2018软件绘图,用SPSS 11.5分析软件进行相关分析和方差分析,所有试验均重复3次。
2 结果与讨论
2.1 蛋白酶酶活
3种蛋白酶的酶活力见表3。

表3 各蛋白酶酶活力Table 3 Protease activity
如表3各蛋白酶的酶活力,由于3种蛋白酶存在生产储运时间等差异,试验所用的蛋白酶活力之间存在差异,但总体保持原有蛋白酶活性,可以保证良好的酶解效果。
2.2 不同蛋白酶酶解紫苏分离蛋白水解度的变化
3种蛋白酶对紫苏蛋白水解度的变化见图1。

图1 不同酶随水解时间对水解度的影响Fig.1 Effect of different enzymes on DH with hydrolysis time
如图1所示,胰蛋白酶先呈现上升的趋势,但在60 min后水解度逐渐下降,原因可能是底物质量分数和数量有限,从而限制了胰蛋白酶与底物的结合,导致水解度不会无限升高,后期变化趋势逐步下降[23]。碱性蛋白酶、木瓜蛋白酶的水解度总体相似,在酶解的初始阶段,水解度均随酶解时间的延长而增大,而当酶解继续进行后,水解度开始随着水解时间的增加逐步下降又趋向平稳。原因在于,酶解反应初期,紫苏蛋白乳液的底物丰富,蛋白酶中的肽键及酶解切割位点被作用的较多,因而,水解度呈现出相对比较明显的上升趋势。但随着酶解反应的持续进行,紫苏分离蛋白逐渐被切割为多肽,可供蛋白酶提供的切割位点逐渐减少,导致水解度的增长缓慢,此外水解产物的积累可能对蛋白酶产生竞争性抑制,进而影响蛋白酶活力,这也是水解度曲线在此条件下增长缓慢的原因之一[24]。根据水解度的变化趋势可知,3种蛋白酶水解能力由强到弱依次为碱性蛋白酶>胰蛋白酶>木瓜蛋白酶。比较3种蛋白酶对紫苏蛋白水解度的变化影响,最终选择碱性蛋白酶为本试验的水解酶。
2.3 不同酶解对紫苏分离蛋白乳化性的影响
2.3.1 不同酶随水解时间对乳化活性的影响
3种酶在相同的底物浓度2%和酶的添加量3 000 U/g下,各种酶在其最适的反应温度和pH值下分别水解,测定不同时间水解产物的乳化性。不同酶随水解时间对乳化活性的影响见图2。
如图2所示,在不同时间内3种酶的乳化特性,都先随着时间的增加呈现先增加后降低的趋势;这种现象出现的原因是因为随着酶解时间的不断增加,蛋白质断裂成肽段后分子刚性降低,紫苏分离蛋白的分子形状由紧密球体逐渐转变为线性分子,从而增加了蛋白的分子柔性,并且更加有顺序的排列在油水界面;另外,随着酶解处时间的增加,蛋白质内部包埋的疏水性基团开始暴露出来,并慢慢扩散于油水界面,进而降低界面张力,从而使紫苏分离蛋白乳化性呈现上升趋势[25]。但随着水解时间的不断增加,紫苏分离蛋白水解度增大,使紫苏分离蛋白的内部结构力(包括氢键、范德华力)逐渐开始被破坏,致使油滴表面的保护层变的脆弱,进而导致乳化性的降低[26]。

图2 不同酶随水解时间对乳化活性的影响Fig.2 Effect of different enzymes on emulsification activity with hydrolysis time
通过比较可知,木瓜蛋白和胰蛋白酶的乳化特性相对较好,碱性蛋白酶其次;木瓜蛋白酶在30 min~40 min内,乳化活性先升高再降低的趋势,分析原因可能是紫苏分离蛋白经蛋白酶水解后,其二、三级结构被打开,多肽链开始展开,使原来隐藏在分子内部的很多疏水区域暴露于溶液中,然而这种疏水区域在水溶液中是不稳定的,它们会因相互疏水作用而凝集或聚合在一起,进而从溶液中析出而沉降,从而使紫苏分离蛋白的表面疏水性增加[27]。胰蛋白酶和碱性蛋白酶在30 min~70 min内,乳化活都呈现先逐步升高后又逐步降低的趋势,分析原因为乳化特性的增加可能是由于大分子蛋白质的降解,使蛋白的溶解性不断提高,从而乳化活性更好。不同酶随水解时间对乳化稳定性的影响见图3。
如图3为不同种酶在不同时间下对紫苏蛋白乳化稳定性的影响,经过不同蛋白酶处理的紫苏分离蛋白乳化稳定性变化不一。碱性蛋白酶及木瓜蛋白酶酶解后的紫苏分离蛋白乳化稳定性有显著提升,通常蛋白质的乳化稳定性与乳滴粒径大小有关,碱性蛋白酶酶解后酶解肽段变小引起液滴粒径减小,进而造成紫苏蛋白酶解修饰后乳化稳定性提高[28-29]。另外,胰蛋白酶酶解后的紫苏蛋白乳化稳定性呈现了降低的趋势。分析原因可能是酶水解会释放出疏水基团,增加蛋白疏水性,有利于乳化性的提高,但由于小分子肽含量过多,分子量过小的蛋白在油-水界面无法形成刚性结构,所以乳化稳定性较差,形成的乳状液不稳定[30]。

图3 不同酶随水解时间对乳化稳定性的影响Fig.3 Effect of different enzymes on emulsification stability with hydrolysis time
2.4 紫苏分离蛋白的酶解
2.4.1 碱性蛋白酶酶解条件优化
在酶解处理单因素试验基础上,采用响应面分析法进行试验设计,利用Design-Expert 8.0.6软件对试验进行优化。以紫苏分离蛋白的乳化活性(Y)为响应值,A酶添加量、B酶解时间、C酶解温度、D酶解底物浓度、E酶解pH值为影响因素,设计五因素三水平的二次回归方程来拟合因素和指标(响应值)之间的函数关系,确定最优工艺参数。其因素水平编码表见表4。

表4 试验安排及结果Table 4 Test arrangement and results
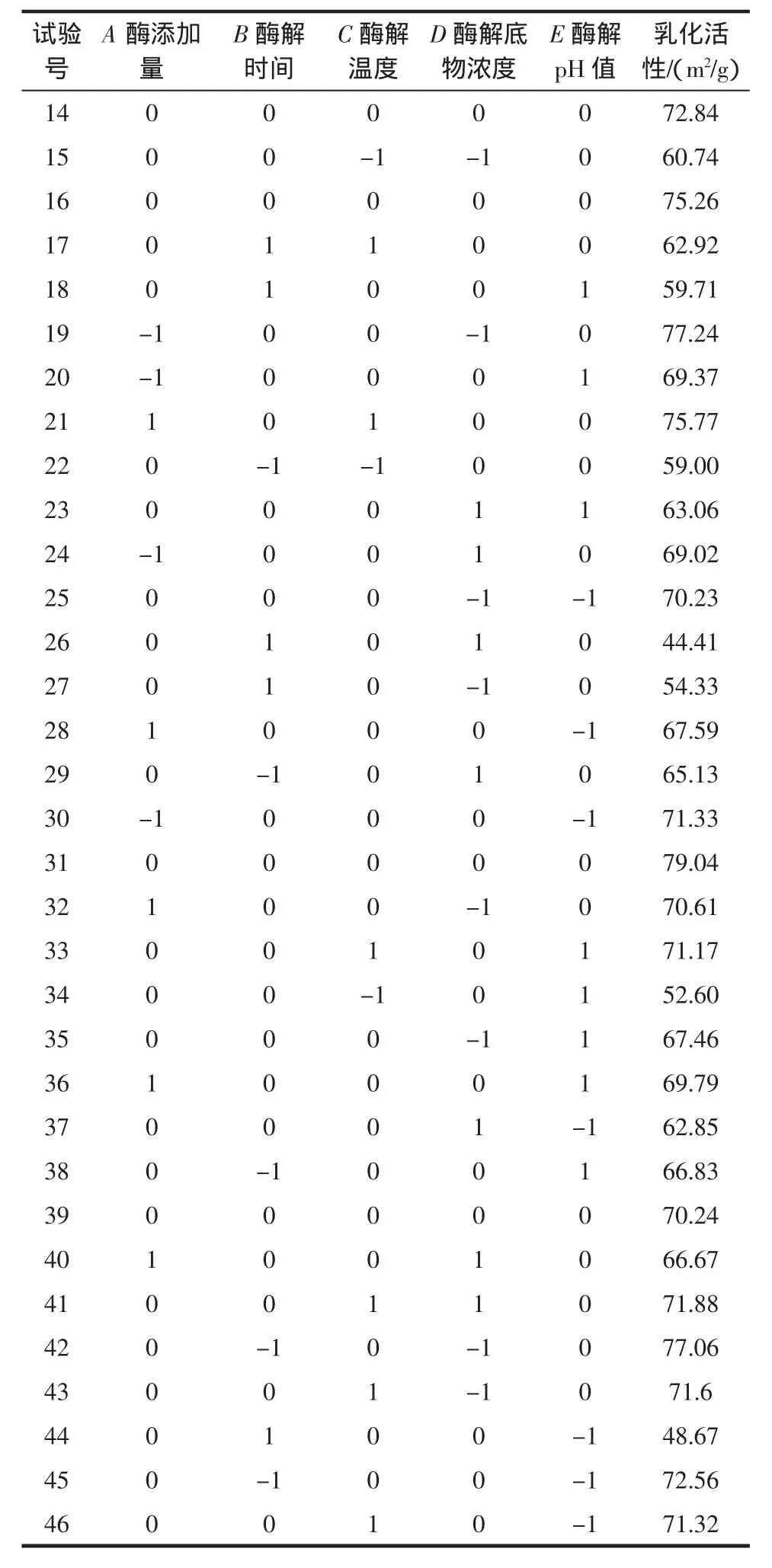
续表4 试验安排及结果Continue table 4 Test arrangement and results
利用Design-Expert8.0.6软件对表4试验数据进行拟合,获得二次多项回归模型方程为:
Y=74.88-1.6A-8.07B+8.71C-3.84D-0.071E-5.07AB+2.93AC+1.07AD+1.04AE+2.90BC+0.50BD+4.19BE+4.06CD+0.96CE+0.75DE-1.60A2-9.35B2-8.54C2-4.22D2-3.88E2应用Design-Expert 8.0.6软件对紫苏蛋白乳化性模型方程进行方差分析,结果见表5。
由表5可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(P<0.000 1),失拟项不显著(P>0.05),一般情况下,R2越接近于 1,拟合的经验模型越好;另一方面,R2值越小,模型中独立变量的相关性越差,从方差分析得到的回归方程显示,模型的拟合度和校正拟合度分别为0.942 1和0.895 7,这些数据说明了二次模型的模拟具有较高的可信度。交互项AC、AD、AE、BC、BD、CE、DE、A2对紫苏蛋白乳化活性没有显著影响(P>0.05);而 A、B、C、D、AB、BE、CD、B2、C2、D2、E2项对蛋白乳化活性具有显著影响 (P<0.05)。由F值可以得出,影响蛋白乳化活性因素的贡献值大小顺序为C>B>D>A>E,即酶解温度>酶解时间>酶解底物浓度>酶添加量>酶解pH值。失拟项不显著,说明其他未知因素不会对试验结果造成显著干扰,并能较好地反映乳化活性与底物浓度、酶解温度、酶解时间、酶添加量及酶解pH值的关系,故此回归方程能较准确预测乳化活性随各参数变化规律。

表5 紫苏蛋白乳化性回归与方差分析结果Table 5 Results of emulsification regression and variance analysis of perilla protein
2.4.2 优化试验结果的验证
采用Design-Expert 8.0.6软件分析最佳酶解温度46.94℃、酶添加量为1820.9U/g、酶解时间为37.62min、底物浓度为4.97%、酶解pH值为8.81,在此条件下紫苏分离蛋白乳化活性的预测值为79.16 m2/g,与对照组(未加碱性蛋白酶)紫苏蛋白的乳化活性40.86 m2/g相比提高了93.73%。为验证响应面法所得结果的准确性,采用上述最佳酶解条件对紫苏蛋白的乳化活性进行5次试验验证,实际测得的乳化活性平均值为78.86 m2/g,与预测值接近,证明了模型的可行性。
2.5 紫苏蛋白结构测定
2.5.1 电镜扫描结果
扫描电镜结果见图4。

图4 原料蛋白与改性蛋白扫描电镜图Fig.4 Scanning electron micrograph of raw protein and modified protein
从图4可以看出,在相同放大倍数(200×)下,未经改性的原料蛋白比较规整,分子之间距离靠近,结构紧密,有细微的孔眼,且很浅;质地饱满颗粒表面光泽,颗粒的大小不均匀;经过碱性蛋白酶改性后的蛋白表面展开,孔眼较多且孔眼较深,质地疏松;原因可能是在碱性蛋白酶改性过程中露出了被深埋在蛋白分子内部的侧链基团,增强了分子柔韧性,蛋白分子在界面上的展开与形态的改变会更容易些。这使碱性蛋白酶对乳化活性增大的微观原因得到了很好的直观说明。
2.5.2 红外光谱分析
红外光谱分析结果见图5、碱性蛋白酶改性后红外光谱图见图6。
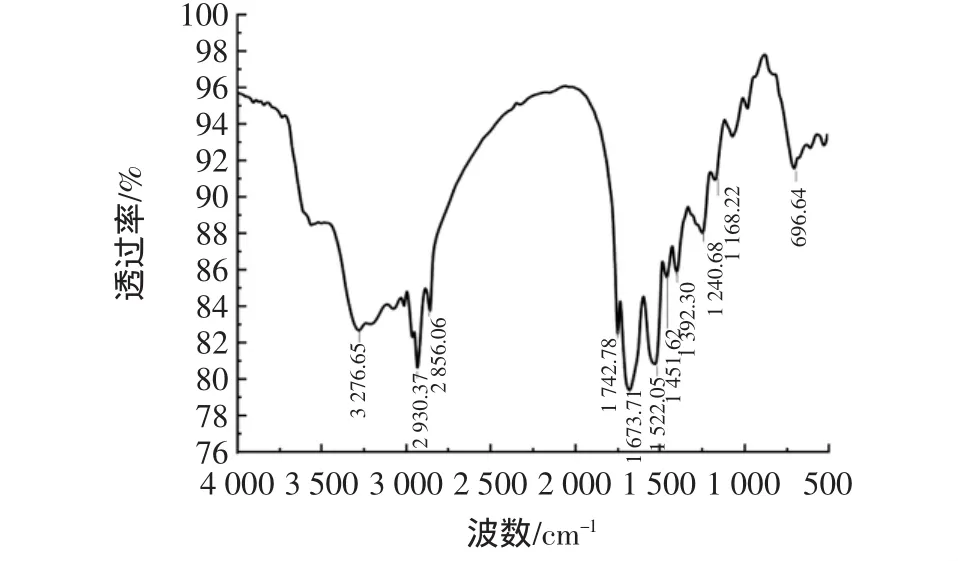
图5 原料蛋白红外光谱图Fig.5 Infrared spectrum of raw protein

图6 碱性蛋白酶改性后红外光谱图Fig.6 Infrared spectrum of alkaline protease modification
从图5和图6对比可以看出,碱性蛋白酶改性的分离蛋白在 1 451.62、1 236.90、162.62 cm-1均出现了新的吸收峰,经查找,芳环C-H吸收峰位于3 100 cm-1~3 000 cm-1,醛基 C-H 吸收峰位于 2820 cm-1~2 720 cm-1,芳香胺C-N吸收峰位于1 350 cm-1~1 280 cm-1。酸酐C-O的吸收峰位于1 310 cm-1~1 045 cm-1,因此推测先产生的吸收峰分别是芳香胺、酸酐发生了伸缩振动。另外3 276.25 cm-1处的吸收峰变平,由于N-H键的吸收峰在3 500 cm-1~3 300 cm-1[31],推测有新的基团在NH2处引入。
3 结论
本研究以紫苏分离蛋白为原料,选用碱性蛋白酶对紫苏分离蛋白进行酶解改性,提高紫苏分离蛋白的乳化性能,结果表明:蛋白酶的筛选碱性蛋白酶的水解度最好,其改性选择碱性蛋白酶。紫苏蛋白经过碱性蛋白酶酶解改性后,在酶解温度46.94℃,酶添加量1 820.9 U/g,反应时间37.62 min,底物浓度为4.97%,pH=8.81在此条件下,其乳化活性为79.16 m2/g,较改性前提高了93.73%。通过扫描电镜得出,经过碱性蛋白酶改性使原来紧密、不均匀的颗粒微观结构变得质地疏松、均匀的微观结构;红外光谱分析得出经碱性蛋白酶改性的蛋白有明显吸收峰出现,说明有新的基团引入。
