蛹、米虫草多糖含量及抗氧化活性比较研究
2020-10-14白丽丹段懿涵谭超杰李春阳王博盛瑜
白丽丹,段懿涵,谭超杰,李春阳,王博,盛瑜
(北华大学药学院,吉林吉林132013)
北虫草(Cordyceps militaris),于1958年在吉林省首次发现,又名北冬虫夏草,蛹虫草,与冬虫夏草同属不同种[1]。它是由子座(即草部分,又称子实体)与菌核(即虫的尸体部分)组成的复合体[2]。研究发现,北虫草的有效化学成分主要包括虫草多糖、虫草素、虫草酸等,同时还含有各种蛋白质和人体所必需的氨基酸,钙、锌、硒、锰等微量元素[3]。其中,虫草多糖是北虫草最丰富的成分之一,具有广泛的生物活性,包括抗肿瘤、抗炎、抗氧化、抗菌、免疫调节等功效,尤其在清除自由基的方面功能显著[4]。研究表明,人体在新陈代谢过程中会产生超氧自由基、羟自由基、过氧化氢等活性氧,但一般处于低水平的平衡状态,随着人们年龄的增长,人体清除这些自由基能力会逐渐下降,残留的自由基导致细胞和细胞膜过氧化损伤,从而加速各器官的衰老,并增加各种疾病发生的机率[5-7]。因此,具有清除自由基功效的虫草多糖可作为天然的抗氧化剂,具备成为抗氧化保健食品和化妆品原料的潜质。
目前,市场上常见的北虫草子实体有两种,一种是以蚕蛹为培养基的蛹虫草,一种是以大米为培养基的米虫草,二者因培养成本的差异导致其在市场上的价格有明显区别,但在生产和生活中常被混淆使用,对于其功效是否一致未见报道。
本试验以北虫草子实体多糖的提取为基础,以其体外抗氧化活性为指标,考察不同培养基(蚕蛹和大米)的北虫草抗氧化能力的差异,为研究北虫草多糖的药理作用及机制奠定基础,同时为进一步确立开发北虫草多糖成为抗氧化保健食品的原料来源,为吉林省北虫草生产基地提供相关信息,促进其增加北虫草的产品附加值,增强其市场竞争力。
1 材料与方法
1.1 材料与仪器
米虫草、蛹虫草:沈阳聚鑫北虫草菌业有限公司;澄清剂:北京正天澄清技术有限公司;DPPH:上海化成工业发展有限公司;三吡啶基三嗪(tripyridyltriazine,TPTZ):南京都莱生物技术有限公司;抗坏血酸:天津市永大化学试剂有限公司;无水乙醇、乙酸乙酯、冰乙酸、硫酸亚铁(均为分析纯):天津市大茂化学试剂厂。
酶标仪(Infinite M200):瑞士 Tecan公司;恒温混匀仪(ThermoMixer C):德国Eppendorf公司;恒温水浴锅(HH-S1-Ni):北京长安科学仪器厂;真空干燥箱(DZ-1BCⅡ):北京中西远大有限公司;电子天平(AL204):梅特勒-托利多仪器(上海)有限公司。
1.2 试验方法
1.2.1 虫草多糖的提取与纯化
取蛹虫草和米虫草干燥子实体粉末(40目),乙酸乙酯、无水乙醇去除脂溶性、醇溶性杂质,滤渣自然挥干,热水浸提,Sevag法去蛋白,离心,取上清液,均分5等份,分别加入无水乙醇使溶液中乙醇体积分数达到50%、60%、70%、80%、90%,静置 12 h,收集沉淀烘干,即得粗多糖。将上述粗多糖复溶,透析,除去小分子杂质,冷冻干燥得精制多糖。
1.2.2 多糖含量测定
标准曲线的绘制:称取葡萄糖标品10 mg,定容至100 mL容量瓶中,得浓度为0.1 mg/mL对照品溶液。依次吸取对照品溶液 0、0.05、0.1、0.2、0.4 mL,加 6%苯酚溶液0.5 mL,浓硫酸2.5 mL,充分振摇,室温(20℃)放置10 min。于490 nm波长处测定吸光度。以葡萄糖浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
样品含量测定:精密称定精制多糖0.1 g,定容至50 mL容量瓶中,使终浓度为2 mg/mL,充分摇匀,即得。测定方法同葡萄糖标准品溶液,根据标准曲线计算多糖含量。

式中:X为样品中多糖含量,%;C为多糖浓度,g/mL;D为样品稀释倍数;V为样品体积,mL;G为菌丝体干重,g。
1.2.3 多糖抗氧化活性测定
1.2.3.1 DPPH自由基清除率测定
将各级醇沉多糖依次配制成浓度为2、1.6、1.2、0.8、0.4、0.2、0.1、0.05 mg/mL 的待测样品溶液 100 μL,加入10 mmol/mL DPPH溶液100 μL,25℃恒温箱静置30 min,于517 nm处测量其吸光度(Ai);每组3次平行试验,以VC水溶液作阳性对照[8-9]。清除率公式计算如下:

式中:A0为蒸馏水代替样品溶液的吸光度;Aj为无水乙醇替换DPPH溶液的吸光度。
1.2.3.2 羟基自由基(·OH)清除率测定
取浓度为 5、4、3、2、1、0.5 mg/mL 的样品溶液各50 μL,加入 6 mmol/L FeSO4水溶液、6 mmol/L 水杨酸溶液、6 mmol/L H2O2溶液各50 μL,混合均匀,37℃恒温箱静置30 min在520 nm处测量其吸光度(Ai)。以VC水溶液作阳性对照[9-10]。按如下公式计算清除率:

式中:A0为蒸馏水代替样品溶液的吸光度;Aj为蒸馏水替换双氧水溶液的吸光度。
1.2.3.3 铁离子还原能力法(ferric reducing antioxidant power,FRAP)法测定北虫草多糖抗氧化能力
FRAP工作液300 mmol/L醋酸盐缓冲液(pH3.6)、10 mmol/L TPTZ 溶液、20 mmol/LFeCl3,体积比 10 ∶1 ∶1混合,现用现配,以FeSO4溶液为标准液绘制标准曲线。样品液稀释至适宜浓度,精密吸取20 μL样品溶液和150 μL工作液,于593 nm处测量其吸光度,FRAP以 FeSO4mmol/g 表示[11-13]。
1.2.4 北虫草多糖对H2O2诱导PC12细胞损伤的保护作用
1.2.4.1 北虫草多糖对正常PC12细胞的毒性试验
从两组多糖中各选出抗氧化活性较好的醇沉组分,即70%米虫草多糖(Cordyceps oryzae polysaccharide,COP),80%蛹虫草多糖(Cordycepsmilitarispolysaccharides,CMP)作为研究对象。试验分组:正常对照组(CON)、米虫草多糖(70%)试验组(0.1、1、10、100 μg/mL)、蛹虫草多糖(80%)试验组(0.1、1、10、100 μg/mL)。选取处于对数生长期的PC12细胞(5×104个/mL),接种于 96 孔板,每孔 100 μL,每组各 3 个复孔,培养24 h后,试验组加入100 μL不同浓度的北虫草多糖,对照组加入100 μL培养液,继续培养24 h后,每孔各加20 μL噻唑兰 [3-(4,5-dimethy l-2-thiazoly l)-2,5-diphenyl tetrazolium bromide,MTT](5 mg/mL),4 h后将上清液吸出,加入150 μL二甲基亚砜,摇匀,放置5 min,酶标仪490 nm处测定吸光度值[14-16]。损伤组吸光度值与正常对照组的比值即为细胞活力值。
1.2.4.2 H2O2诱导PC12细胞损伤模型的构建
取对数生长期的PC12细胞,细胞悬液浓度调整为 5×104个/mL。设置正常对照组(CON)和H2O2浓度损伤组(100、200、300、400、500 μmol/L),将细胞接种于96孔板,每孔100 μL,每组各3个复孔。于37℃,5% CO2孵箱中培养24 h后,损伤组分别加入不同浓度的 H2O2溶液 100 μL,对照组加入 100 μL 培养液,各个浓度分别损伤 1、2、3、4、5 h。损伤结束后,MTT 法测定吸光度,计算细胞活力值[17-19]。
1.2.4.3 北虫草多糖对H2O2诱导PC12细胞损伤的保护作用
选取处于对数生长期的PC12细胞(5×104个/mL),将其接种于96孔板,设置正常对照组(CON)、模型组(MOD)、米虫草多糖(70%)试验组(0.1、1、10、100 μg/mL)、蛹虫草多糖(80%)试验组(0.1、1、10、100 μg/mL)。每孔中加入细胞悬液 100 μL,在 37 ℃,5% CO2孵箱中培养24 h,模型组与试验组每孔加入100 μL浓度为300 μmol/L的H2O2溶液培养3 h后将模型组和试验组每孔吸出100 μL上清液,试验组加入不同浓度的北虫草多糖溶液100 μL,对照组与模型组各加入100 μL培养液,继续培养24 h,每孔各加20 μL MTT(5 mg/mL),4 h 后将上清液吸出,加入 150 μL 二甲基亚砜,摇匀,放置5 min,酶标仪490 nm处测定吸光度值,计算细胞活力值[18,20-22]。
1.2.5 数据统计与分析
每组试验平行测定3次。采用软件SPSS 19.0进行统计学分析。多糖含量、FRAP值均以(±S)表示,试验数据分析由Graphpad Prism7.00统计软件处理,多组间比较采用单因素方差分析,组间两两比较采用t检验。以P<0.05为差异有统计学意义。
2 结果与分析
2.1 多糖含量测定
2.1.1 葡萄糖标准曲线
葡萄糖溶液标准曲线见图1。
以葡萄糖为对照品溶液,绘制标准曲线,得回归方程Y=0.014 9x-0.009 2,相关系数R2=0.999,线性关系良好。
2.1.2 含量测定
两种虫草多糖提取率及纯度比较见表1。

图1 葡萄糖溶液标准曲线Fig.1 Standard curve of glucose solution
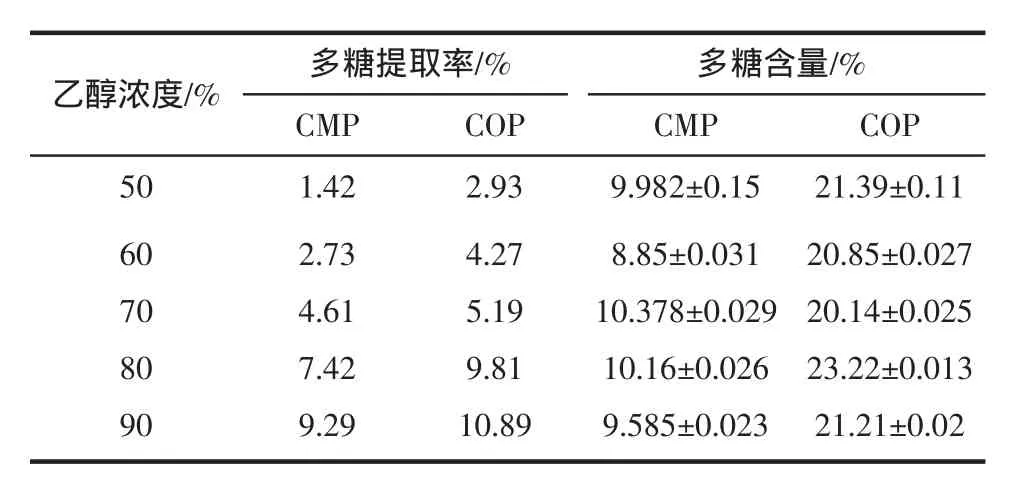
表1 两种虫草多糖提取率及纯度比较Table 1 Comparison of extraction rate and purity of CMP and COP
由表1结果可知,随着沉淀体系中乙醇浓度的升高,米虫草多糖与蛹虫草多糖的提取率逐步增多,但各级醇沉组分多糖含量分布不均。多糖提取率以冻干后的多糖质量占虫草子实体粉末的质量百分数表示[23]。
2.2 抗氧化活性分析
2.2.1 DPPH自由基清除率
由不同浓度乙醇沉淀的虫草多糖对DPPH自由基清除率见图2。
由图2结果分析可知,米虫草多糖和蛹虫草多糖都具有清除DPPH自由基的作用,且清除能力呈量效正相关。乙醇浓度为50%时,两种多糖对DPPH自由基的清除率无显著差异,乙醇浓度为70%时,米虫草多糖作用效果略高于蛹虫草多糖,其余各级醇沉组分中蛹虫草多糖清除能力较强,与米虫草多糖相比差异较显著。
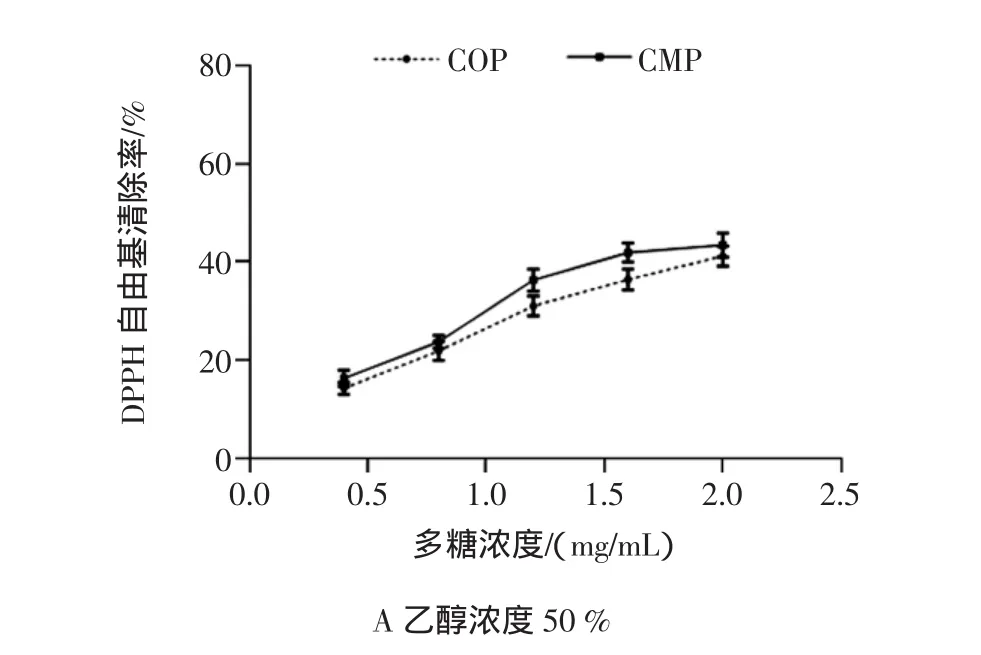

两种虫草各级醇沉组分组间清除DPPH自由基能力大小顺序如图1G、图1H所示,米虫草多糖各级醇沉组分清除能力依次为70%、90%、80%、60%、50%。蛹虫草多糖各级醇沉组分清除能力依次为80%、70%、90%、60%、50%。

图2 不同浓度乙醇沉淀的两种虫草多糖DPPH自由基清除率比较Fig.2 Comparison of DPPH radical scavenging rate of COP and CMP precipitated by different concentrations of ethanol
2.2.2 ·OH清除率
由不同浓度乙醇沉淀的虫草多糖对·OH清除率见图3。
由图3结果分析可知,两种多糖各组分对羟基自由基均有一定的清除作用。乙醇浓度为70%时,米虫草多糖清除率略高于蛹虫草多糖,其余各级醇沉组分相比蛹虫草多糖作用效果好。米虫草各级醇沉组分组间清除羟基自由基能力依次为80%、70%、90%、60%、50%,蛹虫草多糖各级醇沉组分清除能力大小与DPPH自由基清除能力一致。
2.2.3 北虫草多糖的FRAP值
FeSO4标准曲线见图4。


图3 不同浓度乙醇沉淀的虫草多糖对羟基自由基清除率比较Fig.3 Comparison of hydroxyl radical scavenging rate of COP and CMP precipitated by different concentrations of ethanol

图4 FeSO4标准曲线Fig.4 FeSO4standard curve
根据593 nm测得FeSO4溶液的吸光值,绘制FeSO4标准曲线,得回归方程Y=0.743x+0.038 3,相关系数R2=0.999 7。
不同乙醇浓度沉淀的虫草多糖FRAP,见图5。

图5 不同乙醇浓度沉淀的虫草多糖FRAPFig.5 FRAP of COP and CMP precipitated with different ethanol concentrations
由图5结果分析可知,蛹虫草多糖对Fe3+的还原能力高于米虫草多糖。在两种虫草的不同醇沉组分中,90% CMP、70% COP 对 Fe3+的还原能力较强,FRAP分别为 0.744 4、0.564 7 mmol/g。
2.3 两种虫草多糖对H2O2诱导损伤的PC12细胞的保护作用
2.3.1 北虫草多糖对正常PC12细胞的毒性试验
北虫草多糖对正常PC12细胞的增殖影响见图6。
由图6结果可知,两种不同来源北虫草中的多糖对PC12细胞的生长均无细胞毒性,浓度达到10、100 μg/mL时可促进细胞显著增殖。
2.3.2 H2O2诱导PC12细胞损伤模型的构建
H2O2浓度及损伤时间的筛选见图7。
由图7结果分析可知,随着H2O2浓度和损伤时间增加,PC12细胞的损伤情况也随之加重,当H2O2浓度为300 μmol/L、损伤时间3 h时,细胞活力为57.91%,损伤程度适宜,因此将其作为构建PC12细胞损伤模型的条件。
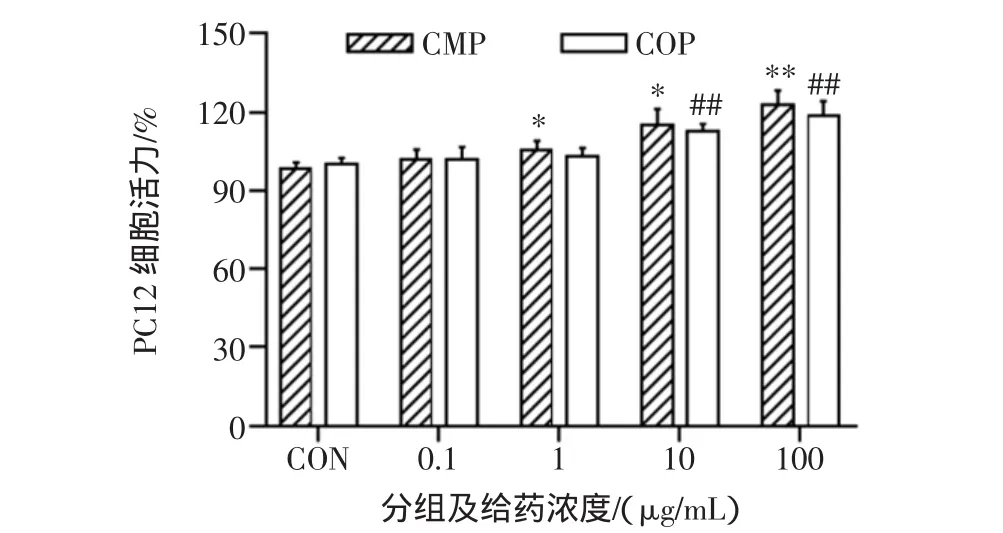
图6 两种虫草多糖对PC12细胞增殖的影响Fig.6 Effect of COP and CMP on the proliferation of PC12 cells

图7 H2O2浓度及损伤时间的筛选Fig.7 Screening of H2O2concentration and injury time
2.3.3 北虫草多糖对H2O2诱导PC12细胞损伤的保护作用
北虫草多糖对H2O2损伤的PC12细胞活力的影响见图8。

图8 两种北虫草多糖对H2O2损伤PC12细胞活力的影响Fig.8 Effect of COP and CMP on the viability of PC12 cells injured by H2O2
由图8分析可知,经H2O2处理后,PC12细胞的生长受到显著抑制(P<0.01),与正常细胞相比,其存活率下降为57.63%。经北虫草多糖处理后,细胞的增殖活性呈现升高趋势,当剂量达到100 μg/mL时,细胞存活率的升高具有显著性差异(P<0.01),蛹虫草多糖细胞存活率达到90.45%,米虫草多糖细胞存活率达到82.62%。
3 结论
在对两种不同来源虫草的多糖研究中发现,米虫草多糖在提取率及含量方面高于蛹虫草多糖,两种多糖的提取率随着乙醇浓度增加而增加,但多糖含量分布不均。两种北虫草的各级醇沉多糖中,80% CMP和70% COP清除自由基能力较强;FRAP法结果表明蛹虫草各级醇沉组分作用效果优于米虫草。结合两种虫草组间各级醇沉多糖抗氧化能力分析,当乙醇浓度为70%~90%时所得多糖体外抗氧化效果较好,但从资源成本方面考虑,不宜用90%的浓度进行醇沉。总体来看,两种虫草多糖均具有一定的体外抗氧化能力,蛹虫草多糖作用效果优于米虫草多糖。
根据体外抗氧化能力试验结果,选取沉淀体系为乙醇浓度80%的蛹虫草多糖和70%的米虫草多糖为研究对象。当多糖浓度为10 μg/mL和100 μg/mL、作用时间24 h时,可显著促进正常PC12细胞的增殖。由H2O2诱导氧化损伤的PC12细胞经两种不同来源的虫草多糖处理后,细胞存活率都有不同程度的提升,呈浓度依赖性;当多糖浓度为100 μg/mL时,细胞存活率显著增加,且蛹虫草多糖作用效果优于米虫草多糖,与体外抗氧化活性测定结果一致。试验通过确定二者在有效成分含量和功效方面的差异,可为提高北虫草质量控制标准提供理论和试验基础。
