参芪扶正注射液防治药物心脏毒性的网络药理学作用机制研究
2020-10-14黎耀和古学奎
何 靖,黎耀和*,余 莹,古学奎
(1.广州中医药大学第一附属医院,广东 广州 510405;2.广州中医药大学,广东 广州 510405)
随着肿瘤发病率的日益递增,化疗已经成为了抗肿瘤不可或缺的治疗方案之一。然而,常用化疗药物如阿霉素、氟尿嘧啶、紫杉醇等,均对患者心肌细胞产生了一定毒害作用,导致心肌损伤、心功能受损,出现胸闷、心悸、呼吸困难、心肌酶改变,甚则心衰等系列临床表现。Kilickap等[1]研究发现,高达65%患者在蒽环类药物治疗后出现了心率失常等心脏毒性的表现,且随着药物应用剂量增加,其对心脏的累积毒性作用也越来越大[2]。药物导致的心脏毒性极大地限制了其临床应用,因此,临床诊疗工作中,预防如蒽环类等抗肿瘤药物所致的心脏毒性尤为重要。中医药凭借其固本祛邪、安全低毒等特点,在改善化疗药物不良反应上显现着巨大优势。其中,由党参和黄芪为主方的参芪扶正注射液,具有益气扶正固本的功效,能很好地改善患者因正气虚弱而出现的心悸、气短、乏力等心气虚表现,恰体现中医 “虚则补之”的治疗原则。临床观察[3-5]表明该药有改善心肌供血、保护心脏等功效,可防治及减轻对心脏毒性,使得其在临床中应用愈加广泛,然其具体作用机制尚无报道。本研究试通过网络药理学探究参芪扶正注射液防治心脏毒性的作用机理,以期为临床医生在工作中防治心脏毒性和改善患者预后提供临床用药及实验室验证的依据。
1 材料和方法
1.1 化学成分构建及筛选 在中药系统药理学分析平台(TCMSP)(http://lsp.nwu.edu.cn/tcmsp.php)检索参芪扶正注射液的组成中药党参、黄芪的所有化学成分,共搜集了221 个化合物,其中党参134 个、黄芪87 个。为更好的筛选药对中的有效化合物,本研究联合口服利用度(OB)、类药性(DL)与CaCo-2 细胞渗透性进行中药活性成分的筛选。其中OB 反映的是药物被机体吸收进入循环的百分比;DL 代表类药性,能够反映化合物中特定的功能基团与大多数药物相同或相似的物理特征;CaCo-2 细胞渗透性则可反映小肠上皮细胞对药物的转运效率。基于此,将OB≥30%、DL≥0.18、CaCo-2 细胞渗透性≥0 作为化合物分子的筛选标准。同时,结合手动查阅及检索结果,以确保最大程度纳入药物的活性成分。
1.2 药物靶点筛选 在TCMSP 数据库中查找与筛选出的药对活性分子相对应的蛋白靶点;同时利用UniProt 数据库(https://www.uniprot.org/),查询靶点蛋白对应的人类基因名称,进行名称标准化处理后录入Excel 表格。
1.3 疾病靶点筛选 以“cardiotoxicity”“cardiac toxicity”为关键词,检索人类孟德尔遗传数据库(OMIM,http://www.ncbi.nlm.nih.gov/omim)与GeneCards 数据库(http://www.genecards.org/),查找与心脏毒性相关的靶基因,合并2 个数据库的搜索结果,去除重复和假阳性的基因,以score>5 作为疾病靶点筛选的标准。
1.4 网络构建 运用UniProt 数据库,查询参芪扶正注射液中活性分子的相关靶点,将药物作用靶点与疾病相关靶点进行映射,从而获取共同靶点,使用Cytoscape 3.7.1 软件构建中药活性成分-疾病靶点相互作用的网络图。并运用String 数据库(https://string-db.org/cgi/input.pl),对靶点进行蛋白质互作用(PPI)网络构建。
1.5 GO 富集和KEGG 通路富集 为了阐明参芪扶正注射液防治心脏毒性的作用机制,将网络中的靶蛋白投射到DAVID 6.8(https://david.ncifcrf.gov/),进行GO 功能富集和KEGG 通路富集,从生物过程及信号通路程角度分析具体作用机制,继而绘制靶点-通路网络图。
2 结果
2.1 药物筛选结果 研究结果表明,参芪注射液组方中有34 个活性成分满足OB、DL、CaCo-2 细胞渗透性的要求,其中党参含有19 个活性成分,黄芪含有15 个活性成分,通过分析相关文献及结合现代药理学研究结果,证实黄芪多糖及黄芪皂苷Ⅰ、Ⅱ、Ⅲ、Ⅳ均为黄芪的活性成分,故该5 个成分亦纳入本药物成分筛选结果,得到黄芪活性成分共20 个。表1 为39 个活性化合物基本信息。
2.2 靶点预测结果 在TCMSP 数据平台上检索出药物活性成分所对应的蛋白靶点,再利用UniProt 数据库,检索与之对应的人类基因名称,最终得到529 个靶点基因。检索Genecards 及OMIM 数据库,分别得到靶基因6237、113 个,合并去重后得到6 341 个。将参芪注射液组方中药的529 个靶基因与心脏毒性疾病相关基因6 341 个进行映射,得到共同靶基因105 个。此105 个靶基因可视为参芪扶正注射液防治药物心脏毒性的有效活性成分作用靶点,由此建立参芪扶正注射液药物-活性成分-心疾病靶点网络图(见图1),其中,矩形代表疾病靶基因,椭圆形代表药物活性成分。
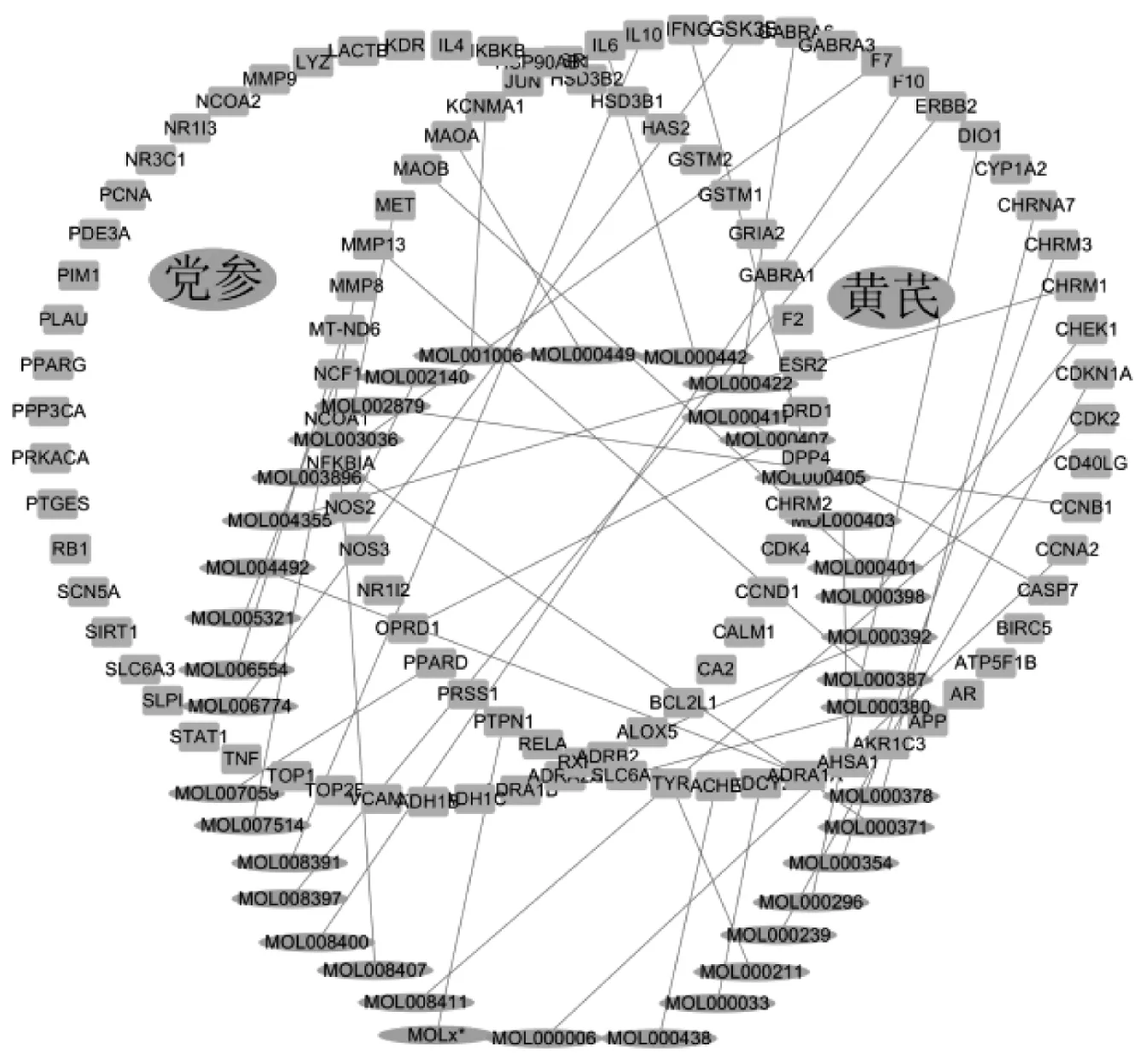
图1 药物-活性成分-疾病靶点网络图
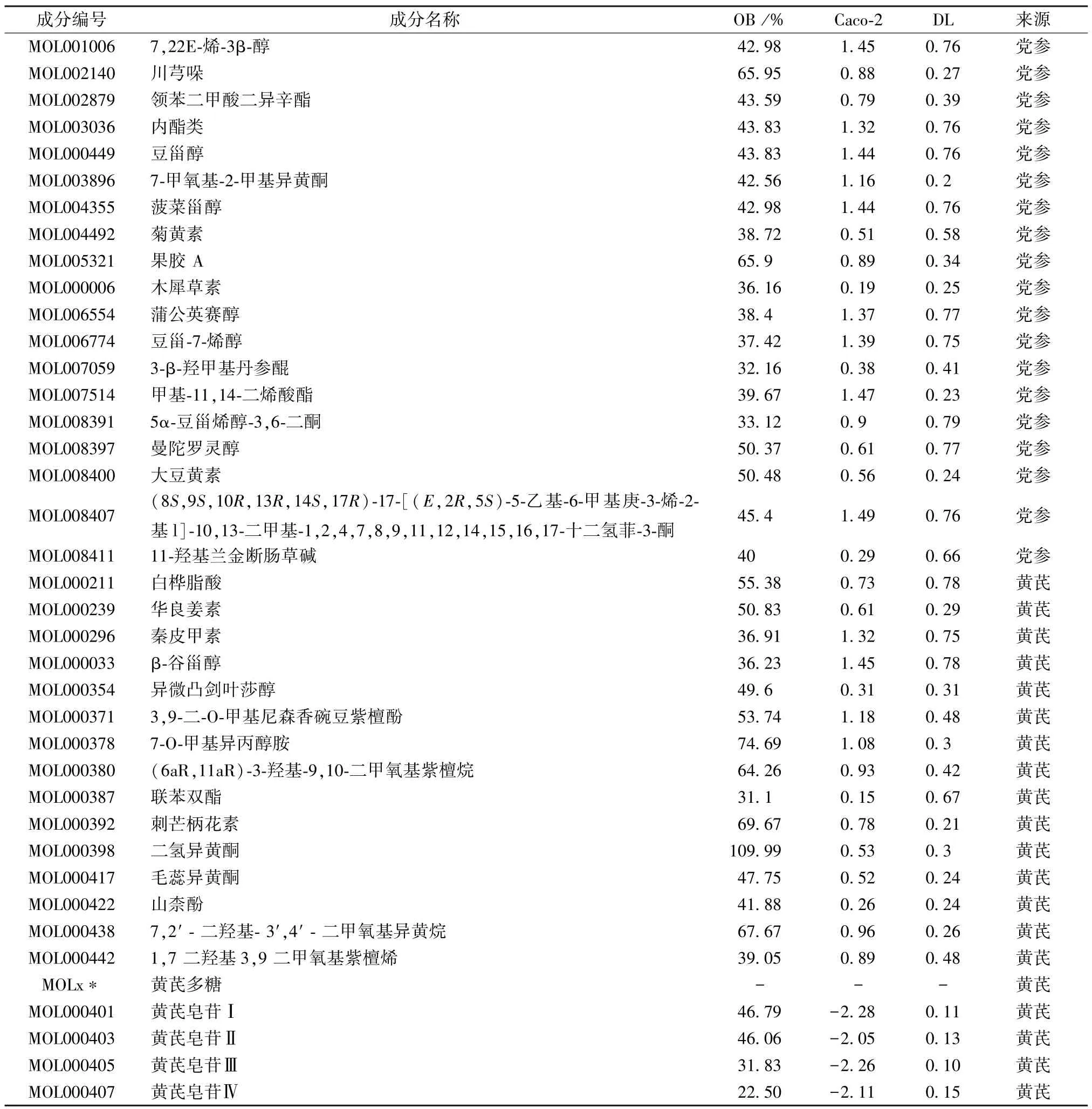
表1 党参、黄芪活性成分
2.3 蛋白相互作用图构建 将得到的活性成分作用靶点导入String 数据库,进行PPI 网络构建(见图2)。图中共有102 个节点,671 条边,其中Degree 较大者为IL6、TNF、JUN、AR、RELA、CCND1(Degree 分别为46、42、42、34、33),提示这些蛋白是参芪扶正注射液防治药物心脏毒性的关键蛋白靶点。
2.4 GO 功能富集分析 借助于DAVID 软件对参芪扶正注射液防治心脏毒性所涉及的105 个靶蛋白进行GO 功能富集分析。以P<0.001 为筛选条件,确定出24 个条目。在GO 功能富集包含的3 个子类中,生物过程(biological process,BP)类条目有15 个、细胞组分(cellular component,CC)类条目有3 个、分子功能(molecular function,MF)类条目有6 个。主要涉及“positive regulation of transcription from RNA polymerase II promoter”、“transcription,DNA-templated”、“extracellular space”、“cell junction”、“steroid hormone receptor activity”等生物学过程(见图3)。
2.5 KEGG 通路富集分析 在DAVID 软件中对105 个靶蛋白进行KEGG 通路富集分析。以P<0.001 为筛选条件,并排除如“Small cell lung cancer”“Influenza A”等与心脏毒性不相关的通路,最后确定出13 条KEGG 通路(见表2),并做出KEGG 通路富集分析图(见图4)。

图3 基因本体论(GO)功能富集

表2 KEGG 通路富集

图4 KEGG 通路富集
根据靶点与信号通路之间的联系,建立靶点-通路网络图(见图5),其中蓝色、绿色菱形表示疾病靶点,红色椭圆形表示信号通路。
3 讨论
自1973 年,Lefrak 首次报道蒽环类药物诱发心脏毒性以来,心脏毒性一词引起了医学界尤其是肿瘤科医师的广泛关注。心脏毒性可概况为在一定使用剂量、治疗时间内,由药物本身导致的急慢性心肌细胞损害,出现心律失常、射血功能降低等心脏功能受损表现[6]。其导致心脏毒性的机制尚不明确,可能的机制为钙超载、铁离子代谢紊乱、氧化应激产物的形成、细胞凋亡程序的启动、自由基的作用[7-8]。化疗药物的累积剂量被认为是导致心脏毒性最重要的影响因素,随着累积剂量的不断增加,心衰的发生的可能性也逐步增加。因此,加强对心脏毒性的早期诊断,及时给予治疗干预措施,对患者的生活质量及预后意义重大。右丙亚胺作为目前唯一被FDA 批准的用于心脏毒性的防治药物[9],它可迅速、完全地结合铁离子,甚至置换出部分化疗药与铁复合物中的铁,并与药物螯合,减少自由基的形成,从而发挥心脏保护作用[2、10],然而,其昂贵的价格限制了临床的广泛应用[11]。此时,中医药在防治心脏毒性上凸显出独特优势,其不仅被灵活运用于扶助机体正气、增强对化疗药物的耐受性上,亦可增效减毒,在减轻心脏毒性中发挥着重要作用[12-13]。
从中医角度观之,心脏毒性的对应于“心悸病”范畴,临床表现以心悸、胸闷、胸痛、气短为多见,后期尚见疲倦乏力、少气懒言、自汗、失眠等症,舌多暗淡,脉多沉细涩,辨证当以“心气虚证”居多。缘素体先天禀赋不足,正气受损,加上药物的“药毒”之邪,直中心脏,故治疗当以益气扶正为法。参芪扶正注射液功专扶正固本、补益正气。临床病例研究表明,参芪扶正注射液有助于减轻心肌损伤及抑制心肌纤维化进程[14],可通过改善心率、心输出量、左室射血分数以治疗心衰[15],且能改善患者体虚、心悸、气短、乏力等症状;药理研究推测,参芪扶正注射液通过上调某些蛋白表达、保护线粒体、溶酶体等,起到抑制缺血再灌注心肌细胞凋亡、保护心肌细胞[16]。
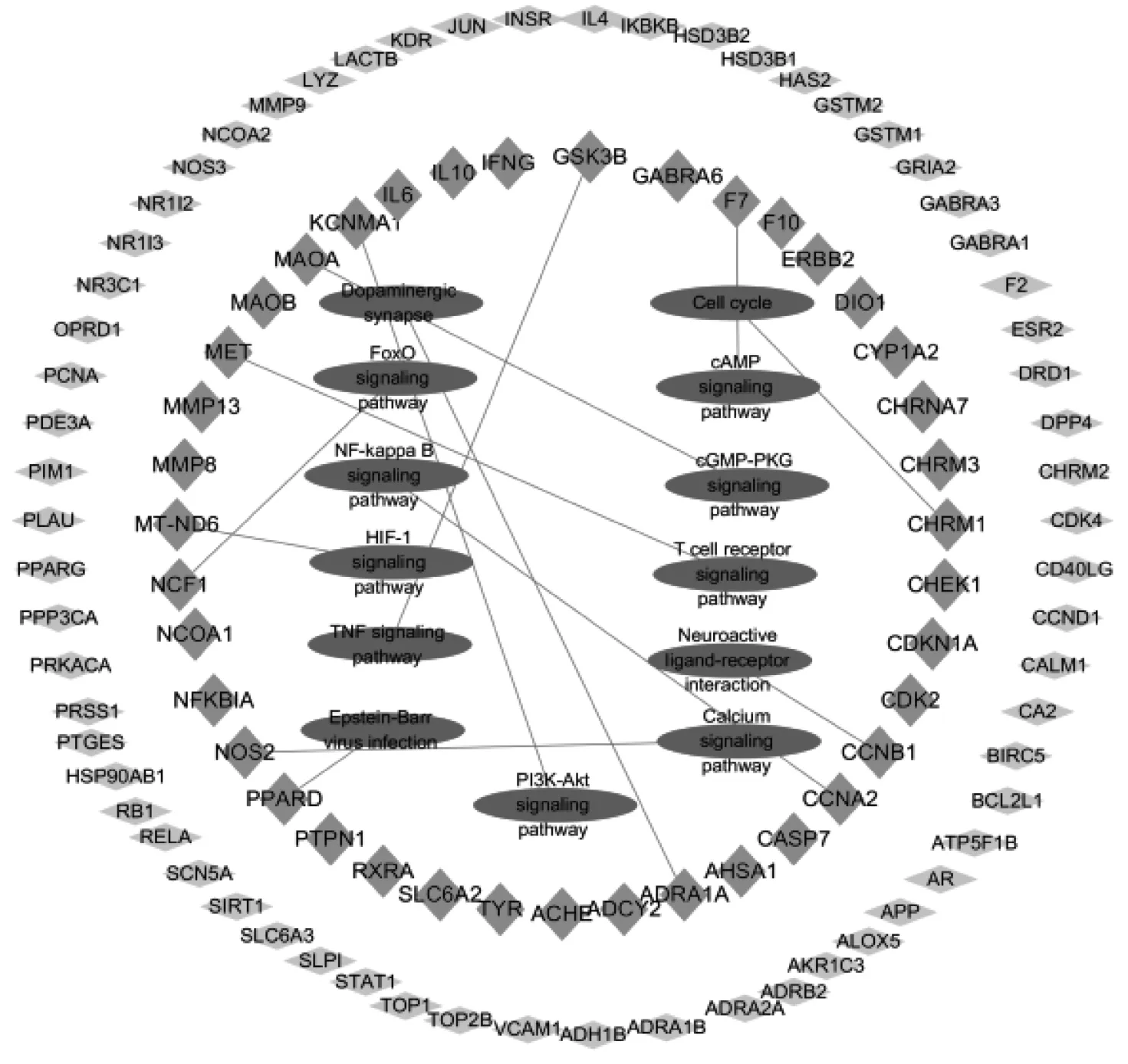
图5 靶点-通路网络图
现阶段,尽管愈来愈多的研究者将目光转向对参芪扶正注射液防治心脏毒性的研究上,但是,检索国内外文献发现,目前尚无对其发挥作用的有效化学成分、作用靶点、信号通路及生物学途径等机制的研究。因此,借助网络药理学平台明确其发挥临床疗效的活性成分及作用靶点成为了现代中医药研究的新方向。通过分析本研究结果,得出以下结论:首先,参芪扶正注射液所含药物的活性成分在心脏毒性防治上存在多成分、多靶点、多向作用的特点,中药成分“一对多”发挥多靶点调控的作用,这恰体现出中医整体治疗作用的优势。其次,通过整合分析得出,其发挥疗效的关键靶点为IL-6、TNF、JUN、AR、RELA、CCND1 等。目前已有研究证实,IL-6、TNF、JUN、AR 与心肌损伤关系密切,心力衰竭患者常伴有细胞因子如肿瘤坏死因子TNF-α、IL-6 的分泌增加,同时,IL-6、TNF 尚能直接或间接激活MAPK、PI3K-Akt、m TOR 信号通路加重心肌损伤[17]。JUN 作为一种原癌基因,其编码的c-jun 蛋白是转录因子AP-1 家族的组成成员,在调控细胞的增殖、分化、侵袭和凋亡方面起关键作用[18-19],JUN 参与心肌缺血再灌注损伤,并通过激活JNK-MAPK 等信号通路诱导心肌细胞凋亡,研究发现心源性猝死者心肌细胞中C-JUN 高表达[20]。心脏损害被认为是从机体交感神经系统的肾上腺素信号激活开始的,β-肾上腺素能系统在心血管系统的结构和功能调控中意义重大[21]。肾上腺受体(Adrenergic Receptor,AR)作为该信号通路的关键组成部分,包括如β1-AR、β2-AR、β3-AR、α2C-AR 等多种亚型,AR 被激活后,刺激肾上腺素系统释放更多的肾上腺素,加重心功能衰竭[22]。例如,β3-AR 作为近年发现的β-AR 的亚型,与心肌细胞兴奋-收缩耦联功能相关[23]。β3-AR 激动剂可以使心室肌细胞内钙离子浓度下调,而在心力衰竭的心肌细胞中,钙浓度下调程度较轻[24]。RELA 与CCND1 在心脏疾病中的报道较少,而本研究提示,其在参芪扶正注射液防治心脏毒性中亦是重要的疾病靶点,这或许可为后续研究提供一定线索。RELA 作为NF-κB 家族的成员之一,其翻译后经过磷酸化、乙酰化、甲基化等修饰,可以精准调控NF-κB 的转录及激活,NF-κB 参与调控心肌细胞的增殖、凋亡,并在炎症以及免疫应答等重要的生命活动中发挥作用[25-26],这或许是其对心脏发挥保护作用的途径。目前对于CCND1 的研究焦点多集中在肿瘤性疾病中,它作为原癌基因,在多种实体肿瘤中都有表达,CCND1 基因编码的产物Cyclin D1 是调控细胞周期G1 期的关键蛋白,主要功能是促进细胞增殖,推动细胞周期由G1 期进入S 期[27-28],而在心脏损害中,动物实验提示,Ccnd1 基因表达下调后,大鼠心脏成纤维细胞增殖受到抑制[29]。
本研究中KEGG 通路富集分析表明,参芪扶正注射液防治心脏毒性的主要作用途径为钙信号通路、PI3K-Akt 信号通路、神经活性配体通路、T 细胞受体信号通路、cGMPPKG 信号通路、cAMP 信号通路等,具体生物学功能表现在对RNA 聚合酶II 启动子转录的正向调控、DNA 转录、细胞外间隙及细胞连接的调控、类固醇激素受体活性的调节。心脏是循环系统的动力泵,心肌细胞的节律性收缩舒张,使得其本身就是一个高耗能的器官,而肌浆网上的Ca2+泵为心肌细胞的收缩提供了30% -40%能量[30]。钙信号通路对心脏功能的调节、维持细胞稳态、提供能量均发挥了重要的作用。在钙信号通路的调控下,外钙诱导内钙释放引起心肌细胞收缩,再由肌浆网钙ATP 酶介导钙离子的重摄,引起心肌细胞的舒张[31-32]。PI3K/Akt 通路作为细胞内重要的信号转导通路,与心肌损伤、缺血、衰竭关系密切[33-35],动物实验推测,药物可通过干预PI3K/Akt 信号通路减轻心脏移植心肌冷缺血再灌注损伤[36];另有研究提示中药干预PI3K-Akt 通路可视为药物发挥减轻心肌细胞损伤、抗心肌纤维化、逆转心衰、改善心功能、抑制心室重构的作用机制[37-38],此皆提示PI3K/Akt 通路与心脏关系密切。存在于质膜上的多种不同类型的受体及配体组成了神经活性配体通路的重要部分,在神经活性配体信号通路的调控下,神经组织的刺激分子与对应的受体结合后,发挥对生理节律、内分泌等不同生物功能的调节[39],其中对心血管系统的调控使之成为参芪扶正注射液防治心脏毒性的作用途径,药物活性成分对该信号通路的干预,引起心肌节律、心脏功能的变化。T 细胞受体信号通路是将抗原信号传递至细胞内的重要途径,MHC 分子将抗原递呈,抗原与T 细胞受体(T-cell receptor,TCR)结合,从而启动TCR信号通路。该通路激活使得下游机体T 细胞产生免疫应答,继而抗体异常生成,导致免疫性疾病的发生,机体在清除抗原的免疫应答过程中,易诱发自身免疫性疾病、炎性疾病,对心肌细胞产生损伤[40],有研究发现,异常的TCR信号通路在自身免疫性扩张型心肌病中起着重要作用[41]。cGMP-PKG 与cAMP 信号通路在心脏疾病中发挥了重要作用,二者作用相反,共同调节心脏活动。作为衡量心脏功能的敏感指标,cAMP 对心脏具有正性肌力作用,能增强心肌收缩力,减少外周阻力,增加泵血量;cGMP 则与之相反,其发挥的生理效应与心脏功能负相关[42]。实验表明,血清cAMP、cGMP 含量、cAMP/cGMP 比值可以反映充血性心力衰竭动物模型的病变程度[43]。
总之,参芪扶正注射液在对心脏毒性的临床防治中应用广泛,然而其实验机制研究甚少。基于此,课题组从作用机制切入,利用网络药理学方法,进一步探讨其参芪扶正注射液防治心脏毒性的有效活性成分、关键靶点、生物学功能以及信号通路,根据本研究结果,我们后期将开展动物实验、细胞实验进行机制验证,以期为临床应用提供更充足的实验基础和理论支撑。同时,翼对今后挖掘其它防治化疗药物心脏毒性的中药、让中医药更好服务于临床提供一定研究思路。
