磷酸甘油酸变位酶1及其抑制剂的研究进展
2020-10-13梁倩陈红专沈瑛
梁倩,陈红专,沈瑛*
(1. 上海交通大学医学院药理学与化学生物学系,上海 200025; 2. 上海市转化医学协同创新中心,上海 200025;3. 上海中医药大学,上海 201203)
肿瘤细胞在有氧环境下提高糖酵解率和乳酸产量以满足快速增殖的能量需求方式被称为Warburg效应[1]。磷酸甘油酸变位酶1(phosphoglycerate mutase 1,PGAM1)是糖酵解通路中的代谢酶之一,其可催化3-磷酸甘油酸(3-phosphoglycerate,3-PG)转化为2-磷酸甘油酸(2-phosphoglycerate,2-PG),调控底物和产物的转化平衡,进而影响糖酵解通路速率及其他代谢通路,促进肿瘤生长[2]。研究发现,PGAM1不仅通过其代谢酶活性参与肿瘤的发生发展,还可以通过非代谢酶功能介导肿瘤转移[3]。PGAM1有望作为抗肿瘤治疗的新靶点,其抑制剂也成为研究热点[4]。
1 磷酸甘油酸变位酶1的结构和催化机制
编码PGAM1基因位于染色体10 q25.3,其cDNA长度为 1 709 bp,编码254个氨基酸长度的蛋白,相对分子质量为28 784[5]。研究发现,His11、Arg62和 His186均位于PGAM1活性位点[6]。PGAM2与PGAM1约有80%的同源性,在人类基因组中PGAM2仅有一个基因拷贝,PGAM1则是多拷贝基因,因此认为PGAM2基因可能来源于PGAM1[7]。PGAM3和PGAM4最初被认为是假基因[8-9],随着研究的深入发现,PGAM3活动中心的必需氨基酸序列与PGAM1相同,表明PGAM3可能与PGAM1有相似的酶活性[10],PGAM4则主要在睾丸中表达,与男性不育有关[11]。PGAM5定位在线粒体外膜,虽然在结构上属于磷酸甘油酸变位酶家族,却缺乏酶活性,可作为一种特殊的丝/苏氨酸磷酸酶参与细胞凋亡[12-13]。
PGAM1通过“乒乓机制”来催化3-PG到2-PG之间的可逆转化[14](见图1)。在反应开始阶段,PGAM1的His11氨基酸残基被磷酸化,PGAM1处于激活状态。当3-PG进入反应口袋,PGAM1的His11残基上的磷酸根转移到3-PG上形成2,3-二磷酸甘油酸(2,3-diphosphoglycerate,2,3-BPG);而去磷酸化后的PGAM1发生构象改变,促进2,3-BPG上3位的磷酸根转移到PGAM1的His11残基上,PGAM1恢复其开始的激活状态并生成2-PG。

图 1 PGAM1催化反应的“乒乓机制” [14]Figure 1 The "ping-pong mechanism" of PGAM1 catalytic reaction [14]
Hitosugi等[15]解析了更高分辨率的人源PGAM1的晶体结构(PDB: 4GPI,2.02 Å;4GPZ,1.65 Å),这2个PGAM1结构分别是His11未磷酸化的原始状态和His11被磷酸化的激活状态(见图2)。 对比2个结构发现,在His11磷酸化的PGAM1中,靠近His11的loop(12-23)有较大的构象改变,控制着活性口袋的开关(见图2a)。在His11未被磷酸化的原始状态中,Tyr26与Trp16相互堆叠,带负电的Glu19占据着带正电的底物结合口袋,阻止了2,3-BPG和3-PG进入活性口袋,且Glu19与Ser14和Ser23形成氢键,进一步稳定了该原始状态PGAM1的构象(见图2b)。而在His11磷酸化的PGAM1中,Glu19不再占据底物结合口袋,磷酸化的His11的带负电的磷酸根进入活性反应区,并且,磷酸化的His11通过磷酸根与周围的Arg10、Arg62和Glu89形成很强的氢键,这些氢键相互作用也稳定了His11磷酸化的激活状态PGAM1的结构(见图2c)。
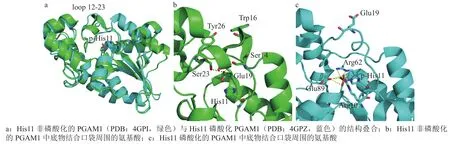
图 2 His11磷酸化和His11非磷酸化PGAM1的结构对比[15]Figure 2 Structural comparison of PGAM1 with His11 phosphorylation and His11 non-phosphorylation [15]
2 磷酸甘油酸变位酶1与肿瘤的关系
PGAM1在多种肿瘤中普遍高表达,如乳腺癌[16]、胆管癌[17]、肾透明细胞癌[18]、前列腺癌[19]和胶质瘤[20]等。临床数据结果统计发现,PGAM1表达水平与肿瘤患者预后呈负相关,与肿瘤组织分级和严重程度呈正相关,如肺癌[21]、口鳞状细胞癌[22]、泌尿道上皮膀胱癌[23]、结直肠癌[24]、肝癌[25]、胰腺癌[26]等,在肿瘤的发展进程中扮演重要角色。
Cortesi等[16]通过双向凝胶电泳和质谱法检测了乳腺癌患者的组织液,发现PGAM1在肿瘤间质液中显著高表达。另有研究发现雌激素受体阴性/黄体酮受体阴性乳腺癌患者中,PGAM1表达明显高于类固醇受体阳性乳腺癌患者[27]。Ishikawa等[28]发现原代培养的乳腺癌细胞中不仅PGAM1增加,而且表现出与癌症相关的成纤维细胞样特性。Shen等[17]通过western blot证实PGAM1在胆管癌患者的胆汁样本中显著上调。研究表明,PGAM1可能是胆管癌的一种潜在的生物标志物。免疫组化结果表明,肾透明细胞癌中PGAM1表达高于正常肾组织,并且与患者年龄、肿瘤大小和T分期有显著的相关性[18]。Wen等[19]检测发现PGAM1在前列腺癌组织和细胞系中表达上调,PGAM1表达与Gleason评分和T分期相关;下调PGAM1能够抑制前列腺癌细胞的增殖、迁移和侵袭,诱导癌细胞发生凋亡,提示PGAM1在前列腺癌的进展和侵袭过程中发挥重要作用,可能是预后不良的有价值的标志物和潜在的治疗靶点。Gao等[20]发现胶质瘤病人样本中PGAM1的表达量显著高于正常脑组织,并且PGAM1的表达量与胶质瘤患者的分级及生存相关。当siRNA敲除PGAM1后,显著抑制胶质瘤细胞增殖,促进细胞凋亡,诱导S期细胞周期阻滞,抑制细胞迁移和侵袭[29]。Sanzey等[30]通过全基因组测序发现,缺氧条件下胶质瘤中PGAM1水平明显升高。
Huang等[31]通过逆转录-聚合酶链反应(reverse transcription-polymerase chain reaction,RT-PCR)发现非小细胞肺癌病人肿瘤组织中PGAM1明显高于癌旁组织, PGAM1的异常高表达与肺癌病人的不良预后密切相关[21]。Zhang等[22]通过对口腔鳞状细胞癌患者组织标本进行分析,发现PGAM1的表达与病人年龄、淋巴转移和肿瘤复发相关,并且高表达PGAM1的病人总生存期和无病生存期较短。Turhani等[32]发现PGAM1可作为口腔鳞癌中潜在的诊断标志物,具有临床意义。Usuba等[24]研究发现PGAM1在结肠直肠癌患者中显著高表达,Liu 等[33]发现PGAM1 能够与T细胞淋巴瘤的侵袭和转移诱导蛋白1相互作用,激活Rac介导的结直肠癌转移。分子机制探究和病理分析表明PGAM1与结直肠癌的转移潜能密切相关[34]。临床病理分析表明,肝癌中PGAM1蛋白过表达,且与低分化、低生存率密切相关。敲低PGAM1导致肝癌细胞的生长受到明显抑制。研究发现,PGAM1在肝癌发生过程中起着重要的作用,是一种潜在的诊断性生物标志物[25]。Liu等[26]研究发现,PGAM1的过表达与胰腺导管腺癌患者的转移、临床晚期、生存率低呈正相关,敲低PGAM1抑制胰腺导管腺癌细胞增殖,表明PGAM1与胰腺癌的临床转移及不良预后密切相关。
3 磷酸甘油酸变位酶1在肿瘤发生发展中的作用
PGAM1在糖酵解通路中催化3-PG转化为2-PG,不仅能调控糖酵解速率,而且还通过调控底物和产物的浓度来影响其他代谢酶活性,进而影响整个代谢网络,在肿瘤生长中发挥着重要作用。Hitosugi等[2]研究发现,3-PG在细胞内的积累会竞争性抑制6-磷酸葡萄糖酸脱氢酶活性,影响磷酸戊糖途径,降低核苷酸等物质的生成;2-PG的积累则增强糖酵解通路向丝氨酸合成通路转变的起始关键酶磷酸甘油酸脱氢酶的活性,促进丝氨酸的生成,因此,PGAM1能同时调控有氧糖酵解、磷酸戊糖途径和丝氨酸合成通路,实现对能量代谢和氨基酸、核苷等生物大分子合成的诸多调控(见图3)。其中,Tyr26残基对于PGAM1至关重要,PGAM1 Tyr26磷酸化促使Glu19从活性中心释放,His11进而与2,3-BPG结合稳定PGAM1结构,增强酶活性[15]。
Ren等[25]对PGAM1调控肿瘤细胞增殖的机制提出一种新的可能性:PGAM1活性的改变影响了ATP的合成,AMP依赖的蛋白激酶 [adenosine 5'-monophosphate (AMP)-activated protein kinase,AMPK]在感受到AMP/ATP的变化后信号通路随之激活,哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)下游的信号分子主要调控细胞的增殖、凋亡和自噬,进而影响肝癌生长。并且,AMPK还会影响乙酰辅酶A羧化酶,进一步调控细胞内脂肪酸的合成(见图3)。Qu等[35]报道了PGAM1对肿瘤细胞DNA损伤应答的调控机制。研究揭示,PGAM1通过酶活功能调控磷酸戊糖旁路,维持细胞内DNA合成元件——脱氧核糖核苷三磷酸池(deoxyribonucleoside triphosphates pool,dNTP pool)的水平。细胞内dNTP失衡,能激活p53/p73依赖的APC/C-Cdh1 E3泛素连接酶活性,下调DNA同源重组修复(homologous recombination,HR)核心蛋白羧基末端结合蛋白反应蛋白(C-terminal binding protein interacting protein,CtIP)的稳定性,进而影响HR修复通路功能(见图3)。

图 3 肿瘤细胞中PGAM1的代谢功能调控示意图 [2,25,35]Figure 3 Schematic diagram of the metabolic regulation mechanism of PGAM1 in cancer cells [2,25,35]
Liu等[26]发现敲低胰腺癌细胞中PGAM1后β-catenin磷酸化水平增加,表明PGAM1可能通过激活Wnt/β-catenin信号通路进而促进细胞发生上皮细胞-间充质转化。进一步的研究发现,使用磷脂酰肌醇3-激酶(PI3K)/蛋白激酶B(Akt)或mTOR抑制剂后,PGAM1总蛋白水平降低,表明PGAM1可能处于mTOR下游并且受到PI3K/Akt信号通路调控。Shen等[36]研究发现,S1P/S1PR3信号通路通过调控Yes相关蛋白1-骨髓细胞瘤病毒癌基因(Yesassociated protein 1-cellular-myelocytomatosis viral oncogene,YAP-c-MYC)复合物进而促进PGAM1转录,增强有氧糖酵解,有利于肿瘤增殖。
PGAM1不仅通过其代谢酶功能参与肿瘤的发生发展,还存在非酶活功能介导肿瘤运动。已有文献报道通过小干扰RNA(small interfering RNA,siRNA)敲低胰腺癌细胞中的PGAM1,缺氧诱导因子 1α(hypoxia inducible factor 1α,HIF-1α)蛋白总量明显下调,反向敲低HIF-1α后PGAM1蛋白水平也随之降低,表明两者之间可能存在直接的相互作用[26]。Zhang等[3]发现乳腺癌细胞中PGAM1通过其201-210位氨基酸,直接与α-平滑肌肌动蛋白(α-smooth muscle actin,ACTA2)相互作用,进而调控肌动蛋白丝组装和肿瘤细胞运动。Huang等[37]报道了一种新型的PGAM1变构抑制剂,当其结合在变构位点后能够拉近氨基酸残基Arg191与Leu208之间的距离,使201-210段氨基酸的构象发生改变,从而减弱PGAM1与ACTA2之间相互作用,抑制肿瘤细胞的转移。抑制PGAM1能够显著提高细胞内活性氧(reactive oxygen species,ROS)水平,激活c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK/c-Jun)信号通路,并抑制Akt和细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)活性,表明PGAM1能通过代谢酶活性和非代谢酶依赖的蛋白-蛋白相互作用,调控肿瘤生长和转移。
4 现已报道的磷酸甘油酸变位酶1抑制剂
PGAM1是一个前景良好的抗肿瘤新靶标,研究与开发新的 PGAM1抑制剂已引起越来越多研究者的关注。2005年,Evans等[38-39]报道了PGAM1抑制剂MJE3(1),课题组首先构建了包含能与PGAM1反应的活性基团的天然产物化合物库,通过细胞增殖实验筛选发现化合物MJE3可以抑制乳腺癌细胞生长,原位蛋白反应谱显示MJE3共价连接到PGAM1上,并降低PGAM1的活性。进一步通过质谱、构建突变蛋白和进行蛋白-小分子复合物结构模拟等方法确定MJE3上的环氧基团共价连接到PGAM1的Lys100位点。Li等[40]报道了天然产物来源的PGAM1抑制剂EGCG[(-)-epigallocatechin-3-gallate,2]。EGCG是绿茶提取物中儿茶酚的主要成分,在分子水平表现出对PGAM1较强的抑制活性,IC50约为 0.49 μmol · L-1。但 EGCG 为多酚结构,其通过细胞膜效率较低,对肿瘤细胞的抑制活性较弱,并且呈现多靶标作用,选择性有待进一步提高[41-43]。
2012年,Hitosugi等[2]报道了蒽醌类PGAM1抑制剂,通过高通量的酶联测活方法,对一个包含2 000个美国FDA批准的小分子化合物库进行筛选,鉴定出茜素红(Red S,3)。但茜素红结构含有磺酸基团,导致该化合物很难通过细胞膜,将其磺酸基团替换成磺酰胺并进行一系列化学修饰,最终发现化合物PGMI-004A(4),细胞水平检测的IC50为 25.6 μmol · L-1,具有抗肿瘤效果,但是 PGMI-004A如何与PGAM1结合以及PGMI-004A的靶向性的验证等问题仍有待进一步探究。
同样以PGMI-004A为先导化合物,Wang等[44]通过骨架跃迁发现了呫吨酮类PGAM1抑制剂,其中活性最好的化合物12r (5)对PGAM1和肿瘤细胞 H1299 的 IC50分别为 2.7 μmol · L-1和 5 μmol · L-1左右。但其溶解性较差并且药物代谢性质不理想,应用受到限制。
Huang等[37]通过解析PGMI-004A与PGAM1的共晶复合物结构,发现PGMI-004A位于邻近底物结合口袋的变构位点,通过叠合该共晶复合物结构与底物3-PG发现,PGMI-004A与3-PG有部分碰撞。基于结构进一步优化,将PGMI-004A中的磺酰胺反转、引入含氮饱和脂肪环,发现了新型PGAM1变构抑制剂HKB99(6)。对接研究发现,新化合物HKB99与先导化合物PGMI-004A位于同一变构位点,但磺酰胺翻转后,HKB99巧妙地避开了与底物3-PG的碰撞,成为非底物竞争型的变构抑制剂,大大提高了抗肿瘤活性。药理学研究表明,HKB99通过变构结合PGAM1后,降低了PGAM1的酶活,抑制3-PG向2-PG的转化,进而抑制细胞增殖。同时,HKB99结合在PGAM1变构位点后,拉近了PGAM1的Arg191与Leu208之间的距离,稳定了201-210位氨基酸的构象,进而阻断PGAM1与ACTA2的结合,抑制细胞的运动和肿瘤转移。进一步分子机制表明,HKB99可以提高细胞内ROS水平、激活JNK/c-Jun通路诱导细胞凋亡并降低磷酸化蛋白激酶B(phosphorylated protein kinase B,p-AKT)和磷酸化细胞外调节蛋白激酶(phosphorylated extracellular regulated protein kinase,p-ERK) 的 水平,从而抑制细胞增殖。简言之,通过变构调节PGAM1,HKB99突破了其先导化合物PGMI-004A的局限,实现了对PGAM1的代谢酶功能和基于蛋白-蛋白相互作用的非代谢酶功能的双重抑制作用,从而全方位阻断PGAM1促进肿瘤生长和肿瘤转移的作用,并能克服靶向药物耐药。
与此同时,Wen等[45]报道了PGMI-004A的另一个衍生物KH3(7),通过晶体学、体外酶学研究发现,KH3也是PGAM1变构抑制剂。他们分析了50例临床胰腺癌患者的病理标本,发现肿瘤组织中PGAM1的活性明显高于癌旁组织,并且PGAM1的表达量与患者的预后相关,提示PGAM1可以作为胰腺癌治疗的潜在靶标。KH3在多种胰腺癌模型中,例如临床病人原代肿瘤细胞、原代植入模型以及病人肿瘤异种移植瘤中均表现出较好的抑制肿瘤生长的效果。进一步的转录组学研究发现,KH3还可以抑制脂质代谢通路和Hedgehog等重要通路,并且其抑制程度与药效相关。该研究说明了胰腺癌中代谢重编程的重要性,并提供了以调控代谢为策略的治疗胰腺癌的新思路。

5 结语
PGAM1作为经典的糖酵解通路代谢酶,在催化3-PG生成2-PG的同时也发挥着非代谢酶功能,它可以与ACTA2蛋白相互作用,调控肌动蛋白的组装从而影响肿瘤运动。并且,临床公共数据库显示PGAM1在多种肿瘤中普遍高表达,与病人的不良预后相关,在肿瘤的发生发展中起着重要的作用。因此PGAM1是抗肿瘤治疗中极具潜力的靶标,其抑制剂的研发也成为热点。
目前,针对PGAM1抑制剂的研发已经做了大量的工作,但是仍然有一些问题未被解决。例如,天然化合物EGCG在细胞水平具有良好的抗肿瘤活性,但因其具有多靶点性质,需要进一步提高其特异性和选择性;新型的变构抑制剂HKB99,具有高活性和低毒性等优点,在抑制非小细胞肺癌增殖和转移的同时能否作用于更多类型的肿瘤;KH3和HKB99能否进一步优化,制备成合适的剂型并应用于临床等。总之,PGAM1作为抗肿瘤治疗的新靶标,其抑制剂的研发值得进一步探究。
