耐多药结核分枝杆菌对阿米卡星耐药与rrs基因突变的相关性研究
2020-10-13任振娟张海杰苏云开马岩刘耀
任振娟 张海杰 苏云开 马岩 刘耀
目前,我国耐多药结核病(MDR-TB)患者日益增多,一线抗结核药品已无法满足临床治疗的需要。针对MDR-TB的治疗,世界卫生组织(World Health Organization,WHO)[1]推荐使用二线注射用抗结核药品,包括氨基糖苷类药物阿米卡星(Am)、卡那霉素(Km)和多肽类药物卷曲霉素(Cm)。Am作为治疗MDR-TB的核心二线抗结核药品,主要作用于细菌核糖体,干扰其蛋白正常合成,在体外也有较强的杀菌活性。本研究通过实验室方法判断MDR-MTB菌株对Am的耐药性及其耐药分子特点,同时比较绝对浓度法和微孔板阿尔玛蓝试验(microplate Alamar blue assay,MABA)法的药物敏感性试验(简称“药敏试验”)结果,建立MDR-MTB对Am耐药的药品体外最低抑菌浓度(MIC)的最佳耐药判断临界值(cut-off值)。
材料和方法
1.菌株选择:159株MTB临床分离株均来自内蒙古自治区第四医院参比实验室,为2005年和2015年到院就诊患者的临床分离菌株。根据《结核病诊断实验室检验规程》[2],菌株均经罗氏培养阳性且硝基苯甲酸(PNB)菌种鉴定为MTB,培养基中PNB浓度为500 μg/ml;且经绝对浓度法进行药敏试验提示至少同时耐异烟肼和利福平,即为MDR-MTB菌株。作为本实验标准质控菌株的H37Rv标准株来源于内蒙古自治区第四医院参比实验室。
2.试剂及仪器: Am(美国Sigma-Aldric公司),Alamar blue显色液(美国Bio-Rad公司),7H9培养基粉及OADC营养添加剂(美国BD公司),罗氏培养基(珠海银科公司),恒温培养箱(BD720,德国Binder公司),FOTODYNE凝胶成像系统(美国Image公司),Bio-Rad s1000基因扩增仪(美国Bio-Rad 公司),超低温冰箱(日本SANYO公司)。
3.MABA法:将MDR-MTB临床分离菌株和标准菌株接种于空白罗氏中性培养基上,于37 ℃恒温培养箱中孵育3~4周。取处于对数生长期的菌株,刮菌、研磨,并通过比浊配置为1麦氏浓度的菌悬液[1×107菌落形成单位 (CFU)/ml]。使用7H9液体培养基(加入10%的OADC)及96孔微孔板,将药物浓度梯度稀释,由第12列至第2列,Am的终浓度为64、32、16、8、4、2、1、0.5、0.25、0.125、0.0625 μg/ml。第1列为空白对照。以标准菌株H37Rv作为对照。37 ℃孵育1周后加Alamar blue显色液显色,37 ℃再孵育24 h,记录各孔的颜色。判读时,根据MIC的定义,即阻止颜色变化(从蓝色变为粉红色)的最低药物浓度。孔为蓝色记为无生长,孔为粉红色为生长,出现紫红色孔,则再继续37 ℃ 培养24 h。后续不变为粉红色,同时其相连的蓝色孔仍为蓝色,则记录为有生长。美国临床和实验室标准化协会(Clinical and Laboratory Stan-dards Institute,CLSI)推荐的Am耐药判读临界浓度为1 mg/L[3]。
4.绝对浓度法:根据中国防痨协会制订的《结核病实验室操作规程》[4],将上述1麦氏浓度的菌悬液,稀释至10-2mg/ml后用微量吸管接种0.1 ml至对照及含药培养基上。含药培养基中Am的药物浓度为10、100 μg/ml。37 ℃培养4周后报告结果。低浓度含药培养基生长分枝杆菌报告耐药(R),未生长者报告敏感(S)。
5.菌株DNA提取及目的基因扩增和测序:取处于对数生长期的菌株,刮菌后转移至含有1000 μl生理盐水的离心管中,充分涡旋震荡混匀后,80 ℃ 30 min灭活,12 000×g离心5 min后,弃上清,沉淀用500 μl TE缓冲液重悬,再100 ℃ 10 min,12 000×g离心3 min后,取上清,即扩增所用的DNA模板。PCR反应引物序列为F:5′-GTCAACTCGGAGGAAGGTGG-3′,R:5′-GTCCGAGTGTTGCCTCAGG-3′。PCR反应条件:94 ℃ 10 min预变性;94 ℃ 30 s变性,58 ℃ 30 s退火,72 ℃ 30 s延伸,30个循环;72 ℃ 10 min后延伸。取得PCR产物,经1.5%琼脂糖凝胶电泳后确认目的片段大小一致,且具有清晰条带后,送由北京睿博生物公司进行核苷酸序列分析。
6.序列分析:利用Bio Edit v7.2.5软件“Multi-way alignment”分析rrs基因,以美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库公布的rrs基因序列作为对照,进行比对分析。
7.统计学处理:采用SPSS 17.0软件进行数据分析,计数资料采用“率(%)”表示,组间差异的比较采用χ2检验,以P<0.05为差异有统计学意义。以绝对浓度法检测结果作为标准,绘制MIC值诊断MDR-MTB菌株Am耐药的受试者工作特征曲线(ROC曲线),以取得最佳cut-off值。
结 果
1.耐药情况:75株2005年分离的MDR-MTB菌株中对Am耐药的有18株(24.0%,18/75);在84株2015年分离的MDR-MTB菌株中有27株(32.1%,27/84)对Am耐药,两者比较差异无统计学意义(χ2=1.295,P>0.05)。
2.基因突变结果:对Am耐药的菌株进行rrs基因测序,结果发现2005年18株对Am耐药的MDR-MTB菌株均有A1401G突变(100.0%,18/18),而2015年27株对Am耐药的MDR-MTB菌株中有26株均有A1401G突变(96.3%,26/27)。此外,2005年6株(33.3%,6/18)菌株和2015年4株(14.8%,4/27)菌株同时携带T1384A突变(表1)。
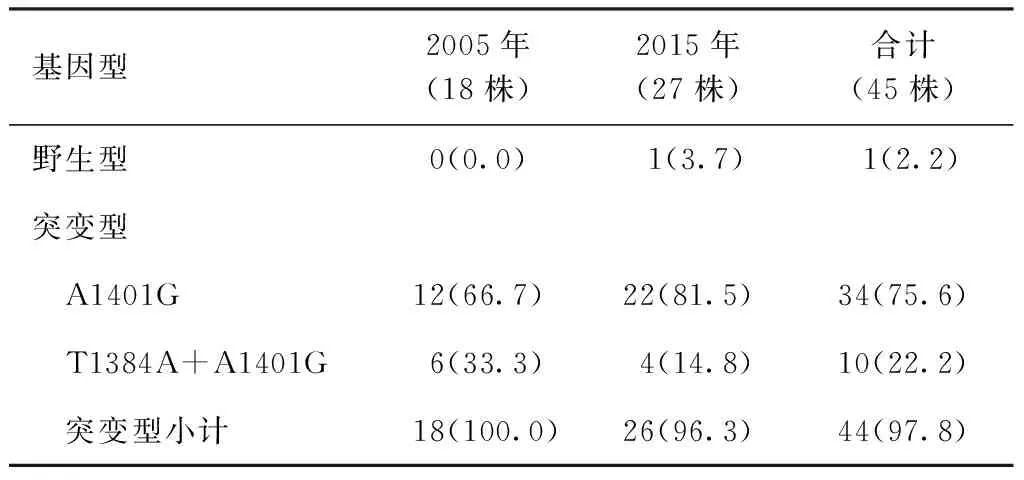
表1 rrs基因突变在不同时间Am耐药MDR-MTB
3.绝对浓度法与MABA法所测MIC值的比较:药敏试验结果对Am敏感的菌株,对应的MIC值主要集中在0.0625 μg/ml、0.125 μg/ml及0.25 μg/ml,分别占41.2%、28.9%和20.2%,三者共占90.3%(103/114)。药敏试验检测对Am耐药的菌株,有37.8%的MIC值≥64 μg/ml,见表2。
将MDR-MTB菌株的绝对浓度法药敏试验结果与相应MIC值绘制ROC曲线(图1),结果显示:ROC曲线下面积为0.942,检测Am耐药的最佳cut-off值为1.5 μg/ml,对应的敏感度为91.1%,特异度为98.2%。
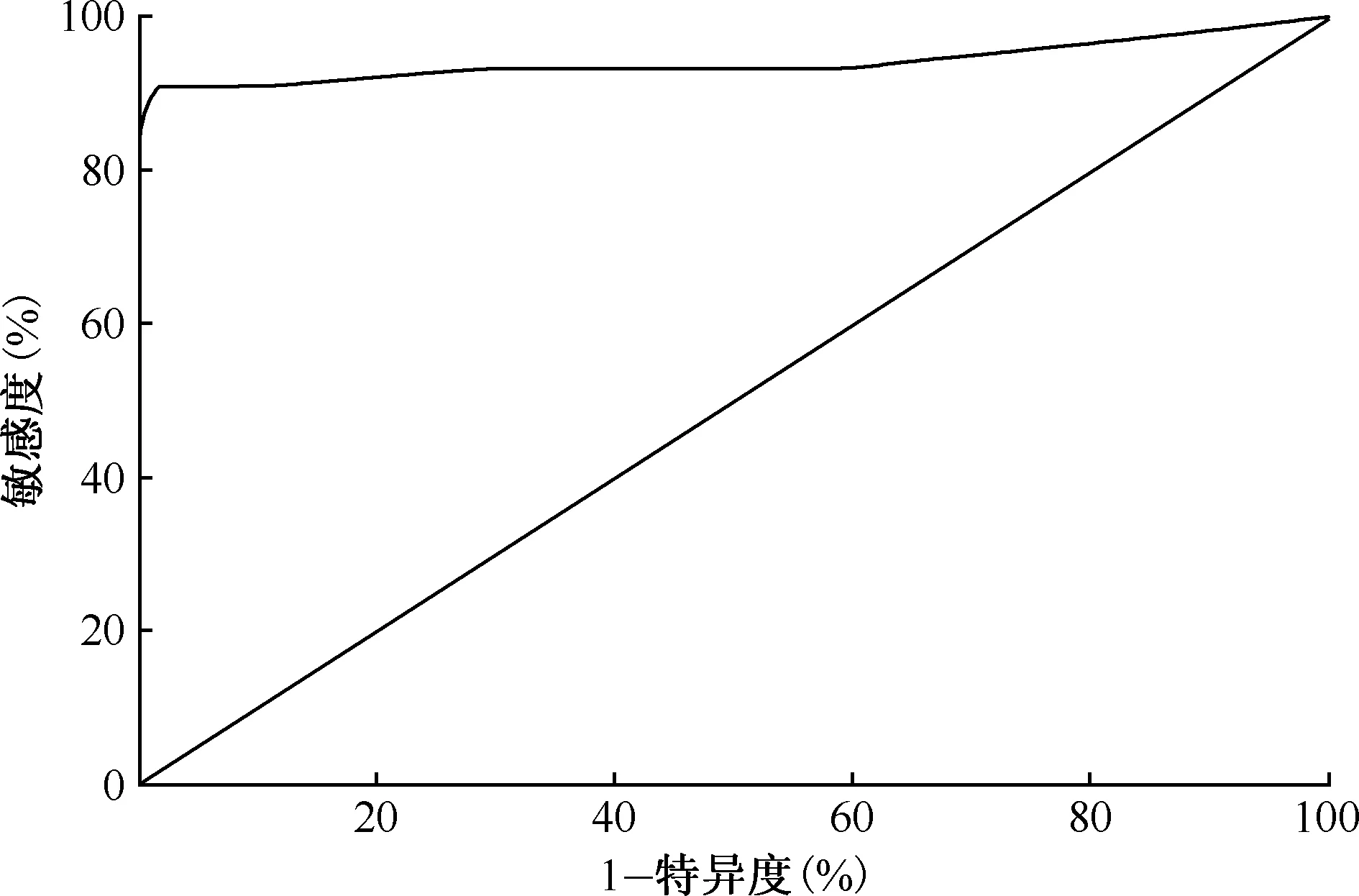
图1 MIC值诊断MDR-MTB菌株对Am耐药的ROC曲线
讨 论
MDR-MTB的感染及流行已成为全球结核病控制的难点。由于其对一线抗结核药品的耐药性,Am作为二线抗结核药品在MDR-TB治疗中得到了更广泛应用,但其耐药性也随之增高。本次研究显示,2005年MDR-MTB分离株对Am的耐药率为24.0%,而2015年则上升至32.1%。其原因可能是由于本次研究纳入样本量较小所致,后续有必要纳入更多的MDR-MTB菌株进行评价。而本次研究发现的MDR-MTB菌株对Am的耐药率高于摩洛哥(3.33%)、韩国(7.10%)、俄罗斯(17.5%)、沙特阿拉伯(2.40%),以及我国山东省(17.07%)、苏州地区(7.71%)及汕头市(15.56%)[5-11]。可见,各地MDR-MTB菌株对Am的耐药率不尽相同,国内对Am的耐药率也存在地域差异,且国内的耐药率高于国外。究其原因,首先,中国作为MDR-TB疫情最为严重的国家之一,随着相应治疗药品的广泛应用,其耐药情况势必高于其他发达国家。同时,我国各地区经济水平及医疗技术水平不均衡发展是造成各地区结核病疫情及对药品耐药情况不同的重要原因。而本研究中的2005年和2015年的MDR-MTB对Am的耐药率在国内处于较高水平。这可能是由于笔者所在医院作为结核病定点医院,难治、复治患者就诊比例较高,反复治疗使得患者总体耐药情况比较严重。Am是治疗MDR-MTB的核心药品,国内许多地区并没有常规开展二线抗结核药品的药敏试验,仅凭经验治疗,其较高水平的耐药率会增加患者治疗失败的风险,加大结核病的诊治难度。
Am属于氨基糖苷类抗生素,但国内外对其专项研究较少,目前对其产生耐药性的分子机制尚无全面的了解。通常认为Am和Km的耐药性是通过结合16S核糖体RNA的30S小核糖体亚基来抑制蛋白质合成[12],且16S rRNA的编码基因rrs突变与Am的耐药相关[13-14]。在本研究中,对Am耐药的MDR-MTB菌株共45株,其中97.8%发生A1401G突变。此突变率低于格鲁吉亚(100%),高于美国(76.5%)、泰国(37.5%)和我国山东省(68.6%)报告的结果[10,15-17]。可见,A1401G突变与Am耐药性有较高的相关性。近期,WHO推荐将分子检测技术在MDR-TB患者或耐利福平结核病(RR-TB)患者中应用于对二线抗结核药品的药敏试验,以提高诊断的准确性。本研究结果提示,在MDR-TB患者中开展对二线抗结核药品的分子药敏试验具有良好的效果。另外,还发现对Am耐药的菌株同时存在A1401G和T1384A位点突变。目前,在相关研究中尚未发现T1384A位点突变的报道。但对Am敏感的MDR-MTB菌株进行rrs测序分析,均未发生T1384A位点突变,考虑T1384A可能与Am耐药相关,推测其可能与补偿突变相关,具体意义有待进行相关分子生物学研究以进一步验证。
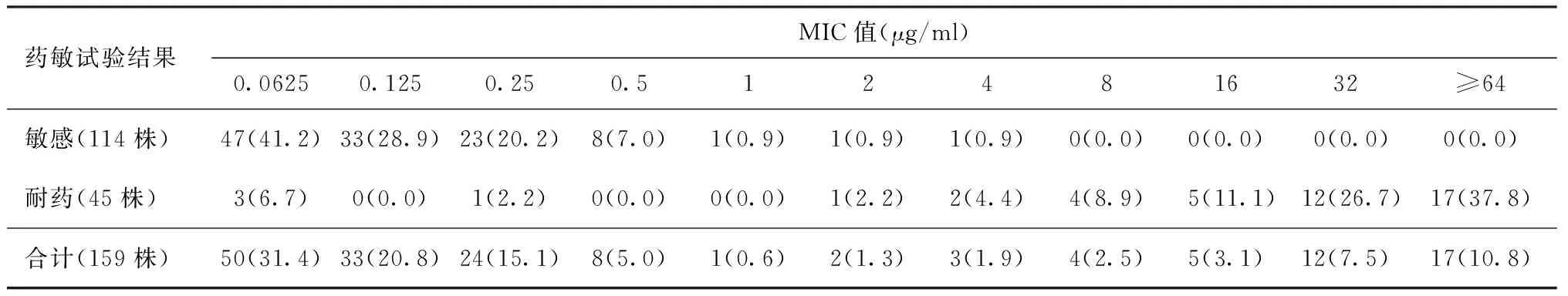
表2 MDR-MTB菌株对Am的药敏试验结果在不同MIC值中的分布
本研究通过绘制MIC值判断Am耐药性的ROC曲线,模拟最佳cut-off值为1.5 μg/ml,高于此前WHO推荐的1 μg/ml。其原因可能是MABA方法检测MIC值相较于表型药敏试验,每孔的接菌量较大,此时参考WHO推荐标准可能造成结果不准确。同时,笔者发现在一些相关研究中,也有报道MABA法检测MIC值时参考WHO推荐的关键浓度并不准确。有学者通过ROC曲线分析确定对Am耐药的最佳判断cut-off值为4 μg/ml[18],以及氧氟沙星的耐药折点浓度为2 μg/m[19],均高于WHO推荐的1.5 μg/ml。可见,在使用MABA法检测MIC时,使用WHO推荐标准判读结果可能造成结果不准确。但本研究结果尚处于初步阶段,后续还需要通过扩大检测的样本量来进一步修正MIC判读临界值。
