三维超声测量颈动脉斑块灰阶中位数值与脑梗死预测的关系*
2020-10-13段依恋项飞翔
文 琼, 段依恋, 项飞翔, 武 彧
华中科技大学同济医学院附属协和医院超声影像科,分子影像湖北省重点实验室,武汉 430022
中风是全球第二大死亡和致残病因,每年有超过1300万的新病例,全球每年的发病率约为41/10万至316/10万,具有较高的致死率及致残率[1]。随着中国经济加速发展,人民物质生活水平大幅提高及人口老年化的加剧,中国脑梗死的发病率也逐年上升,这将成为人类生命健康与国家发展的沉重负担。研究表明,在预估脑梗死风险时,评估颈动脉斑块的易损性比动脉狭窄程度更有意义[2]。因而寻求一种无创、便携又经济的检查方法来发现易损斑块成为了目前的研究热点。
1 资料与方法
1.1 研究对象
选取2015年7月~2016年12月在华中科技大学同济医学院附属协和医院神经内科住院,常规颈动脉超声检查斑块厚度>2 mm[3]的88例患者。男性48例,女性40例,年龄48~88岁,平均年龄为(66.9±8.9)岁。所有患者根据3个月内MRI或CT检查分为急性脑梗死组(脑梗组,51例)及对照组(非脑梗组,37例),急性脑梗死诊断依据《中国急性期缺血性脑卒中诊治指南2018版》[4]。本研究排除标准:既往有房颤、心肌梗死、不稳定心绞痛、脑出血、后循环脑梗、静脉血栓等病史。
1.2 仪器与方法
采用Philips IU Elite彩色多普勒超声诊断仪,选用VL13-5三维容积探头及L9-3探头。应用L9-3探头行常规颈动脉超声检查,测量斑块大小、厚度,记录斑块回声强度、斑块的位置,并测量无斑块节段的动脉内中膜厚度,选择颈动脉中厚度最大、长度适中,且钙化比例<50%的斑块进行三维图像采集。
应用VL13-5探头行三维图像采集,不同患者图像采集时仪器参数的设置保持一致,机械指数调节为0.20,二维增益设为70%,Focus设置在颈动脉斑块处。选取目标斑块短轴切面斑块最厚处,将图像调整为RES状态,轻放探头且垂直置于颈部。为避免侧壁回声失落,使后期斑块三维成像显示更为清晰,采集图像时调整探头方向使斑块尽量显示于与声束垂直的区域,调整探头扇扫角度,在保证能够包绕整个斑块的前提下尽可能调小扇扫角度。整个过程,嘱患者屏住呼吸,放松颈部肌肉。图像存储为DICOM文件。
血管斑块三维定量技术(vascular plaque quantification,VPQ)分析方法检查结束后,将DICOM图像导入Philips QLAB软件VPQ程序中逐帧观察,首先输入所测得的非斑块处的内中膜厚度并保存(软件默认为0.5 mm)。将斑块开始出现的前一帧图像定为起始帧,斑块消失的后一帧图像定为结束帧,软件自动确认动脉的外膜和内膜轮廓线。在起始帧图像和结束帧图像之间,将短轴斑块较厚或较为特殊的那一帧图像手动确定为关键帧,关键帧可有多帧,以便更为详细地勾勒斑块的整体结构。VPQ软件自动识别所有帧图像中血管内腔和斑块之间的边界,并自动计算每一帧斑块厚度、灰阶中位数值(gray-scale median,GSM),最后得出整个斑块的体积、厚度、以及GSM(min、max、mean)和缩减百分比图(图1、2)。逐帧观察软件处理完后的图像,将出现偏差的图像进行手动修正斑块感兴趣区(region of interest,ROI)。缩减百分比图中,所选点的X轴表示该帧到具有最大缩窄百分比的帧的距离(mm),所选点的Y轴表示该帧的缩窄百分比。最后,选出清晰显示血管内腔的一帧图像,在血管内腔内选定ROI,将血管内腔内的灰度值进行标准化校正,计算出斑块的标准化GSM值(normalization gray-scale median,NGSM)。
1.3 统计学方法
采用SPSS 20.0统计学软件进行统计学分析。计量资料以均数±标准差表示,计数资料以例数和百分数表示。所有计量资料均经过正态性检验及方差齐性检验。采用两独立样本t检验比较脑梗组与对照组斑块的体积、厚度、GSM(mean、max、min)、NGSM(mean、max、min)。以P<0.05为差异有统计学意义,并勾画GSM、NGSM的ROC曲线,计算其曲线下面积(area under the curve,AUC)。观察者内变异由同一观察者随机选取20例研究对象重复测量;观察者间变异由另一观察者随机选取20例研究对象并重复测量。由于本研究测量均为脱机双盲重复测量,观察者内及观察者间变异均采用组内相关系数(intraclass correlation coefficient,ICC)及95%置信区间表示。
2 结果
2.1 斑块各参数计量值比较
脑梗组颈动脉斑块的体积(94.99±60.74)mm3和厚度(3.11±0.60)mm,与对照组斑块的体积(77.12±38.66)mm3和厚度(3.15±0.57)mm比较,P值分别为0.747、0.120,差异均无统计学意义;脑梗组颈动脉斑块GSMmax(57.04±8.31)、NGSMmax(49.61±7.63)与对照组GSMmax(56.05±6.81)、NGSMmax(48.35±6.33)比较,P值分别为0.556、0.416,差异均无统计学意义。脑梗组颈动脉斑块的GSMmin(15.86±3.82)、GSMmean(28.25±4.10)、NGSMmin(11.37±3.29)、NGSMmean(23.33±2.73)与对照组GSMmin(18.54±5.16)、GSMmean(34.43±4.65)、NGSMmin(13.94±4.03)、NGSMmean(30.45±4.21)比较,P值分别为0.006、0.000、0.001、0.000,差异均有统计学意义(图3)。
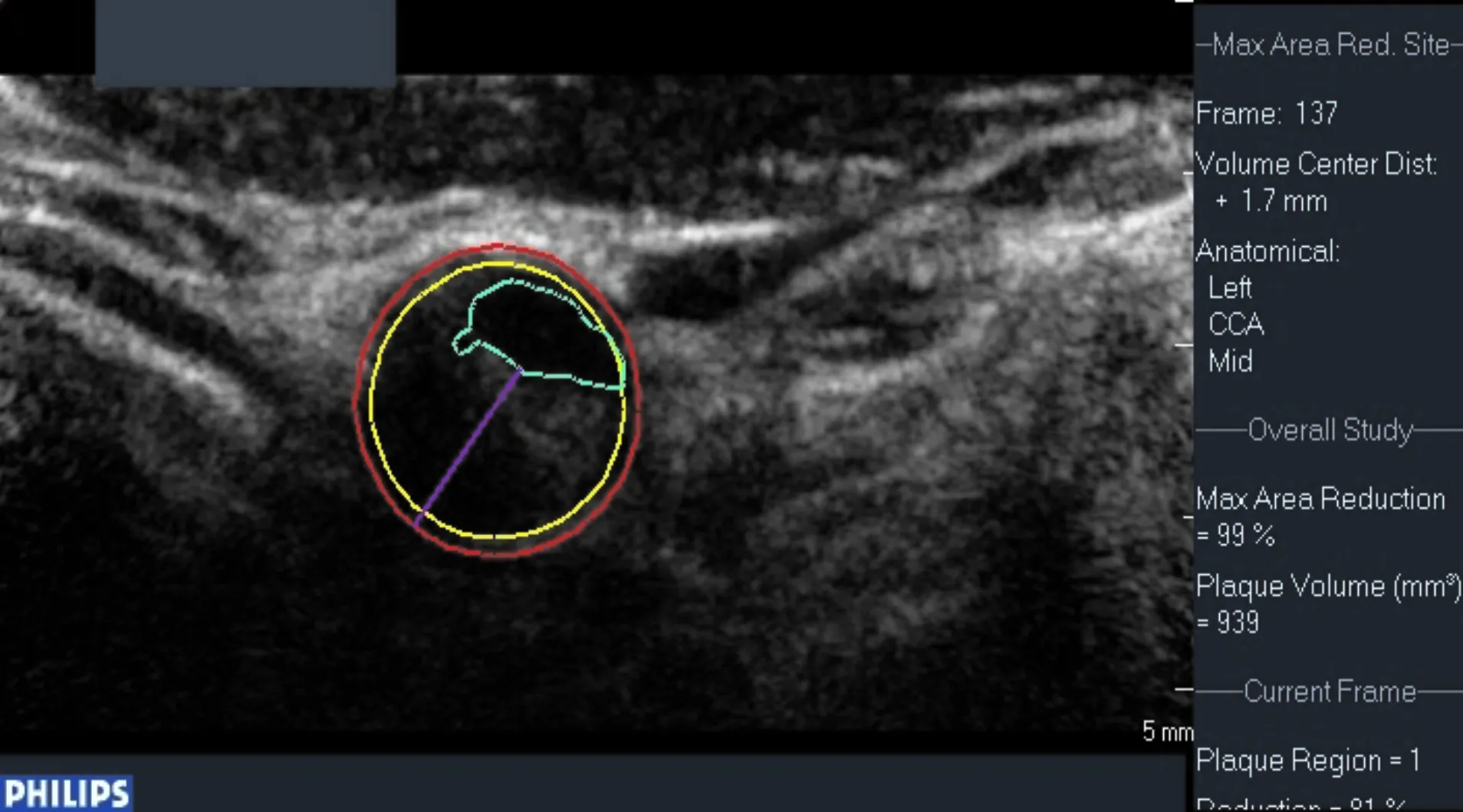
红色线:中-外膜边界;黄色线:内腔-内膜边界;绿色线:内腔边界;紫色线:最大斑块厚度图1 VPQ图像处理软件自动勾画血管斑块(短轴)Fig.1 VPQ image processing software automatically sketches vascular plaques(short axis)
2.2 斑块有统计学意义参数AUC分析
GSMmean、GSMmin、NGSMmean、NGSMmin的AUC(图4)分别为0.848、0.659、0.897、0.691。其中GSMmean的截断值为30.5(灵敏度为81.1%,特异度为82.4%),NGSMmean的截断值为26.5(灵敏度为81.1%,特异度为92.2%)。

图2 VPQ图像处理软件计算出斑块缩减百分比图(提示斑块表面形状不规则)Fig.2 Percentage of plaque reduction calculated by VPQ image processing software(indicating irregular shape of plaque surface)
2.3 观察者组内及组间ICC分析
GSMmean观察者组内、组间ICC分别为0.919、0.942,95%置信区间分别为0.806~0.967、0.860~0.977;GSMmin观察者组内、组间ICC分别为0.878、0.895,95%置信区间分别为0.717~0.950、0.755~0.957;NGSMmean观察者组内、组间ICC分别为0.928、0.919,95%置信区间分别为0.827~0.971、0.807~0.967;NGSMmin观察者组内、组间ICC分别为0.912、0.875,95%置信区间分别为0.792~0.964、0.712~0.949。

图3 颈动脉斑块GSM、体积及厚度的比较Fig.3 Comparison of the carotid plaque GSM,volume and thickness
3 讨论
过去的研究认为,颈动脉狭窄程度是导致脑梗死的重要因素,但现在越来越多的研究表明,大多数脑梗死是由轻-中度的颈动脉狭窄导致的[5]。颈动脉易损斑块的破裂、脱落是导致脑梗死的主要原因之一,占脑梗死病因的20%[6]。
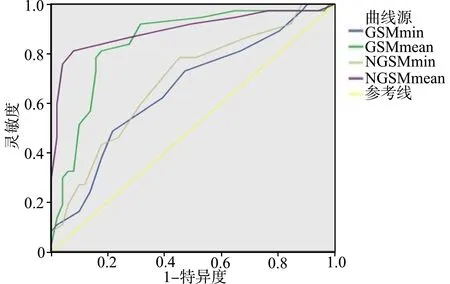
图4 GSMmean、GSMmin、NGSMmean、NGSMmin诊断脑梗死的ROC曲线Fig.4 ROC curve of GSMmean,GSMmin,NGSMmean and NGSMmin in diagnosing cerebral infarction
国外多项研究已证明斑块的回声强度可以反映斑块的成分[7]。GSM是采用像素分布分析技术对二维超声采集的灰阶图像进行分析,对斑块的回声强度进行定量分析,给出GSM值评估斑块成分,提高了评估的精确性和可重复性[7]。VPQ是一项近年开发的超声新技术[8],它可自动追踪血管壁及斑块边界,清楚地显示斑块立体结构,反映动脉粥样硬化斑块的病变程度,获得斑块性质,指导临床治疗。
常规颈动脉斑块超声检查依据斑块的超声强度评估斑块的成分。研究表明,中到大的斑块,与未来心血管事件的风险相关[3]。在斑块厚度>2.1 mm的患者中,低-无回声斑块患者发生血管事件的相对风险较高。将斑块的超声强度与组织学对照,发现动脉斑块回声强度与斑块的具体成分具有一定的相关性,斑块回声强度中的低-无回声区代表斑块内脂质核心或斑块内出血,强回声区代表斑块的钙化和纤维化,斑块钙化、纤维化程度增高,斑块的稳定性也增高[9]。但从超声二维图像上分辨斑块的回声强度,无法对斑块形成整体的观察及测量、不能定量分析以及切面重复性差,而且不同型号超声仪器、仪器条件的设置及医师经验等也存在一定的差异。本研究采用计算机像素分布分析技术,分析采集的灰阶图像,对所研究斑块的回声强度定量分析,得出GSM值。这项技术将黑色定为0,将白色定为255,管腔内血液的GSM设置为0~5,动脉外膜的GSM设置为185~195,减少了不同条件下的偏差,重复性大大提高[10]。目前颈动脉斑块GSM的研究重点在于将斑块的回声强度进行定量,计算GSM的截断值,从而来评估发生脑梗死的风险。国外已有大样本研究来测定评估脑梗死风险的GSM截断值,但目前尚没有统一标准。Biasi等[11]在一项大型颈动脉狭窄-脑梗死风险的对比研究中发现,低-无回声斑块导致脑梗死的风险更高,与GSM>25者相比较,GSM<25的患者具有更高的发生脑梗死的风险。另一项持续3年的大型追踪研究发现[11],GSM<32的糖尿病患者,其心脑血管疾病的发生率更高。但是上述试验均是在动脉斑块的二维图像上进行测定斑块的GSM值,鉴于动脉斑块的组织异质性导致斑块的不同部位的GSM不同,二维图像上只能显示斑块局部的GSM,而本研究中VPQ技术可清楚地显示斑块的立体结构,在三维立体的成像模式下,测量斑块整体的GSM值,更为全面、敏感地评估斑块易损性[12]。
颈动脉狭窄是脑梗死的一个危险因素[13],但是在本研究中,两组间颈动脉斑块的体积和厚度无显著差异,导致这一结果可能的原因为斑块的易损性与斑块的体积大小、颈动脉的狭窄程度与脑梗死并无相关性,而是与斑块的形态和成分相关[14]。另一方面,入选的患者均为神经内科的住院患者,对照组虽为非脑梗死组,但常合并颈动脉粥样硬化的危险因素,如高血压、高血脂、糖尿病等。且本研究入选标准为斑块厚度>2 mm。这些原因共同导致了两组患者的颈动脉斑块的体积和厚度无显著差异。
本研究中两组间颈动脉斑块的GSMmax无显著性差异。其原因可能是因为混合斑块中斑块的GSMmax常位于斑块的钙化区,虽然斑块的钙化成分比例与其稳定性呈正相关,但是GSMmax与斑块内钙化的比例多少无明显相关性,且本次试验纳入的病例中,对照组和脑梗组的混合斑块比例差异无统计学意义,这可能是两组GSMmax无统计学差异的原因。脑梗组颈动脉斑块的GSMmin、GSMmean、NGSMmin、NGSMmean均低于对照组。易损斑块的病理特点为巨大的脂质核心和斑块内出血。斑块内脂质核心和斑块内出血多表现为低-无回声。此结果提示脑梗组颈动脉斑块的GSMmin、GSMmean、NGSMmin、NGSMmean更低,这与颈动脉易损斑块的病理特点相符。脑梗组中GSMmean、GSMmin、NGSMmean、NGSMmin的AUC分别为0.848、0.659、0.897、0.691。GSMmean、NGSMmean的诊断价值较高,且校正后的NGSMmean稍高于GSMmean。GSMmean的截断值为30.5,其灵敏度为81.1%,特异度为82.4%。NGSMmean的截断值为26.5,其灵敏度为81.1%,特异度为92.2%,与国外的一些研究数据基本一致[15]。
本研究还存在着一定的局限性,国外已有许多研究使用超声三维成像技术勾画斑块的整体外形轮廓,据此发现斑块内溃疡,评估斑块的易损性,其准确性和重复性均较高[16]。本研究VPQ软件分析亦可以得出一个短轴上血管有效腔面积和缩减百分比图,可以间接地显示斑块表面的起伏情况,大致体现出斑块表面的不规则程度,但该技术并未对斑块不规则程度给出量化指标,无法进行定量分析,因此本项研究中未能将此项目进行比较。同时,本研究样本量有限,纳入了88例患者中最厚的88个斑块,且患者均为神经内科患者,存在一定的入选偏倚。为了获得准确的中国人群GSM截断值,在以后的研究中,应进一步扩大样本量及样本种群。
VPQ技术在三维条件下定量斑块的整体回声强度,评估斑块的成分,其GSMmin、GSMmean、NGSMmin、NGSMmean值或可成为预测脑梗死发生的风险参数。
