硫化氢介导TGF-β1信号通路在早产儿视网膜病变血管损伤中的作用*
2020-10-13汪德海姚念杰
田 静, 汪德海, 姚念杰
安徽省淮北市人民医院眼科,淮北 235000
早产儿视网膜病变(retinopathy of prematurity,ROP)多在早产儿和低体重儿中发生[1],早产儿及新生儿处于高氧环境时,促血管生长因子减少,导致ROP早期血管发育停滞,视网膜局部缺血、缺氧,进一步又促进大量促血管生长因子产生,导致视网膜边缘区域的血管增生异常,ROP进展至二期[2]。
硫化氢(hydrogen sulfide,H2S)是一种重要的气体信号分子,在哺乳动物体内,内源性H2S主要通过胱硫醚-β合酶(cystathionine β synthase,CBS)和胱硫醚γ裂解酶(cystathionine γ lyase,CSE)催化L-半胱氨酸产生,CBS和CSE具有组织特异性,研究表明CSE主要存在于视网膜,CBS则主要在角膜表达[3],提示内源性H2S可能通过视网膜血管参与视网膜的正常生理反应。ROP的发生及进展过程中,转化生长因子-β(transforming growth factor-β,TGF-β)也参与血管生成的调节,TGF-β1为TGF-β超家族成员,TGF-β1对血管内皮细胞的作用是多效的,其对血管生成促进或抑制作用与血管内皮细胞来源、配体浓度、细胞密度等多种因素相关[4]。研究表明在糖尿病小鼠视网膜组织及血管内皮细胞中,TGF-β1表达升高[5]。
当前针对ROP的治疗多集中于ROP二期,针对ROP早期病变尚未见有效干预措施,而多项研究表明H2S可介导TGF-β1的表达,基于此,本研究构建新生大鼠氧诱导模型、高氧/低氧刺激人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC),探讨H2S能否通过介导TGF-β1表达在ROP早期血管发育中发挥作用。
1 材料与方法
1.1 实验材料
SD大鼠购自北京维通利华实验动物技术有限公司,HUVEC购自中科院上海细胞库,胎牛血清购自美国Gibco公司,RPMI 1640培养液购自美国Hyclon公司,H2O2、CoCl2、NaHS购自美国Sigma Aldrich公司,TGF-β1(批号3709)购自美国CST公司,p-Smad 2/3(批号ab272332)购自美国ABCAM公司,GAPDH、羊抗鼠IgG、羊抗兔IgG、ECL液、BSA购自美国Thermo公司,CSE酶ELISA检测试剂盒购自美国R&D Systems公司,Transwell小室模型购自美国Corning公司,主要实验仪器为酶标仪(BIO-RAD,美国)、超灵敏化学发光成像仪(GE,美国)、病理切片机(徕卡,德国)。
1.2 实验方法
MTT法,CSE酶测定方法,Transwell实验方法,详细步骤见参考文献[6-8]。
1.2.1 高氧/低氧诱导的视网膜病变大鼠模型构建[9]实验方案经淮北市人民医院伦理委员会批准,取生育龄SD大鼠按3∶1雌雄比合笼,雌鼠晨起见阴道栓子判断其怀孕,将孕鼠单独饲养,孕鼠生育后将新生鼠随机分为ROP组及对照组,每组各30只。将ROP组新生鼠置于自控氧气箱中,设置氧气浓度为50%,24 h后将氧气浓度调整为10%,维持24 h,此为高氧/低氧诱导一个循环,完成7个循环即新生鼠出生后14 d后终止实验,对照组新生鼠置于常氧环境下常规饲养至出生后14 d。
1.2.2 组织标本取材 新生鼠14 d后腹腔注射足量水合氯醛,处死新生大鼠,迅速剪开大鼠左胸,于大鼠左心室心尖搏动处采用足量甲醛溶液缓慢灌注,随后进行取材,剪开新生鼠眼周围皮肤,小心对眼球周围结缔组织进行游离,采用眼科手术剪将眼球后方的视神经、血管、眼周围结缔组织剪断,小心清理眼球周围残余结缔组织,随后进行包埋,常规HE染色,免疫组化法测TGF-β1表达。另取未灌注甲醛溶液新生大鼠,小心取出眼球,剥离视网膜血管组织,ELISA法测定CSE酶活性,Western blot法检测p-Smad 2/3、TGF-β1表达水平。
1.2.3 高氧/低氧诱导HUVEC建立[10]配制含50 μmol/L H2O2、10%胎牛血清的RPMI 1640培养液作为高氧诱导培养液,配制含50 μmol/L CoCl2、10%胎牛血清的RPMI 1640培养液作为低氧诱导培养液,6孔培养板中HUVEC铺满至2/3时,去除含10%胎牛血清的RPMI 1640培养液,随后加入高氧诱导培养液,于二氧化碳培养箱中孵育15 min,除去高氧诱导培养液,加入低氧诱导培养液,于二氧化碳培养箱中孵育4 h,此为高氧/低氧诱导1个循环,4个循环后HUVEC接近生长抑制,以模拟早产ROP病变高氧/低氧刺激。
1.2.4 Western blot法检测 采集视网膜血管组织、收集6孔培养板中采用药物处理后的HUVEC,提取组织及细胞蛋白,采用BCA法测定蛋白裂解液中的蛋白浓度,稀释蛋白裂解液,配制含溴酚蓝的上样缓冲液,上样,采用SDS-PAGE凝胶电泳,待蓝色条带至凝胶底部时,终止电泳。转移凝胶中的蛋白至PVDF膜,TBST清洗3次,每次5 min,加一抗,4℃孵育过夜,TBST清洗3次×5 min,5%BSA封闭1 h,TBST清洗3次,每次5 min,加入二抗,室温孵育1 h,TBST清洗3次,每次5 min,加ECL发光液显影,目的条带的吸光度值采用ImageQuant TL软件分析处理。
1.3 统计学分析

2 结果
2.1 视网膜血管组织及H2S浓度变化
ROP组HE染色切片中突破视网膜内界膜的血管内皮细胞较多,而对照组中突破视网膜内界膜的血管内皮细胞极少见或未见,详见图1A、1B。测定血管组织CSE酶活性,根据标准曲线换算H2S浓度,结果发现ROP组视网膜血管组织H2S生成高于对照组,详见图1C。

A:对照组视网膜血管增生情况(HE染色,×400);B:ROP组视网膜血管增生情况(HE染色,×400);C:视网膜血管组织H2S生成情况图1 视网膜血管组织及H2S浓度变化Fig.1 The changes of retinal vascular tissue and H2S concentration
2.2 视网膜血管组织TGF-β1信号通路表达水平
ROP组免疫组化染色切片中视网膜血管组织TGF-β1表达较少,而对照组中TGF-β1表达较高,详见图2A。Western blot法检测视网膜血管组织中TGF-β1、pSmad 2/3表达水平,结果显示ROP组视网膜血管组织中TGF-β1、pSmad 2/3表达水平较对照组低,差异具有统计学意义(均P<0.05),详见图2B、2C。
2.3 外源性H2S对HUVEC增殖的影响
我们采用外源性H2S供体NaHS(0~100 μmol/L)处理ROP组HUVEC 24 h,提示NaHS浓度10 μmol/L处理时约有50%ROP组HUVEC存活,详见图3A;进一步采用NaHS浓度10 μmol/L处理0~42 h,结果提示24 h时约有50%ROP组HUVEC存活,详见图3B;随后采用NaHS(10 μmol/L)处理ROP组HUVEC 24 h,结果发现ROP组HUVEC生存率低于对照组HUVEC。对照组中采用NaHS处理的HUVEC细胞生存率高于未经处理的细胞,ROP组中采用NaHS处理的HUVEC细胞生存率高于未经处理的细胞,差异具有统计学意义(P<0.05),详见图3C。
2.4 外源性H2S对HUVEC迁移能力的影响
我们采用Transwell小室模型观察NaHS(10 μmol/L)处理24 h后HUVEC的迁移能力,结果发现对照组细胞中NaHS处理后迁移到另一侧膜的细胞数明显升高,ROP组中NaHS处理后的细胞同样观察到此现象,详见图4A~D。进一步采用图像分析软件计算细胞数,结果发现ROP组HUVEC迁移细胞数低于对照组HUVEC。对照组中经NaHS处理后的细迁移细胞数高于未经处理的细胞数,ROP组中经NaHS处理后的迁移细胞数高于未经处理的细胞,差异具有统计学意义(均P<0.05),详见图4E。
2.5 外源性H2S对HUVEC中TGF-β1信号通路的影响
Western blot法检测NaHS(10 μmol/L)处理24 h后对HUVEC中TGF-β1、pSmad 2/3表达水平的影响,结果显示ROP组HUVEC中TGF-β1、pSmad 2/3表达水平较对照组低,进一步采用图像分析软件分析,结果发现ROP组HUVEC中TGF-β1、pSmad 2/3表达水平低于对照组HUVEC。对照组中经NaHS处理后的TGF-β1、pSmad 2/3表达水平低于未经处理的细胞数,ROP组中经NaHS处理后的TGF-β1、pSmad 2/3表达水平低于未经处理的细胞,差异具有统计学意义(均P<0.05),详见图5。

A:两组视网膜血管TGF-β1表达水平(免疫组化染色,×400);B:Western blot法检测视网膜血管组织TGF-β1、pSmad 2/3表达;C:图像分析软件分析视网膜血管组织TGF-β1、pSmad 2/3表达图2 视网膜血管组织及TGF-β1信号通路表达水平变化Fig.2 The changes of retinal vascular tissues and expression of TGF-β1 signaling pathway

A:不同浓度NaHS处理对HUVEC增殖的影响;B:NaHS不同处理时间对HUVEC增殖的影响;C:经10 μmol/L NaHS处理24 h对HUVEC增殖的影响图3 外源性H2S对HUVEC增殖的影响Fig.3 Effect of exogenous H2S on HUVEC proliferation

A:对照组+NaHS;B:对照组;C:ROP组+ NaHS;D:ROP组;E:NaHS处理对HUVEC迁移细胞数目的影响图4 外源性H2S对HUVEC迁移能力的影响Fig.4 Effect of exogenous H2S on immigration ability of HUVEC
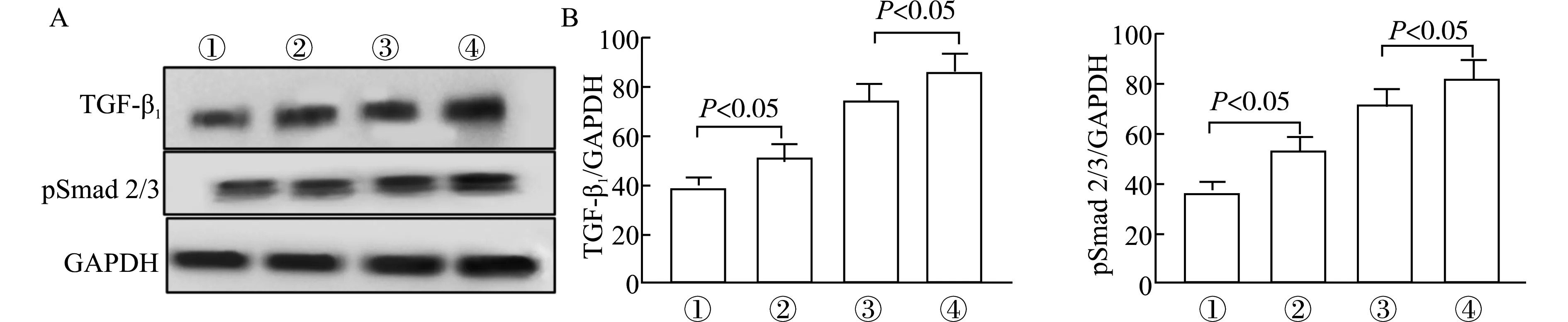
A:Western blot法检测HUVEC中TGF-β1、pSmad 2/3表达;B:图像分析软件分析HUVEC中TGF-β1、pSmad 2/3表达;①ROP组+ NaHS;②ROP组;③对照组+NaHS;④对照组图5 外源性H2S对HUVEC中TGF-β1信号通路的影响Fig.5 Effect of exogenous H2S on TGF-β1 signaling pathway in HUVEC
3 讨论
随着早产儿存活率的提高,ROP的发病率也呈上升趋势,研究表明我国体重<2 kg或胎龄<34周的早产儿或者因疾病接受氧疗超过5 d的新生儿中,ROP发生率为15.2%[11]。ROP发病机制复杂,胎儿在子宫内时,其动脉氧分压约为30 mmHg,而常氧状态时,早产儿及新生儿动脉氧分压约为55~80 mmHg[12]。由于高氧环境,ROP早期视网膜血管生成受抑,血管生长停滞,诱发视网膜缺氧,进一步促进氧调节因子表达,刺激视网膜形成新生血管即ROP二期[13]。H2S作为内源性气体信号分子参与抗缺血性损伤,降低氧化应激反应,抑制细胞凋亡等多种病理生理反应[14]。研究表明,哺乳动物中晶状体、虹膜、角膜、视网膜等眼内组织均能生成内源性H2S,其中角膜及视网膜生成水平较高,而视网膜中存在CSE表达[15]。ROP早期H2S是否参与视网膜血管生成的调节值得研究,本项研究发现大鼠ROP模型视网膜血管组织中H2S生成高于对照组,进一步研究发现ROP组HUVEC的增殖能力低于正常HUVEC,采用外源性H2S供体NaHS处理后ROP组HUVEC增殖能力高于未经处理的HUVEC,上述结果提示ROP早期视网膜血管组织中内源性H2S生成增加,这可能与病理状态下代偿性增加H2S生成以保护血管内皮细胞相关。
ROP的发生及进展与视网膜血管发育密切相关,研究表明,胚胎发育中TGF-β1及其下游信号通路激活能够调节中枢神经系统发育[16]。胚胎发育中视网膜为脑的衍生器官,研究表明视网膜深层血管发育进程中TGF-β1及其下游信号通路激活能够促进视网膜深层血管的正常发育[17]。本项研究发现D14大鼠ROP模型中突破视网膜内界膜的血管内皮细胞较对照组多,采用免疫组化技术发现ROP组视网膜血管组织TGF-β1表达较对照组少,Western blot检测发现ROP组视网膜血管组织中TGF-β1、pSmad 2/3表达水平较对照组低。上述结果提示高氧/低氧诱导产生的大鼠ROP模型其TGF-β1及其下游信号通路的抑制对视网膜血管发育产生影响。
TGF-β1通过与不同的TGF-β受体结合,能够发挥调节细胞增殖、凋亡等生物学效应,抑制TGF-β1及其下游信号通路可降低细胞凋亡,改善氧化应激水平[18]。研究表明,H2S可通过下调TGF-β1及其下游信号通路对血管内皮细胞发挥保护作用[19]。本项研究中,我们发现对照组HUVEC迁移能力高于ROP组HUVEC。对照组中经NaHS处理后的迁移细胞数高于未经处理的细胞,ROP组中经NaHS处理后的迁移细胞数高于未经处理的细胞,提示外源性H2S可改善高氧/低氧诱导造成的HUVEC迁移能力降低。在TGF-β1及其下游信号通路中Smad 2/3为重要蛋白,Smad 2/3能够促进细胞外基质合成相关蛋白表达及胶原沉积[20]。进一步我们采用Western blot法检测外源性H2S对TGF-β1及其下游重要蛋白Smad 2/3的影响,结果发现ROP组HUVEC中TGF-β1、pSmad 2/3表达水平低于对照组HUVEC。对照组中经NaHS处理后的TGF-β1、pSmad 2/3表达水平低于未经处理的细胞数,ROP组中经NaHS处理后的TGF-β1、pSmad 2/3表达水平低于未经处理的细胞。本项研究结果提示外源性H2S可以改善高氧/低氧诱导HUVEC的增殖和迁移能力,下调TGF-β1、pSmad 2/3的表达水平,说明H2S可能通过介导TGF-β1信号通路参与视网膜血管病变早期的血管发育。
我们的研究证明了在早期ROP病变中,H2S在视网膜血管发育早期可能扮演关键角色,其机制与介导TGF-β1及其下游信号通路相关。然而TGF-β1与ALK1、ALK5这2种不同受体的结合对血管发育的作用是双相的,既可以促进血管内皮细胞增殖和迁移,也可以抑制其增殖及迁移[21]。此外在ROP进展过程中,涉及血管内皮细胞及周细胞,H2S在其中的机制及其对TGF-β1信号通路的调节有待进一步研究。
