microRNA-665调控TRPM7表达对心肌梗死后心力衰竭大鼠心肌纤维化的影响*
2020-10-13熊信林张春伟周裕丰
罗 斌, 熊信林, 张春伟, 周裕丰
成都大学附属医院 1急诊科 2心内科,成都 610081
慢性心力衰竭(chronic heart failure,CHF)是绝大多数心血管疾病的最终阶段,也是导致死亡的主要原因[1-2]。心室重塑参与了CHF的发生和进展,包括心肌纤维化、心肌细胞基质改变,最终引起心脏结构和功能改变[3]。瞬时受体电位(transient receptor potential,TRP)通道是一种与神经生物学有关的基因,其家族成员瞬时受体电位M型7(TRPM7)是最具有代表性的双功能膜蛋白。研究显示[4],TRPM7具有蛋白激酶和阳离子通道双重结构,在肿瘤形成、细胞增殖、缺血再灌注损伤和细胞凋亡等生物学功能中发挥重要的调控作用。最新研究表明[5],TRPM7与细胞纤维化的形成有关,CHF大鼠心肌组织TRPM7表达明显增加,并与心肌纤维化程度呈正相关。但是关于心肌纤维化中TRPM7的具体调控机制依然鲜有报道。微小RNA(microRNAs,miRNA)是由21~25核苷酸组成的单链小分子RNA,介导转录后的基因调控[6]。miRNA-665是心肌组织表达特异性miRNA,在心肌组织中表达丰富。研究表明miRNA-665可能通过调控细胞凋亡维持心血管系统的正常生理功能,但其具体作用机制仍不清楚[7]。基于此,本研究通过建立心肌梗死后心力衰竭大鼠模型,并利用冠状动脉注射miRNA-665过表达的腺病毒转染大鼠心肌,观察miRNA-665对心肌细胞凋亡的影响及调控机制。
1 材料与方法
1.1 实验材料
RNAqueous®-Micro Total RNA Isolation Kit(美国Thermo Fischer Scientific公司),SYBR Green PrimeScriptTMRT Master Mix(日本Takara公司),TRPM7抗体(Invitrogen公司),Bcl-2、Bax、Bcl-xl、Bad、Caspase-3、Caspase-9抗体(Cell Signaling Technology公司),GAPDH抗体、辣根过氧化酶标记的羊抗兔二抗、羊抗鼠二抗(上海碧云天生物技术有限公司),BSA(Sigma Aldrich公司),PVDF膜(Millipore公司),ECL化学发光底物(Thermo公司),miRNA-665引物(上海生工生物工程股份有限公司),rAAV9-Zs-Green-pre-miRNA-665、空载病毒rAAV9-Zs-Green(深圳市百恩维生物科技有限公司),TUNEL试剂盒(Roche公司)。载体构建方法:将含有过表达的miRNA-665(pAAV9-Zs-Green-rno-pre-miRNA-665)导入至293 AAV细胞;rAAV9-Zs-Green-pre-miRNA-665和空载病毒rAAV9-Zs-Green病毒滴度为5×1012μg/mL。主要实验仪器为心脏超声仪(GE VIVID7),Millar压力容积导管(Mikro-Tip pressure catheter SPR-839),酶标仪(BIO-RAD公司),Image Quant LAS4000化学发光成像分析仪(GE公司),EG 1160包埋机(Leica公司),病理切片机(Leica公司)。
1.2 动物来源与分组
60只健康雄性Sprague-Dawley大鼠,体重250~280 g,购自中英合资上海西普尔-必凯实验动物有限公司[动物许可证号:SYXK(沪)2013-0058]。大鼠分笼饲养,自由进食饮水,维持室温(20±2)℃,12 h~12 h昼夜循环光照(光照时间08:00~20:00),适应性喂养1周后开始实验。将60只大鼠随机分为4组,每组15只大鼠。假手术组(Sham):仅手术打开胸腔,不结扎冠状动脉;模型组(Model):大鼠冠状动脉前降支结扎,继续饲养8周;空载病毒组(Vector):先向大鼠冠状动脉注射空载病毒rAAV9,再结扎冠状动脉前降支,继续饲养8周;miRNA-665组:先向大鼠冠状动脉注射rAAV9-Zs-Green-pre-miRNA-665,然后结扎冠状动脉前降支,继续饲养8周。
1.3 实验方法
1.3.1 心肌梗死后心力衰竭大鼠模型制备 参考李安莹等[8]报道的方法建立心肌梗死后心力衰竭大鼠模型,具体操作简述如下:大鼠腹腔注射戊巴比妥钠(50 mg/kg),麻醉后以仰卧位固定于手术台,四肢连接心电图,颈部切口,暴露气管,横向剪开气管,插入自制气管插管控制呼吸,维持呼吸频率70~90次/min,呼吸比1∶1,潮气量10~12 mL。剪开胸部皮肤,逐层分离肌肉,充分暴露心脏、主动脉和肺动脉,用6-0缝合线结扎冠状动脉前降支。模型成功标准:心肌结扎部位以下颜色变白,心脏搏动明显减弱,心电图示ST段抬高。模型制作完毕后,彻底止血、逐层关胸。待大鼠恢复自主呼吸后拔出插管,颈部皮肤缝合。术后大鼠肌肉注射青霉素钠,20万U/d,连续注射5 d预防感染。
1.3.2 冠状动脉注射腺病毒转染miRNA-665 麻醉和呼吸机支持方法同“1.3.1”,暴露心脏后分离冠状动脉,用0.3 mL胰岛素注射器由冠状动脉向左心室腔内注射150 μL rAAV9-Zs-Green-pre-miRNA-665,注射完毕后用血管钳夹闭主动脉10~15 s,待心脏膨大、心率减慢后松开止血钳。继续观察5 min,直至心脏恢复正常大小、心率恢复正常后,进行冠状动脉前降支结扎手术。Vector组注射相同体积空载病毒,其余方法同miRNA-665组。
1.3.3 大鼠心脏超声检查 大鼠饲养8周后,同“1.3.1”方法麻醉大鼠,待翻正反射完全消失后,以仰卧位固定,剪去胸前毛发,探头置于左胸前,图像深度2.0~2.5 cm,超声检查左室收缩压峰值(LVSP)、左心室舒张末期压(LVEDP)、等容收缩期左心室内压力上升的最大速率(+LV dP/dtmax)。各指标平行检测3次,取平均值。
1.3.4 心肌组织采集 4组大鼠继续饲养8周后,戊巴比妥钠麻醉,剪开前胸,用生理盐水灌洗心脏,直至所有血液冲洗完毕后整体取出心脏,称重,并计算心脏重量与体重比值(HW/BW)。剔除心脏结缔组织、血管等,完整分离左心室,以左心室长轴作为中点,将心脏横剖为两部分,其中心尖部分用4%多聚甲醛固定,留作组织形态学观察。心底部分置于液氮速冻后-70℃保存待用。
1.3.5 心肌组织形态学观察 采用苏木精-伊红染色法(HE)观察心肌细胞形态,取出4%多聚甲醛固定的心肌组织,梯度乙醇脱水,二甲苯透明,石蜡包埋,切片机制成4 μm的连续切片。二甲苯脱蜡,梯度乙醇水化,苏木精染色,伊红复染,自来水反复冲洗,中性树胶封固,显微镜下观察心肌组织形态学变化。
1.3.6 免疫组织化学法检测心肌组织TRPM7表达及TUNEL法检测心肌细胞凋亡 取出冷冻的心肌组织,自然解冻,常规石蜡包埋,行两步免疫组化染色法。石蜡切片常规脱蜡,加入3%过氧化氢孵育10 min,再加入0.01 mol/L柠檬酸缓冲液,微波修复抗原。PBS冲洗3次后分别滴加TRPM7抗体,4℃孵育过夜。次日取出切片,静置30 min后滴加二抗继续孵育20 min,PBS冲洗3次后DAB显色,显微镜下观察阳性染色面积。
取已经制备好的心肌组织切片,对切片进行充分脱蜡及水化,在3%H2O2甲醇溶液中浸泡15 min,在蛋白酶K工作液中消化15 min,随后PBS洗涤5 min,洗涤2次后,现配TUNEL反应混合物,按TUNEL试剂盒规程进行操作,苏木精染液复染,梯度乙醇进行脱水,采用二甲苯透明,最后中性树胶封片,在高倍镜(×400)下拍照,正常心肌细胞胞核在光镜下呈蓝色,为阴性,凋亡心肌细胞在光镜下呈棕黄色,为阳性。每张切片于高倍镜下随机选择5个视野进行计数,心肌细胞凋亡指数=凋亡阳性细胞数/总细胞数×100%。
1.3.7 Western blot检测心肌组织TRPM7蛋白及凋亡相关蛋白表达 手术剪将心肌组织剪碎,加入1 mL RIPA裂解液,充分研磨至匀浆,冰浴上静置20 min,4℃低速离心10 min,吸取上清液,BCA法检测蛋白含量。加入上样缓冲液将蛋白煮沸5 min变性,取50 μg总蛋白SDS-PAGE电泳分离,电泳后半干法转移至PVDF膜,5% BSA中封闭1 h。PBST洗膜后加入TRPM7抗体(1∶500稀释)和Bcl-2、Bax、Bcl-xl、Bad、Caspase-3、Caspase-9抗体(1∶1000),4℃孵育过夜。次日加入辣根过氧化酶标记的二抗(1∶10000)振荡孵育1.5 h,ECL显色,化学发光成像分析仪成像,Image pro plus 6.0扫描图像。目的蛋白相对表达量用目的蛋白与GAPDH条带灰度值比值表示。
1.3.8 实时荧光定量PCR检测大鼠心肌组织miRNA-665表达 RNAqueous®-Micro Total RNA Isolation Kit提取心肌组织miRNA,按照逆转录试剂盒说明书逆转录为cDNA,以cDNA为模板利用实时荧光定量PCR检测心肌组织miRNA-665表达。利用Primer 5.0软件设计引物,miRNA-665:5′-CTATGGCTTTTTATTCCTATGTGA-3′;U6:5′-AACGCTTCACGAATTTGCGT-3′。以U6为内参,95℃预变性2 min,之后每步94℃变性15 s,引物60℃退火延伸45 s,共进行40个循环,读取每个延伸阶段的荧光值。
1.4 统计学方法

2 结果
2.1 大鼠心功能变化
60只大鼠死亡14只,术后存活46只,其中Sham组14只,Model组11只,Vector组9只,miRNA-665组12只。与Sham组比较,Model组、Vector组、miRNA-665组LVSP、+LV dP/dtmax明显降低,LVEDP、HW/BW明显升高,差异具有统计学意义(均P<0.05);其中miRNA-665组LVSP、+LV dP/dtmax明显高于Model组和Vector组,LVEDP、HW/BW明显低于Model组和Vector组(均P<0.05),见图1。
2.2 大鼠心肌组织miRNA-665表达
miRNA-665组miRNA-665表达明显高于Sham组、Model组和Vector组,Sham组miRNA-665表达又明显高于Model组和Vector组,差异有统计学意义(均P<0.05),见图2。
2.3 大鼠心肌组织形态学变化
Sham组心肌细胞排列整齐,细胞间隙清晰、均匀;Model组和Vector组心肌细胞减少,可见大量结缔组织,同时伴有炎性细胞浸润,心肌间隙增加,偶见水肿;miRNA-665组可见部分心肌细胞坏死,纤维结缔组织增生,但较Model组和Vector组明显减轻,见图3。

与Sham组比较,**P<0.01;与miRNA-665组比较,##P<0.01图2 大鼠心肌组织miRNA-665表达Fig.2 Expression of miRNA-665 in myocardial tissues

A:Sham组;B:Model组;C:Vector组;D:miRNA-665组图3 各组大鼠心肌组织切片HE染色(×100)Fig.3 HE staining of myocardial tissues in rats(×100)
2.4 大鼠心肌组织TRPM7表达
免疫组化染色显示,阳性TRPM7蛋白主要呈棕黄色颗粒,Sham组未见棕黄色颗粒,Model组、Vector组和miRNA-665组棕黄色颗粒明显增多,但miRNA-665组较Model组、Vector组棕黄色颗粒有所减少(图4,箭头所示)。Western blot结果显示,Model组、Vector组、miRNA-665组TRPM7蛋白表达明显高于Sham组,其中miRNA-665组TRPM7蛋白表达明显低于Model组和Vector组,差异有统计学意义(均P<0.05,图4)。
2.5 大鼠心肌细胞凋亡情况
阳性凋亡细胞核呈棕黄色颗粒,Model组可见大量棕黄色颗粒,Sham组、Vector组和miRNA-665组棕黄色颗粒明显较Model组少(图5)。进一步比较各组之间心肌细胞凋亡指数,结果发现与Sham组相比,Model组、Vector组、miRNA-665组心肌细胞凋亡指数较高,与Model组、Vector组相比,miRNA-665组心肌细胞凋亡指数较低,差异有统计学意义(均P<0.05,图5)。

A~D:免疫组化染色,×100;A:Sham组;B:Model组;C:Vector组;D:miRNA-665组;E:Western blot检测大鼠心肌组织TRPM7蛋白表达;与Sham组比较,*P<0.05 **P<0.01;与miRNA-665组比较,##P<0.01图4 各组大鼠心肌组织TRPM7蛋白表达Fig.4 TRPM7 protein expression in myocardial tissues of rats
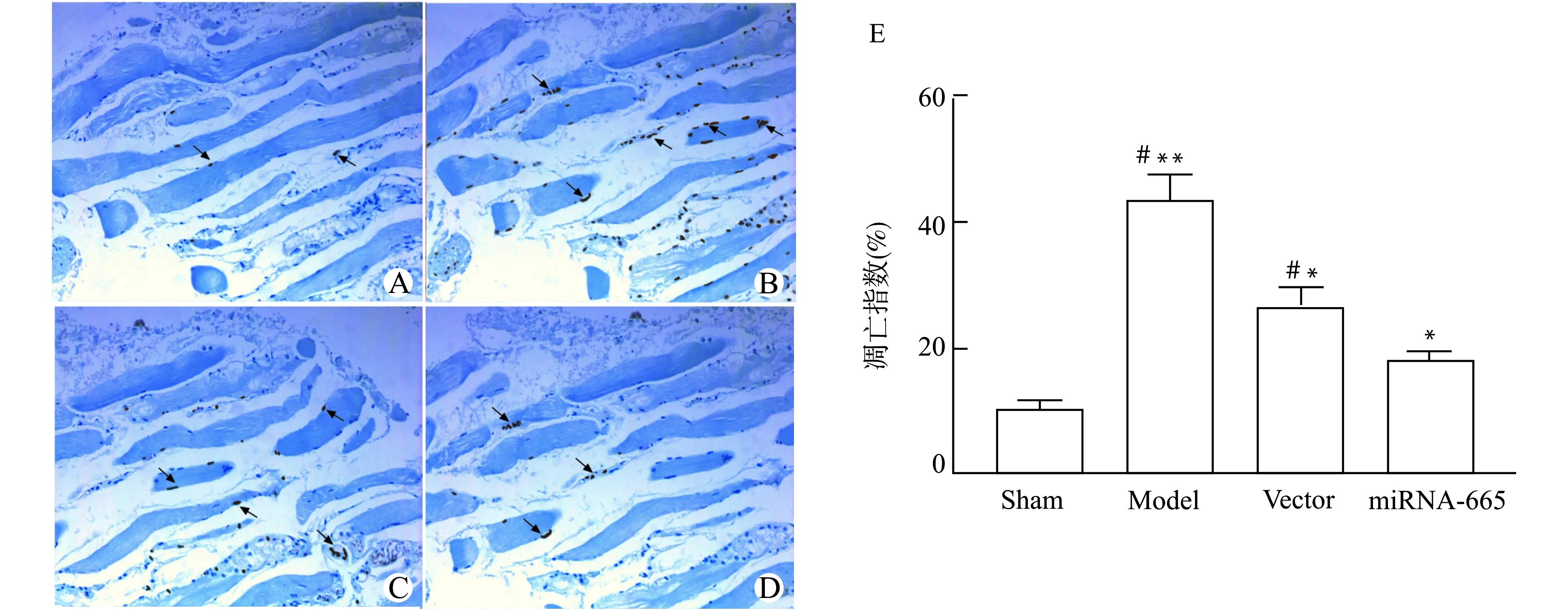
A:Sham组;B:Model组;C:Vector组;D:miRNA-665组;箭头所示为TUNEL染色凋亡细胞;E:大鼠心肌细胞凋亡指数比较;与Sham组比较,*P<0.05 **P<0.01;与miRNA-665组比较,#P<0.05图5 各组大鼠心肌细胞凋亡情况(TUNEL染色,×400)Fig.5 Apoptosis of myocardial cells of rats in each group(TUNEL staining,×400)
2.6 大鼠心肌组织凋亡相关蛋白表达情况
Western blot检测大鼠心肌组织凋亡相关蛋白表达情况,结果显示,与Sham组相比miRNA-665组、Vector组、Model组Bcl-2、Bcl-xl表达水平降低,与Sham组相比miRNA-665组、Vector组、Model组Bad、Bax、Caspase-3、Caspase-9表达水平升高(图6)。进一步采用成像分析软件分析条带灰度值,结果表明与Sham组相比miRNA-665组、Vector组、Model组Bcl-2/Bax比值、Bcl-xl表达水平降低,与Sham组相比miRNA-665组、Vector组、Model组Bad、Caspase-3、Caspase-9表达水平依次升高,其中与Model组、Vector组相比miRNA-665组Bcl-2/Bax比值、Bcl-xl表达水平较高,Bad、Caspase-3、Caspase-9表达水平较低,差异具有统计学意义(均P<0.05)。
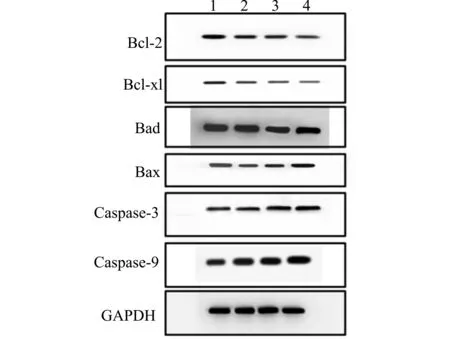
1:Sham组;2:miRNA-665组;3:Vector组;4:Model组图6 Western blot检测各组大鼠心肌组织凋亡相关蛋白表达情况Fig.6 Detection of the expression of apoptosis-related proteins in myocardial tissues of rats in each group
3 讨论
研究表明,miRNA-665是心肌组织特异表达的miRNA,参与了心脏发育、心肌缺血性损伤等心脏病理和生理过程[9]。Engelsvold等[10]报道称miRNA-665通过诱导血管新生,促进心肌缺血后心脏功能的修复。研究发现[11]严重心力衰竭患者miRNA-665表达减少,大麻素受体CB2可能通过上调miRNA-665表达发挥心肌细胞的保护作用。目前对miRNA-665的研究较少,其具体作用机制仍未阐明。有报道显示[12],miRNA-665可能通过Bcl-2和Akt信号通路调控细胞的增殖和凋亡。Sang等[13]报道枸杞多糖可以通过Akt信号通路上调miRNA-665表达来增强心肌细胞的抗凋亡能力,在抑制心肌纤维化和抗低氧损伤中起关键作用。
本研究发现与Sham组相比,Model组心肌组织miRNA-665表达显著降低,提示miRNA-665可能与心肌梗死后心力衰竭有关。基于载体病毒的miRNA前体转染是过表达miRNA的主要方法,常用的转染途径包括心肌注射、尾静脉注射和冠状动脉注射。本研究利用冠状动脉注射的方式转染miRNA-665,发现miRNA-665组miRNA-665表达明显上调,说明冠状动脉注射途径转染有效。本研究同时发现Model组心肌细胞明显凋亡,并出现大量结缔组织和炎性浸润,而转染miRNA-665后心肌细胞数量有所增加,炎性浸润明显减轻,说明miRNA-665可以改善梗死后心肌细胞炎症反应和细胞凋亡,从而延缓心肌纤维化。Xiao等[14]报道称miRNA-665通过抑制钙调蛋白、胰岛素样生长因子-1等表达阻断Ca2+信号通路,避免心脏发生重构和延缓慢性心功能不全的进展。Pang等[15]在体外大鼠模型中发现miRNA-665通过抑制结缔组织生长因子介导的肥厚信号抑制心脏肥厚和改善心脏功能。本研究发现转染miRNA-665后的慢性心力衰竭模型大鼠LVSP、+LV dP/dtmax明显升高,LVEDP、HW/BW明显降低,说明miRNA-665可以明显改善心力衰竭大鼠心脏功能。
TRPM7是miRNA-665潜在的靶基因之一,作为一种同时具有离子通道和激酶活性的双功能膜蛋白,在高血压、心力衰竭、心房颤动以及心脏的早期发育中发挥了重要的调节作用[16-17]。此外,Li等[18]研究发现TRPM7是血管紧张素Ⅱ诱导心肌成纤维细胞功能改变的重要环节,TRPM7可能是治疗纤维化相关心脏病的一种有前途的治疗靶点。本研究发现Model组TRPM7表达明显上调,而过表达miRNA-665后会引起TRPM7表达降低,提示miRNA-665与TRPM7可能起到负性调控作用。张静等[19]证实病理因素可以刺激心肌成纤维细胞分泌TRPM7,促进Ca2+细胞内流,通过启动生物级联信号诱导心肌成纤维细胞增殖、分化和释放细胞外基质,最终造成心脏间质纤维化和细胞凋亡。
本项研究发现Sham组心肌细胞凋亡指数较低,miRNA-665组心肌细胞凋亡指数较Model组、Vector组低,我们进一步研究了大鼠心肌组织凋亡相关蛋白表达水平,结果显示Sham组Bcl-2、Bcl-xl表达水平较高,Bad、Bax、Caspase-3、Caspase-9表达水平较低,miRNA-665组Bcl-2、Bcl-xl表达水平较Model组、Vector组高,Bad、Bax、Caspase-3、Caspase-9表达水平较Model组、Vector组低。Bcl-xl和Bcl-2为抗凋亡因子,在保护心肌细胞存活、抑制心肌细胞凋亡中扮演着重要角色[20]。而Bax、Bad为促凋亡因子,抑制Bax、Bad表达水平对心肌缺血再灌注损伤后可发挥保护作用[21],Bcl-2/Bax比值升高,线粒体外膜通道开放受抑,细胞凋亡受到抑制。而在线粒体凋亡途径中Caspase-3、Caspase-9是激活凋亡级联反应的关键环节,抑制Caspase-3、Caspase-9表达水平对缺氧诱导的心肌细胞凋亡具有保护作用[22]。本研究发现,与TRPM7表达趋势相反,Model组Bcl-2、Bcl-xl表达水平降低,而miRNA-665可以促进Bcl-2、Bcl-xl表达,抑制Bax、Bad的表达,进一步导致Bcl-2/Bax比值升高,同时能够抑制线粒体凋亡途径中Caspase-3、Caspase-9表达水平,提示miRNA-665对心肌的保护作用可能是通过抑制心肌细胞凋亡实现的。
综上所述,心肌梗死后心力衰竭大鼠心肌组织miRNA-665表达下调,可能使其对TRPM7的抑制作用减弱,进而导致心肌细胞凋亡。
