马铃薯StUOXs基因家族的生物信息学分析
2020-10-13梁丽琴
梁丽琴,杨 瑞,郜 刚,*
(山西师范大学 a. 生命科学学院;b.文理学院,山西 临汾 041004)
泛醌氧化酶(ubiquinol oxidase,UOX)是核基因编码的线粒体末端氧化酶,它与细胞色素C氧化酶(cytochrome C oxidase,COX)同属于血红素-铜氧化酶家族(Heme-Copper family)[1]。其中,COX是线粒体呼吸链的末端酶,位于线粒体内膜上,催化电子从细胞色素C转移到氧,并将质子排到线粒体膜间隙最终经ATP合酶使ADP转化为ATP供能[2-3]。而UOX主要分布在线粒体内膜,负责催化泛醌的抗氰氧化并将分子氧还原为水,但不转移质子,因此与氧化磷酸化没有联系[4]。除此之外,UOX的表达受诸如冷、活性氧物种和病原体感染等胁迫影响时,会导致COX途径减少电子流动[5-6]。
近年来,有关泛醌氧化酶的研究进展主要集中在发育与胁迫应答方面。其中研究较深的是交替氧化酶(alternative oxidase,AOX),AOX是一种膜结合的非质子泵类的泛醌氧化酶,存在于大多数植物以及许多真菌和原生动物中[7]。在拟南芥中,已鉴定出5个编码AOX的基因:AOX1a-d和AOX2。其中的AOX基因家族的表达被证明与组织和发育有关;在豆科植物中,鉴定出了4种AOX即CaAOX1和CaAOX2A,B和D[8]。而且AOX的活性和表达也已经在几个物种中被证明是由许多非生物胁迫诱导的,例如冷[9-10]、旱[11-12]氮和磷限制和活性氧诱导胁迫[13],表明AOX在优化叶片代谢以适应不断变化的环境条件方面发挥了重要作用。AOX基因的表达谱以及AOX的数量和活性对强光条件表现出强烈的响应,这表明AOX基因与叶绿体新陈代谢有关[14]。除此之外,交替氧化酶途径通过调节细胞ROS、苹果酸阀和抗氧化系统优化渗透和温度胁迫下的光合作用。关于其他类型的泛醌的研究极少,尤其是它们与已知AOX在结构、功能、进化关系等方面的研究未见报道。
马铃薯(Solanumtuberosum)是中国第三大粮食作物,含有人体所需要的各种营养成分,是一种重要的粮食和蔬菜作物[15-16],它的适应性很强、营养丰富、经济效益高[17],但是由于近年来土地资源的各种问题,马铃薯的种植出现倒茬问题,这使得马铃薯土传病害尤其是青枯病加重,因此对马铃薯产量有巨大的影响。但是有关马铃薯中的StUOXs(EC:1.10.3.11)的研究尚未见报道。本文通过同源序列比对在马铃薯SolTub_3.0基因组中鉴定了马铃薯的5个StUOXs基因,并对其进行序列比对、进化树构建、蛋白质性质表达谱分析,旨在研究StUOXs在马铃薯抗病过程中发挥的作用,进而为提高马铃薯的产量作贡献。
1 材料与方法
1.1 马铃薯StUOXs家族基因序列的提取
利用前期马铃薯测序获得的一条StUOX4 EST序列为出发点序列,进行Blast同源性比对,进行insilico克隆[18]。在PGSC网站下载马铃薯基因组中的全部蛋白质序列。以上述获得的StUOX4序列作为对象,通过Uniprot、Pfam、TBtools提取同源序列[19]。并对马铃薯的StUOXs基因根据染色体上的位置进行命名。在Ensemblplant数据库中获取烟草、番茄、辣椒、拟南芥全基因组序列[20],并提取StUOXs的同源基因序列。
1.2 StUOXs基因序列分析
依据上述获得的基因序列号在基因库中下载相应的基因组序列、编码区序列以及氨基酸序列,进一步进行序列结构与蛋白质结构预测等分析。用在线ExPASy (https://web.expasy.org/compute_pi与https://web.expasy.org/cgi-bin/protparam/)分析蛋白质的理化性质,如相对分子质量、理论等电点、不稳定指数、亲水性等;利用Protcomp 9.0(http://linux1.softberry.com/berry)预测它的亚细胞定位;利用TMHMM(http://www.cbs.dtu.dk/services/TMHMM/)预测StUOXs蛋白是否含有跨膜结构域。所用软件均为免费在线工具,在进行分析时,参数均采用默认值。
1.3 StUOXs进化树的构建
将马铃薯的5条StUOXs序列、番茄的4条序列、拟南芥的7条序列、烟草的7条序列及辣椒的24条序列放在MEGA7软件,利用ClustalW程序进行多序列比对,输出的多序列比对结果采用Maximum parsimony方法构建进化树[21]。

Clustal Consensus表示序列的同源性,其中“*”表示完全保守的残基位置;“:”表示有些保守的残基位置;“.”表示保守程度较低的残基位置。Clustal Consensus denoted sequence homology. “*” indicated positions with a fully conserved residues; “:” indicated the positions of some conservative residues; “.” indicated the positions of less conservative residues.图1 马铃薯StUOXs的多序列比对Fig.1 Multiple sequence alignment of representatives of StUOXs family
1.4 StUOXs基因表达模式分析
在PGSC网站上下载各序列的FPKM值,整理相匹配的mRNA数据,选择叶片、茎及整株植物中基因在不同处理条件下(如生物胁迫,热处理等)的表达量值。利用TBtools软件对表达数据进行可视化分析[22]。
1.5 StUOXs基因蛋白互作分析
通过在线Uniprot软件,打开Protein-protein interaction databases(STRINGi 4113.PGSC0003DMT400019707),获得与目的基因相互作用的蛋白,以及互作分值,从而预测目的蛋白的功能。
1.6 青枯菌接种及实时荧光定量PCR(qRT-PCR)检测基因表达
实验取7—8叶龄期的马铃薯幼苗,用108CFU·mL-1(D600=0.2)菌液伤根灌菌法接种[23]。处理后在0、24、48、72、96、120、148 h分别取样,液氮冷存,-80 ℃保存备用。每次处理重复3次。
以马铃薯Actin基因为内参,引物如下:Actin-F,5′-TATAACGAGCTTCGTGTTGCAC-3′;Actin-R,5′-ACTGGCATACAGCGAAAGAACA-3′。以StUOX4序列设计特异性荧光定量引物:F,5′-CGTGCCAACGCCCTCCTG-3′;R,5′-CACCGTCAGCCGCTTCGC-3′。正反引物各0.4 μL,2×TransStart Top Green qPCR SuperMix 10 μL,模板(稀释的cDNA) 2 μL,加ddH2O定容至20 μL[24]。
2 结果与分析
2.1 马铃薯StUOXs的蛋白序列的理化性质
通过EST片段序列在NCBI数据库进行电子克隆以及利用UOXs蛋白保守域建立HMM模型(PF01786)检索获得马铃薯的StUOXs的候选序列。之后利用生物信息学进一步验证,最终获得5条StUOXs序列,序列的ID号为PGSC0003DMP400022226、PGSC0003DMP400013471、PGSC0003DMP400032207、PGSC0003DMP400013470、PGSC0003DMP400023609;在拟南芥基因组中鉴定出同源序列有7条,分别为AT3G27620.1、AT5G64210.1、AT3G22360.1、AT1G32350.1、AT1G32350.2、AT4G22260.1、AT3G22370.1;辣椒中有24条同源序列(PHT93166、PHT93167、PHT72818、PHT66457、PHT64156、PHT67970、PHT64647、PHT92598、PHT49307、PHT87461、PHT94954、PHT86810、PHT89471、PHT60928、PHT73747、PHT73750、PHT74015、PHT88962、PHT72616、PHT68555、PHT75687、PHT96032、PHT70389、PHT83475)、烟草中有7条同源序列(OIS98262、OIT30507、OIT03592、OIT37664、OIT30836、OIT19320、OIS96044)及番茄中4条同源序列(Solyc08g075540.3.1、Solyc01g105220.3.1、Solyc08g005560.3.1、Solyc11g011980.2.1)。根据马铃薯中该基因各成员在染色体上的位置进行命名(StUOX1-StUOX5),并对其理化性质进行分析。分析发现该家族成员的氨基酸数目在279~366;相对分子质量分布在31~42 ku。其中StUOX3最小,仅含279个氨基酸残基,相对分子质量为31.90 ku。StUOXs的蛋白等电点为5.61~9.08。除StUOX2、StUOX5呈现酸性,其余成员呈现碱性,蛋白质表面电荷为正电荷;亚细胞定位5条序列均定位在线粒体(表1)。

表1 StUOXs理化性质基本信息Table 1 Basic information of physical and chemical properties of StUOXs
2.2 染色体定位
利用Stuberosum_448_v4.03.gene.gff3提取马铃薯的全部基因位置信息,查找StUOXs的对应位置信息。结果如表2所示,发现马铃薯的StUOXs分别定位在1号、8号和11号染色体上。
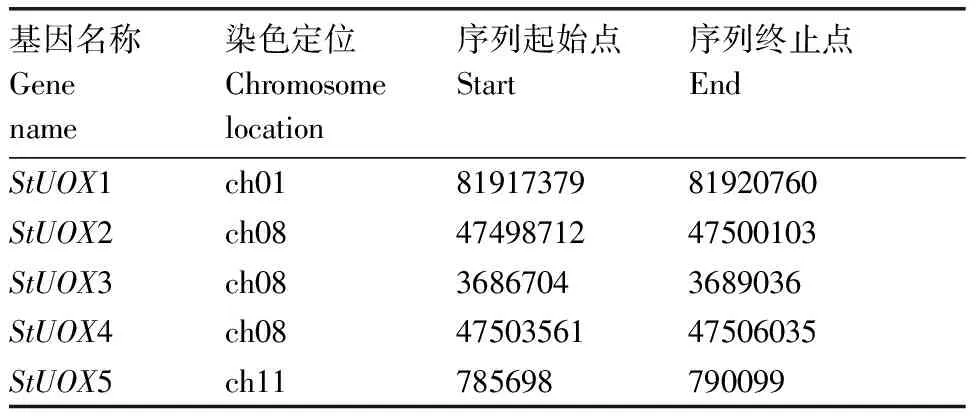
表2 马铃薯中StUOXs同源基因的染色体定位信息Table 2 Gene mapping information of homologous genes of StUOXs in potato
2.3 多序列比对
利用Bioedit对马铃薯的StUOXs的同源序列进行多序列比对(图1)。结果可以发现,StUOXs中序列同源性较高的残基有88个;StUOX1、StUOX2、StUOX3、StUOX4之间的相似性高于StUOX5。并且进化树分析也发现,StUOX1、StUOX2、StUOX3、StUOX4之间的亲缘关系较近,而与StUOX5的亲缘关系较远(图2)。
2.4 启动子分析
随机选取马铃薯StUOX4基因做代表性基因,提取起始密码子(ATG)上游2 000 bp序列,利用Softberry,Augustus,PlantCARE软件进行启动子顺式元件分析。分析发现,StUOX4含有MRE、CGTCA-motif、TATA-box、GARE-motif顺式作用元件,它们分别是参与光反应的MYB结合位点、参与MEJA反应性的顺式作用调节元件、TATA-box,以及赤霉素应答元件(图3)。这说明StUOXs会受光照强度、激素、生物胁迫的诱导。

用邻接法构建了StUOXs的系统发育树。The phylogenetic tree of StUOXs constructed by using the Neighbor-Joining method.图2 马铃薯StUOXs的进化树分析Fig.2 Evolutionary tree analysis of StUOXs family

1,MRE;2,CGTCA-motif;3,转录起始位点;4,TATA box;5,GARE-motif;6,起始密码子;7,终止密码子;8,PolA位点。图中浅色部分是外显子区域。1, MRE; 2, CGTCA-motif; 3, Transcription initiation site; 4, TATA box; 5, GARE-motif; 6, Start codons; 7, Stop codons; 8,PolA site. The light part showed the exon region.图3 StUOXs启动子顺式作用元件分析(StUOX4作为代表性成员)Fig.3 Analysis of promoter elements of StUOX4 as a representative member
2.5 蛋白质亚细胞定位及保守结构域分析
亚细胞定位预测结果表明(表2),StUOXs多定位于线粒体中。利用MEME进行蛋白保守结构域预测分析发现,motif2、motif4、motif6及motif9在StUOXs蛋白保守结构域中均存在;motif1、motif3、motif5、motif7在StUOX1、StUOX2、StUOX3及StUOX4中存在(图4)。整体上看,StUOX1、StUOX2、StUOX3、StUOX4编码的氨基酸蛋白序列保守性较高。
2.6 系统发育进化分析
通过将拟南芥、番茄、烟草、辣椒和马铃薯的UOXs蛋白序列总计47条序列进行建树(图5),结果发现,StUOXs基因与番茄、辣椒的UOXs的亲缘关系最近,与拟南芥、烟草亲缘关系远。除此之外,在进化关系图中发现辣椒的UOXs基因家族占有很大的比例,说明UOXs在辣椒中可能在长期的进化过程中形成并且发挥着重要作用。
2.7 马铃薯StUOXs基因的表达
利用PGSC在线网站下载马铃薯StUOXs的FPKM 数据,并对数据进行处理(图6),结果发现,叶片中的StUOX1、StUOX2、StUOX4、StUOX5在生物胁迫与病菌胁迫下表达量都增加,StUOX3的表达量有所下降;整株植物在35 ℃下暗培养发现StUOX2、StUOX4、StUOX5表达量下降,其他的两条序列的表达量变化不明显。除此之外,在图6中发现两条序列StUOX1、StUOX3的表达量是低表达;StUOX4、StUOX5的表达量在胁迫处理下表达量变化差异大;StUOX2在5条序列中的表达量是高表达。
2.8 蛋白互作分析
通过蛋白互作关系分析可了解与目标蛋白共表达的相关蛋白的情况,是预测蛋白功能的一种方法。本研究利用UniProt分析与StUOX4共表达和可能发生蛋白互作的蛋白,从而为研究StUOX4的功能提供参考。从图7中可以看到与1089114(StUOX4)蛋白互作分值在0.5以上的蛋白有10个,其中与102589531蛋白互作得分较高。102589531是酰基辅酶A合成酶(Acyl coenzyme A synthetase),NCBI注释中显示该蛋白参与脂肪酸的代谢、生物合成以及降解过程。102582385、102604331和NAD1是催化线粒体NADH氧化的替代NADH-泛醌氧化还原酶。此外,102586640、102586030、102595411是丝氨酸/苏氨酸蛋白磷酸酶在KEGG分析中显示参与mRNA的监测和信号通路调控。这些信息显示,StUOX4基因可能与mRNA的监测和信号通路调节有关。

左图为5个物种中UOXs 的系统发育树;右图为保守序列的分布,图中不同的颜色表示10个motif。The map on the left showed the phylogenetic tree of UOXs in 5 species, and the picture on the right showed the distribution of conservative sequences, with different colored boxes representing 10 putative motif.图4 StUOXs基因的系统发育关系和保守基序分析Fig.4 Phylogenetic relationship and conserved motif analysis of StUOXs genes
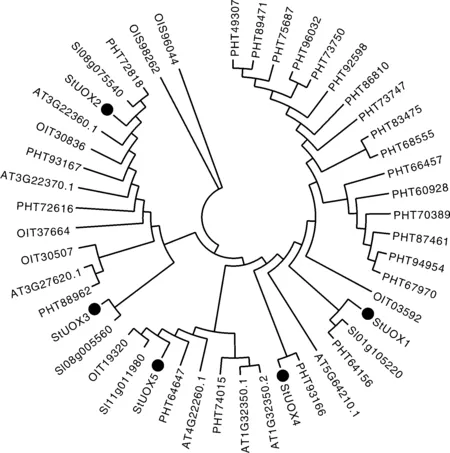
其中点标注的是StUOXs。此图是用MEGAV7.0软件使用最大简约法和1 000次重复生成树。The dot in the picture is marked with StUOXs. The tree was generated with MEGA v7.0 software using the Maximum Parsimony method and 1 000 bootstrap replicates.图5 马铃薯与烟草、番茄、拟南芥、辣椒UOXs家族系统发育树Fig.5 Phylogenetic tree of UOXs from potato, Arabidopsis, tomato, tobacco and pepper
2.9 StUOX4在青枯菌诱导下的表调模式
为了解StUOX4在马铃薯抗病过程中的应答反应,利用qRT-PCR分析青枯菌对StUOX4的影响(图8)。接种青枯菌后,StUOX4的相对表达量逐渐升高,在第4天达到峰值,在第5、6天时相对表达量降低。在接种后的7~21 d即感染青枯菌后的中后期,未检测到该基因的表达。这些结果表明,StUOX4参与马铃薯青枯病的早期应答反应。

此图是用PGSC软件获得StUOXs基因的FPKM值;用TBtools软件构建热图。The FPKM value of StUOXs gene was obtained by PGSC software; Heatmap was constructed by TBtools software.图6 StUOXs在不同组织器官中的表达谱Fig.6 Expression profiles of StUOXs in different tissues and organs
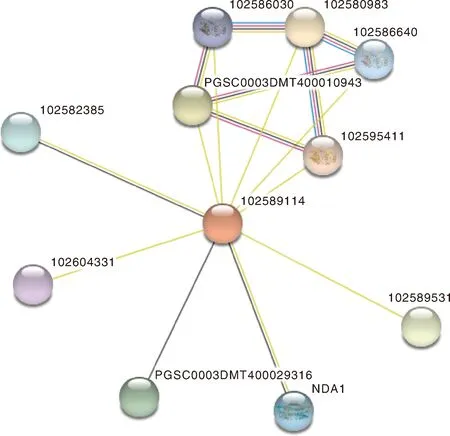
图中线条表示交互作用。102589114,StUOX4;102589531,酰基辅酶A合成酶;102582385,鱼藤酮不敏感的NADH-泛醌氧化还原酶;102604331,NADH-泛醌氧化还原酶;NDA1,线粒体内替代NAD(P)H-泛醌氧化还原酶A1;102586640,丝氨酸/苏氨酸蛋白磷酸酶;102586030,丝氨酸/苏氨酸蛋白磷酸酶;102595411,丝氨酸/苏氨酸蛋白磷酸酶。The lines in the figure represent the interaction. 102589114, StUOX4; 102589531, Acyl coenzyme A synthetase; 102582385, Rotenone-insensitive NADH-ubiquinone oxidoreductase; 102604331, NADH-ubiquinone oxidoreductase; NDA1, Internal alternative NAD(P)H-ubiquinone oxidoreductase A1 in mitochondria; 102586640, Serine/threonine-protein phosphatase; 102586030, Serine/threonine-protein phosphatase; 102595411, Serine/threonine-protein phosphatase.图7 马铃薯中基因的相互作用Fig.7 Protein interaction map in potato

图8 利用qRT-PCR分析接种青枯菌的马铃薯幼苗StUOX4基因的相对表达量Fig.8 The relative expression of StUOX4 gene in potato seedlings treated with Ralstonia solanacearum by qRT-PCR
3 讨论
泛醌氧化酶作为线粒体末端氧化酶,在植物的生长发育调节及胁迫应答中发挥着重要作用。随着基因组学与分子生物学的发展,有关AOXs的研究已有很多,如AOXs已在多种植物中被鉴定与克隆,如水稻、番茄、小麦、拟南芥及豆科植物[6,8,25-26]。本研究通过利用生物信息学的方法在马铃薯基因组中鉴定出了5条StUOXs蛋白序列,其编码序列属于血红素—铜氧化酶家族,该家族的成员中的血红素—铜中心用于催化氧还原为水的四电子还原反应[27]。对StUOXs进行分析发现它们编码的蛋白约有350个氨基酸残基,相对分子质量大概在36~41 ku,亚细胞定位发现它们均分布在线粒体中,其中StUOX2在胞外也有分布,并且它还含有2个跨膜结构及6个外显子;通过将马铃薯、番茄、拟南芥、烟草、辣椒的UOXs进行进化树分析发现,马铃薯的5条StUOXs同源序列与番茄、辣椒的UOXs的亲缘关系最近,较拟南芥、烟草稍远。之后对马铃薯的不同器官中的StUOXs基因的表达量进行了在线分析,发现StUOXs家族的5个基因中有4个基因在生物胁迫与病菌胁迫下表达量都增加,且StUOX4、StUOX5的表达量在胁迫(如病原菌、激素、温度、光照)处理下表达量变化差异大,而StUOX2是5条序列中的表达量最高的序列,说明4个基因参与了胁迫的响应。图7对目标基因进行蛋白互作分析发现,StUOX4与脂肪酸的代谢、合成及降解有关;与NAD1有相互作用参与生物在不利条件下的电子传递过程;还与丝氨酸/苏氨酸蛋白磷酸酶有相互作用,参与mRNA的监测以及信号通路调控。qRT-PCR实验表明,StUOXs参与马铃薯青枯病的早期应答反应。因此,开展这些基因的功能研究,可为植物青枯病菌的防治机制提供参考。
植物在受到逆境胁迫后,往往会产生自我保护途径,其中基因的应激表达是最主要的。而且基因的表达会受到启动子的调控,因此,研究目的基因的启动子顺式作用原件有非常重要的意义。本文对StUOXs的启动子顺式作用原件进行分析,StUOXs含有激素诱导的调控原件,如MRE、CGTCA-motif、GARE-motif等顺式作用元件。除此之外,StUOXs会受光照强度、生物胁迫的诱导。这些顺式作用元件的存在可能表明马铃薯在受到非生物胁迫后StUOXs基因在应答反应中发挥着重要作用。
UOXs基因的表达影响植物的生长发育及对外界的抵抗力,它们在植物生长发育的各个生理过程及植物对环境的适应过程中起到重要作用。有研究发现,亚基Ⅰ中保守的芳香氨基酸残基如Trp280、Tyr288、Trp331和Phe348对于UOXs的催化功能是必不可少的,它们参与了血红素—铜双核中心的组装和功能[28]。AOXs作为一种泛醌氧化酶,它会影响病毒的侵害,当植物在受到病原菌侵害时,往往会导致一氧化氮和氰化物的产生,而它们会干扰线粒体的功能[29],如烟草中的AOX在丁香假单胞杆菌侵染过程中发挥重要的作用。这与我们对马铃薯的StUOXs的基因表达数据分析发现的StUOXs在生物胁迫、病原菌的胁迫下表达量会变化一致。而且AOXs基因可被活性氧(reactive oxygen species, ROS)、水杨酸(salicylic acid, SA)和逆境(寒冷、干旱、盐分、病原体)上调[30-34]。本文同样发现马铃薯的StUOXs的基因在激素、温度的胁迫下表达量会发生变化。这些结果暗示马铃薯的StUOXs基因在生物胁迫、激素、胁迫应答反应过程中有重要功能,尤其是在马铃薯与青枯菌互作的早期,该基因的强烈上调表达显示其参与了马铃薯对青枯菌的应答反应,这与本实验室前期的相关研究的结论是一致的[24]。
本文在鉴定马铃薯StUOXs基因的基础上,利用生物信息学方法对StUOXs基因结构、理化性质、进化树构建和表达谱进行分析,并对StUOX4参与功能进行了初步分析,这将为进一步深入研究马铃薯StUOXs的生物学功能提供重要线索。
