体外循环下心脏瓣膜置换术后心包及纵膈引流液量的变化
2020-10-13于仁斌
于仁斌
(青岛大学附属医院,山东青岛 266555)
心脏瓣膜病是一种临床中非常多见的心脏疾病,患者主要表现为风湿热引发的瓣膜损害。伴随着人口老龄化问题的加剧,老年性瓣膜病、心肌梗死以及冠心病所导致的瓣膜病变也越来越多,加强早期诊断治疗,是提高患者生存质量的重要任务[1]。体外循环下心脏瓣膜置换术是目前治疗心脏瓣膜病的主要方法,但同时较之其他术式具有较高的术后并发症发生率。根据相关文献报道显示[2],体外循环下心脏瓣膜置换术的术后死亡率为3.33%~18.72%。尽管随着医学技术的发展,体外循环下心脏瓣膜置换术日渐成熟,死亡率也有了极大程度的控制,但术后出血仍然是体外循环下心脏瓣膜置换术一大难题,不仅有着较高的发生率,同时还会引发术后二次开胸探查、大量输血等。目前,针对体外循环下心脏瓣膜置换术的研究中,更多倾向于对术式方案的制定以及术中精细化操作,关于术后出血方面的报道还相对较为欠缺。有研究者表示[3],体外循环下心脏瓣膜置换术后出血,会增加异体输血量,使得经血传输的感染风险随之增加,而纵膈引流量、心包引流量增多与术后出血密切相关,故可将其作为非常重要的判断指标。为此,加强对体外循环下心脏瓣膜置换术后心包及纵膈引流液量变化的观察,可有效掌握术后出血情况,为早期干预提供参考。现选取青岛大学附属医院收治的体外循环下心脏瓣膜置换术患者,对其术后心包及纵膈引流液的变化规律进行分析总结,结果如下。
1 资料与方法
1.1 一般资料
选取青岛大学附属医院2018年1月至2019年4月收治的心脏瓣膜病患者。①纳入标准:术前确诊为心脏瓣膜病[4],且符合体外循环下心脏瓣膜置换术指征[5];心功能改善后复查低于IV级后纳入观察对象;术前2周停止服用华法林抗凝治疗;签订知情同意书。②排除标准:术前合并有糖尿病、高血压、肢体动脉栓塞等疾病;合并有感染性心内膜炎、再次瓣膜手术等;术后任何原因引起中等量以上心包积液、胸腔积液。根据上述标准,本研究共纳入体外循环下心脏瓣膜置换术患者85例,其中女性44例,男性41例,年龄50~77岁,平均年龄(59.62±4.81)岁。根据心功能(NYHA)评级[6]结果显示,III级37例,II级48例。本研究经青岛大学附属医院伦理委员会审批通过。
1.2 方法
①术前准备:所有患者均在入院后接受心功能改善用药干预,主要包括:利尿剂、强心苷、β受体阻滞剂、血管紧张素转换酶抑制剂,部分患者不规律服用华法林抗凝。满足手术指征,则在获得患者同意后,为其提供体外循环下心脏瓣膜置换术治疗。
②手术治疗:常规全麻浅低温(32~35 ℃)体外循环下手术治疗。胸正中切口,纵劈胸骨开胸,行主动脉插管,经由右房将下腔静脉引流管插入,再通过上腔静脉或者右房插入上腔静脉引流管,针对单纯主动脉瓣置换的患者,则行右心房插入双极管。通过主动脉根部将4 ℃的含血停搏液灌入。针对行动脉主动脉瓣置换术的患者,则主动脉根本行斜切口或者横切口,采取右房-房间隔路径实施二尖瓣置换,将合并左心房血栓的患者同期清除再进行左心耳缝合。本组患者合并有心房纤颤的情况,均未同时给予射频消融术干预。术毕,将心脏插管拔除,并向其中注入鱼精蛋白,缝合,将引流管置入纵膈和心包中。本组资料中,均无心包未缝合以及胸膜破裂的患者。术中停止体外循环由于种种原因再次转机的患者均不纳入研究对 象。
③术后管理:术后将患者转入ICU,密切观察各项生命体征指标变化,及患者的尿量、出入量,并给予常规术后用药。与此同时,对患者的纵膈、心包引流液量变化情况进行密切观察记录,保证引流管通畅,每小时观测1次,结合患者的体重来进行引流液量的计算。术后3 h、术后6~8 h,取引流液,并对红细胞计数(RBC)、血红蛋白(Hb)、血细胞压积(HCT)进行检测。若患者确定无创面活动性出血情况,24 h引流总量在100 mL以内,且无二次开胸指征的情况,即可拔管。
1.3 统计学分析
1.4 观察指标
观察患者术后 1 h 到术后 12 h 心包、纵膈引流液量以及术后引流液量中 RBC、Hb、HCT 变化情况。
2 结果
2.1 术后心包、纵膈引流液量变化情况
本组85例患者,术后1 h到术后12 h心包、纵膈引流液量呈持续下降特征。术后1~2 h内引流液量的下降最为显著,但在术后6 h后,引流液量的下降逐渐趋于平缓,见表1。
表1 术后心包、纵膈引流液量变化情况(±s,mL/kg.h)

表1 术后心包、纵膈引流液量变化情况(±s,mL/kg.h)
时间 n 引流液量术后1 h 85 2.55±0.51术后2 h 85 1.62±0.34术后6 h 85 0.45±0.03术后8 h 85 0.27±0.02术后10 h 85 0.18±0.02术后12 h 85 0.15±0.01
2.2 术后引流液量中RBC、Hb、HCT变化情况
术后6~8 h引流血RBC、Hb、HCT水平与术后3 h引流血比较,RBC、Hb、HCT水平显著降低,差异有统计学意义(P<0.05);术后6~8 h循环血RBC、Hb、HCT水平与术后6~8 h引流血比较显著升高,差异有统计学意义(P < 0.05),见表2。
表2 术后引流液量中RBC、Hb、HCT变化情况(±s)
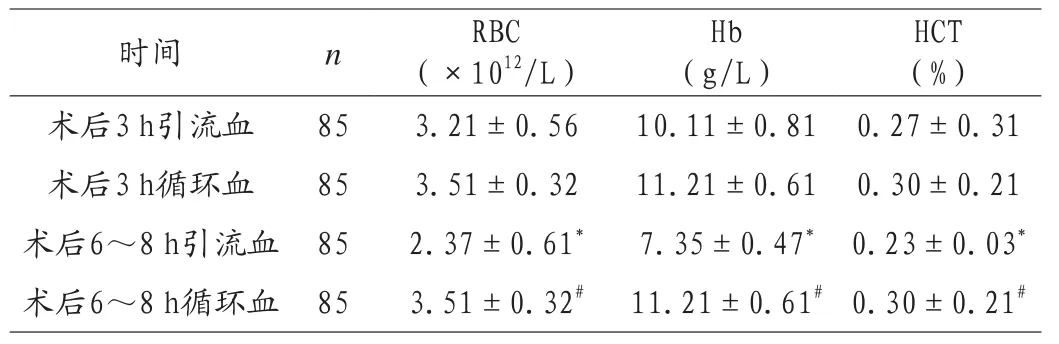
表2 术后引流液量中RBC、Hb、HCT变化情况(±s)
注:与术后3 h引流血比较,*P<0.05;与术后6~8 h引流血比较,#P< 0.05。
HCT(%)时间 n RBC(×1012/L)Hb(g/L)术后3 h引流血 85 3.21±0.56 10.11±0.81 0.27±0.31术后3 h循环血 85 3.51±0.32 11.21±0.61 0.30±0.21术后6~8 h引流血 85 2.37±0.61* 7.35±0.47* 0.23±0.03*术后6~8 h循环血 85 3.51±0.32# 11.21±0.61#0.30±0.21#
3 讨论
根据我国心血管外科注册登记的研究成果来看,国内平均每年行6万余例瓣膜手术,其中风湿性心脏病是引起瓣膜病的主要病因,尤其是在人口老龄化形势的影响下,年龄在65岁左右的老年群体成为心脏瓣膜病的高发群体,同时也意味着瓣膜置换术难度的增加。术后出血是心脏瓣膜置换术的首要并发症,发生率大约为2%~11%[7]。这主要是由于体外循环下需要采用各种管道,这属于外界异物入侵、非生理性灌注,加之受到低温等因素的共同影响,即可引发凝血系统失衡、纤溶亢进,导致出血,而出血又会加剧凝血系统失衡[8]。为此,加强对术后出血的预防、控制非常关键。
有研究者认为[9]导致体外循环下心脏瓣膜置换术后出血的因素非常多,包括低体温、止血不彻底、肝素中和不全、获得性暂时血小板功能异常等,其中止血不彻底是最关键的因素。为降低这些危险因素,本组患者在术前均首先为患者提供心功能药物治疗,确定心功能分级(NYHA)评分低于IV级后再行手术干预,可以观察到本组患者术后6 h引流液量均无显著增加。而针对肝素中和不全的问题,则对鱼精蛋白用量、用药时间进行调整,以此实现对出血发生率的控制。在本组患者中,术后1~2 h的引流液量显著较多,此时为其提供10~20 mg的鱼精蛋白,较好地控制了引流液量增多现象。为此,谨慎细致的手术操作是控制术后出血的基础,但体外循环下心脏瓣膜置换术后出血的控制,还必须从多方面来综合防控,关键是要掌握出血量和出血趋势,给予有效的止血干预,这就要求我们能够把握住体外循环下心脏瓣膜置换术后出血的规律。
术后早期,特别是在术后12 h内胸腔内出血往往与心包、纵膈引流液量密切相关,尤其是术后前6 h,又被称之为“关键6 h”[10]。结合本研究结果来看,本组85例体外循环下心脏瓣膜置换术患者,术后1~2 h表现出非常显著的心包、纵膈引流液量较大的特征,而在术后6 h引流液量有了显著下降,且逐步趋于平缓。在整个引流液量下降的过程中,引流液量表现出非常显著的波动性下降,而术前1~2 h引流液量占据了整个引流液量的42%,尤其是术前1 h,占据了非常大的比例。有研究者认为[11],出现这种情况,主要是由于术后1~2 h是血小板功能恢复时间、肝素反跳发生高峰时期、复温之后逆转血小板内脏沉积作用时间。随着机体的逐步恢复,在术后6~12 h血小板的暂时性功能损伤逐步恢复,故此后的引流液量必然会逐渐下降,且在6 h时趋于稳定后即可拔管。在留置引流管的这段时间内,始终会有大量的液体流出,这正好与体外循环导致凝血机制遭受破坏并引发炎症反应的结果一致。但即便是如此,本组资料病例仍然能够在一定时间范围内实现自我止血。这就表明,尽管体外循环会导致凝血因子、血小板损耗严重,但机体仍然有充足的储备应对机体修复。但这种情况不得出现大血管出血现象,当术后血压逐步稳定之后,自身的止血功能就可发挥较好的止血效果[12]。为此,临床可观察到术后6 h引流液中的红细胞数量呈现为非常显著的下降,这就与上述分析结果相一致。为此,在体外循环下心脏瓣膜置换术后加强术前6 h的严密监测,在未出现大血管闭合的情况下,无需过多干预出血问题,配合内科纠正即可取得一定的止血效果。当然这对外科医师的判断和处理都是非常大的考验,一旦确定存在活动性出血的情况,就必须立即为患者安排手术实施止血干预[13]。
综上所述,在体外循环下心脏瓣膜置换术治疗中,术后出血是其常见并发症,通过早期的心包、纵膈引流液量变化及成分变化的监测,能够为医者提供术后6 h关键时期的出血风险评估,有效实现对术后出血的预防控制。但在实际运用期间,必须考虑不同患者的特性各不相同,为此必须多项指标综合评估,以便更为准确的掌握体外循环下心脏瓣膜置换术后出血征象特点,为临床早期干预提供客观依据。
