中成药欧盟注册分析
2020-10-12张钰沙康吴正红祁小乐
张钰 沙康 吴正红 祁小乐
摘要 自2004年起,欧盟和美国分别发布了《传统植物药注册程序指令》和《植物药产品指南》,掀起了中药的新篇章,西方发达国家第一次在法律层面上认可中药作为药品的地位,现通过对欧盟植物药注册法规法律的探讨以及注册成功案例的分析,为我国中成药国际化注册提供一定参考。
关键词 中成药;欧盟;出口;质量标准;植物药专论;注册;政策法规;技术性贸易壁垒
Abstract Since 2004,the European Union and the United States have separately issued the Directive on Registration Procedures of Traditional Botanical and Guidance for Botanical Drug Products,setting off a new chapter in Chinese medicine.For the first time in the Western developed countries,the status of Chinese medicine as a drug is recognized at the legal level.This paper provides a reference for the international registration of Chinese patent medicine through the discussion of EU botanical registration laws and regulations and the analysis of successful registration cases.
Keywords Chinese patent medicine; EU; Export; Quality standard; Botanical monograph; Registration; Policies and regulations; Technical trade barriers
中图分类号:R282文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.17.030
中医药作为我国传统医学,无论在古代还是在现代社会,对人们的健康生活产生了重大影响,可以说中医药在我国具有不可替代的地位。在现代国际市场中,中药的贸易额已逾600亿美元,且仍以每年10%的速率增长[1]。但是在庞大的中药市场中,我国仅占有不到20%的份额[2]。
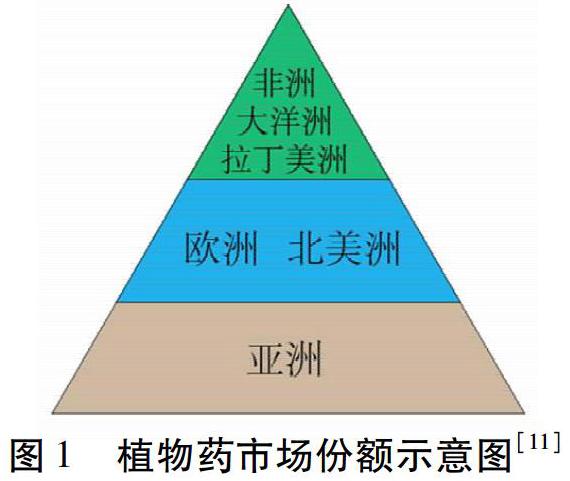
欧洲作为全球最大的植物药市场之一。见图1。每年销售额约占全球销售额的45%[3-5],有着700多年的植物药应用历史的欧洲是西方最成熟的植物药市场[6],因此,欧洲也成为我国第二大中药出口方向[7]。但长久以来,我国中药产品不被欧洲药品市场所认可,仅以膳食补充剂、食品、化妆品等形式在欧洲市场流通,附加值较低[8-9]。植物药产品没有像化学药物一样有着严格的市场准入和监管力度,其安全性受到质疑,因此,2004年欧盟頒布了《欧洲传统植物药注册程序指令》(即2004/24/EC法令),第一次从法律层面上承认了植物药的药品身份,阐述了植物药的定义,对植物药注册程序、申报材料、审批程序作出了详细的规定[5,8-9]。
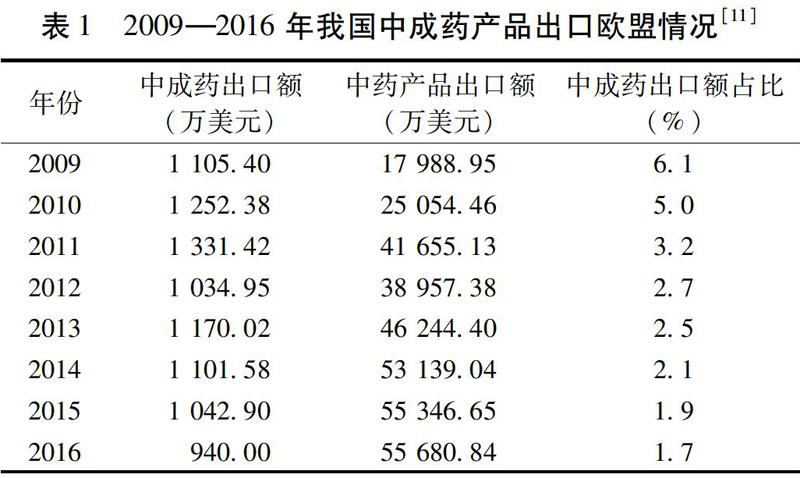
这为我国中药进入欧洲市场提供了机遇,大大改变了以前中药作为食品、保健品、膳食补充剂等尴尬的境遇,也为世界对我国传统中药的重新认识起到积极的作用。机遇与挑战共存,法令的颁布也带来了更为严格的监管,在国内能够满足注册要求的中成药在欧盟市场却屡屡碰壁,如表1所示,在2011—016年中成药出口欧洲的出口额逐年下降,中成药占比也是逐年下降,我国中药出口产业迎来低谷期[9-10]。值得欣慰的是,中药出口贸易结构逐渐优化,从低附加值的中药材及饮片逐步转变为附加值较高的中药提取物,但中药的严峻形势不容小觑。因此,我们分别从欧盟的药品政策法规制度、中药注册失败原因解析、成功注册经验总结以及应该采取的措施这4个方面来进行详细阐述,从而发现中药全球化面临的问题以及中成药国际化的突破口。
1 欧盟的植物药政策法规制度
1.1 欧盟的植物药注册法规 欧盟的药品法规是由各成员国的法规制度和欧盟药品管理局(European Medicines Agency,EMA)组成。从1965年的第一部药品监管法令65/65/EEC开始,一直到2004年前后颁布了多项法令来规范和完善欧盟的药品管理法规,但这些法规主要针对的都是化学药品[12]。在2004年4月颁布的2004/24/EC法令[13],第一次从法律层面上承认了植物药的药品身份。
欧盟药品法(2001/83/EC法令)及其补充修正案(2004/24/EC法令)将植物药分为3类,分别是新植物药、固有应用植物药以及传统植物药。其中新植物药申请资料最全,申请难度最高,门槛最低。而传统植物药申请难度最低,但是门槛最高,超过30年的应用历史,且在欧盟应用的时间超15年,必须为口服、外用或吸入制剂,才可进行简化注册申请。而固有应用植物药则是难度和门槛均适中的一类:在欧洲有超过10年的应用历史,部分申请资料可用相关文献进行代替[13-14]。
1.2 欧盟的药品监管机构 欧洲药品评价局(European Agency for the Evaluation of Medical Products,EMEA)是EMA的前身,从1995年开始对人用药和兽用药进行监管,主要职责是评价及监管人用及兽用药品的安全性和有效性,保护民众和动物的生命健康[15]。
欧洲质量管理局(European Directorate for the Quality of Medicines & Health Care,EDQM)是重要的监管部门,其主要负责药品质量标准的制定和修订、标准品的制备和欧洲药典适用性证书的批准等[5,11,15]。
2004年9月植物药药品委员会(Committee on Herbal Medicinal Products,HMPC)的成立体现了欧盟在不断加强对植物药审批及监管程序。
1.3 欧盟植物药专论 为了促进欧盟地区植物药药品领域技术标准的统一,HMPC建立了植物药专论(Community Herbal Monograph,CHM),并为成员国内部植物药药品审评标准提供参考[11,16]。其内容主要包含对植物药物质及其制剂有效性和安全性数据的科学见解,同时提供含有特定植物药物质或制剂的药物的所有信息:功能用途;适用人群;不良反应及药物相互作用的安全数据[17]。
同时,HMPC也会对某些植物药发布公开声明(PS),即认为这些植物药不满足建立专论的条件。《中华人民共和国药典》(2015版)中收录了当归、丁香、白屈菜、积雪草这几种植物药[18],但是这些植物药已被HMPC发布PS,因此,在欧盟注册中成药时,要注意避开含这几种植物药的处方[14,17]。
除了CHM外,还有欧盟植物药目录(European Union List Entries)来补充植物药物质的传统应用植物药专论,但与CHM不同的是,欧盟植物药目录具备法律效应。因此其可以被传统植物药药品注册(Traditional Use Registration,TUR)的申请人用于代替其产品在安全性和传统使用的证据,前提是申请人可以证明他们提供的产品或相关声称符合目录中的信息[17]。
1.4 植物药注册分类 根据相关法规,欧盟的植物药药品注册分为完整注册和简化注册两大类。完整注册申请,提交的资料较为完整,需提供一系列完整的非临床实验数据和临床试验结果,来向欧盟证明其产品的安全有效以及质量可控。而简化注册申请,需提供的申请资料简单一些,一些非临床及临床数据可用有关文献、专家报告或证据替代。
第1类:TUR,这类申请关键在于提供30年应用历史及15年欧盟使用历史的证据来证明其产品安全有效,从而减免非临床和临床研究。
第2类:固有应用注册(Well-Established Use,WEU),医疗用途明确、疗效可靠和具备安全性的植物药产品可进行申请注册。这类申请关键是提供详细的科研文献来证明其在欧盟使用10年以上,从而减免非临床和临床研究。
第3类:独立/混合申请(Stand Alone/Mixed Application,SA/MA),独立和混合申请的区别就在于安全性和有效性的数据是否全部由申请人本身提供,若是一部分由文献数据支撑则属于混合申请,否则为独立申请。这类申请需要提供完整的申报资料,且一般需要进行临床研究,仅有部分资料可用文献代替[7]。
理论上讲,我国中药企业可按照上述3种方式中的任意一种申请注册。但我国包含安全性和有效性评价的所有内容的科研文献仍不被国际所认可,而独立/混合申请对于一般的中药企业来说周期太长,难以实现,因此现阶段选择TUR申请相对更为容易,但其注册申请门槛太高,仅有部分产品符合要求。
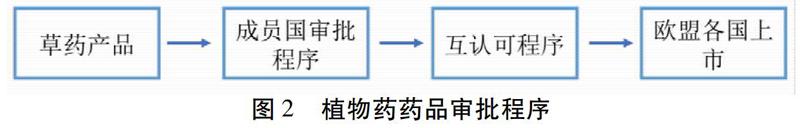
1.5 欧盟药物注册程序 欧盟进行药物注册主要有2种方式:集中授权程序和国家授权方式。集中授权方式为集中审评程序(Centralized Procedure,CP),是指药品通过EMA审批后,在整个欧盟地区上市销售;国家授权方式则包含“非集中审评程序”(Decentralised Procedure,DCP)“互认程序”(Mutual Recognition Procedure,MRP)以及“成员国审批程序”(National Procedure,NP)[13]。1)集中审评程序,针对死亡率较高的且难以根治的疾病或者是利用高科技或生物技术制备的产品等药物必须采用集中审评程序。审批程序也最为完善,申请者资料递交结束后,审评人员进行审评并起草报告草案,解决问题后,将报告递交至EMA,获得最终评估报告。审评周期最长,为210 d。2)非集中审评程序,当多个成员国收到申请者递交的注册申请资料,且已经进入审批程序的某一成员国则自动成为“参照国”,其余成员国可暂停审批,等待参照国对产品出具详细评估报告后,再进行审核。或由申请者指定某一成员国为参照国,其余成员国根据参照国的评估报告进行审核。如有成员国不认同其审批结果,可向欧洲药品管理局的人用药品委员会或兽用药品委员提出仲裁。3)互认程序,互认程序主要分为2个步骤,首先是递交互认申请和成员国受理,接着是互认審评。其主要过程是先将申请递交给一个成员国,其成为参照国。若审评通过,参照国将报告发给所有相关国家,相关国家在90 d内完成审核,如若同意参照国的审评意见,则颁发上市许可证。如有国家对参照国的决定有异议,可向欧洲药品管理局的人用药品委员会或兽用药品委员提出仲裁。委员会对异议做出仲裁结果后,相关成员国必须执行仲裁结果。若其未能做出仲裁结果,则移交欧盟理事会做出决定。我国在欧盟成功注册的地奥心血康就是先在荷兰获得上市许可证,然后通过互认程序在欧盟所有成员国内进行上市销售[13]。见图2。4)单一成员国审评程序,如果药品在单一成员国进行销售,则只需完成此成员国审评程序,手续相对简单,但销售市场不大,只能获得某一成员国的上市许可证。
2 中成药注册失败原因解析
欧盟的药品管理制度相较于我国来说还是更加严格,而且在欧盟,仍不承认矿物药和动物药可以作为药品的主要成分,所以说欧盟所谓的“植物药”其实并不等于是我国的中药,在近几年的中药出口额分布上来看[10-11,19-21],我国中药出口欧盟主要集中在植物提取物、中药饮片等低中端附加值产品上,而附加值较高的中成药出口额占欧盟出口额总数的四分之一还不到,所以说进军欧盟市场任重而道远。自从2004年欧盟开始对植物药进行监督管理后,虽给予企业长达7年的过渡期,但我国企业未能抓住时机加快推进中药注册,截止到2009年,国内并无一家中药企业提出中药注册申请,错失了中药注册的黄金时期[11]。此后,一些企业意识到时间的紧迫,向欧盟提交了注册申请,却因为达不到注册要求被欧盟拒绝。截止到目前为止,仅有3例中成药在欧盟成功注册,这对于我国庞大的中成药数目来说,无疑是相当微小的数字,我国中药企业在欧盟注册上市艰难的原因,可以归为以下几点。
2.1 简化注册条件高 2004/24/EC指令规定,植物药生产企业可通过简化注册程序进行注册,即申请注册的植物药可减免进行临床试验和安全性测试,只需提供文献资料证明其在使用过程中对患者无安全性隐患,且至少有30年的使用历史,以及15年以上的欧盟使用历史[15]。但事实上中成药有规模地进入欧盟市场是在20世纪90年代中后期,有的企业甚至更晚,这项条件對于企业来说是道门槛,而且有些企业的中成药产品虽然是在欧盟市场上销售了15年以上,但是在进入欧盟市场初期,记录较为混乱,难以证明其在欧盟已有15年的使用历史[22]。
2.2 注册成本高昂 中成药处方中大多包含多种中药,有效成分较为复杂,但2004/24/EC指令中规定必须对植物药中的各种化学成分进行检测,确定中药的成分和物质的含量,这样下来,一种中成药的检测费用可能高达40万欧元左右,还需GMP认证等手续费和硬件设施的投入,这样高昂的注册成本是许多中小企业无法承担的[22]。
2.3 研发动力不足 一个企业发展的根本动力是研发创新,中国市场广阔,能满足大多数企业的生存需求,而且中国在欧洲的市场份额较少。因此大多企业的目光仅停留在国内和亚洲,没有走出去的意愿,若是进军国际市场,中药产品大多还需进行二次研发,且不说时间和成本问题,短期销售难以回本,这对于中小企业是难以逾越的障碍。
2.4 政策解读不足 国际市场的法规标准参与度不够,对海外市场的医药法律政策研究不足,缺乏和目标市场进行多层次、系统性的交流合作机制。从2004/24/EC指令发布之后,中药企业对此指令重视不够,错失黄金过渡期,随着欧盟法规的不断完善,造成中成药注册难度不断加大。
2.5 基础研究不足 欧盟植物药注册相较于我国还是更加严格,数据资料要求更加完善,我国大部分企业仅仅为了在国内注册上市,对中药的研究仅限于国内标准所要求的内容,而这远远达不到欧盟注册的门槛。
2.6 质量管理不达标 缺乏科学合理的药材的种植、储存等管理规范,原药材的地产种植区域不清,产期不明,中药质量没有保障。2009年,英国当局销毁了大批质量不合格的中药材;2011年“牛黄解毒片”在香港被发现砷元素超标;2013年国际环保组织绿色和平组织表示,在对英美等7个国家的中药产品进行抽样检测时发现,产自中国的中药材产品出现农药残留现象。究其问题根源,还是由于中药材种植生产过程不规范、农药残留超标、加工生产设施落后等原因,其次还受贸易技术壁垒的影响。
2.7 恶性竞争 我国中药使用历史悠久,中药文化源远流长,但是这也造成了大量同名产品恶性竞争,部分中药企业生产工艺较为落后,限制了中药大品种的形成[2]。
3 成功经验
虽然有着各种各样的压力和困难,但可喜的是,成都地奥集团的地奥心血康、天士力的丹参胶囊以及广州香雪制药的板蓝根颗粒分别于2012年、2016年和2017年成功在欧盟上市[10-11],从他们注册的经历中,我将其归纳为以下几点。
3.1 注册国家的选择 欧盟成员国对植物药的态度不尽相同,有些国家将植物药列为食品和天然产品,对植物药的药品身份不太认同,比如希腊、爱尔兰、意大利、卢森堡等,植物药就很难进入这类国家;还有是承认植物药的药品地位,但申请注册资料和化学新药的一致,即必须提供药理、药效、毒理以及临床的全部数据,这类国家的注册就比较耗时耗力;还有一些国家有着悠久的植物药使用历史,对植物药的认识比较深入,承认植物药作为药品的身份,因此还颁布了相应的法规,这是中药进入欧洲最顺利的国家,例如比利时、德国、法国、荷兰等,成都地奥集团的地奥心血康就是从荷兰作为突破口,首先在荷兰申请注册上市,再通过欧盟的互认程序在整个欧盟地区进行上市。而2种中成药品种在荷兰成功上市,也让荷兰成为中药注册申请的热门国家之一。因此,选择注册门槛较低的欧盟成员国进行中药注册,然后通过互认可程序,在其他成员国获得市场准入,达到以点带面的目的[5]。
3.2 联盟合作战略 目前我国中药企业大多为中小型企业,资金和技术均很难支撑其渡过整个注册到上市流通的过程。而且,欧盟出台的政策中规定:申请注册植物药的企业必须是欧盟本土的企业。这两方面的原因均预示着我国我国药企必须要寻求与欧盟本土药企的合作,而且和本土企业合作有着很大的优势,可以充分利用其资金、技术、营销网络与经验,本土企业对当地的政策法规的解读也更为深刻,可以避免走许多弯路,减少资金投入,缩短研究周期,从而顺利通过药品注册申请[23]。2006年,地奥集团就与荷兰本土企业SU Biomedicine公司(简称SUB公司)达成战略合作,共同开发地奥心血康胶囊,也正是SUB公司为地奥集团提供了很大的信息和技术支持才使地奥心血康胶囊成为我国第一个在欧盟注册成功的中成药品种[9]。
3.3 适应证的选择 第一最好是选择单一适应证。药品的适应证越多,则需要提供每一种适应证的GCP研究数据和临床实验数据。我国的中小企业很难完成如此巨大的工作量,因此,选择单一适应证能够以较快的速度获得药品上市资格。地奥心血康、丹参胶囊和板蓝根颗粒在欧盟上市的适应证均只有一个,一定程度上加快其成功注册。
其次是要选对适应证。在欧盟成功上市的传统植物药产品中,产品主要集中在感冒、胃肠道紊乱、精神压力和情绪异常、失眠等常见疾病领域[24],而我国中成药产品在这些领域也有独特的优势[11]。
接着,还可以选择西药疗效欠佳的适应证,比如说糖尿病、艾滋病等慢性疾病,如果能够在中药中找到有明确治疗效果的中成药,相信其注册申请通过的可能性会很大。
除此之外,要注意剂型和适应证的选择要符合欧盟患者的疾病特点和用药习惯,做到“入乡随俗”。
3.4 产品种类选择 在欧盟批准的TUR和WEU的产品中,由2味药组成的复方制剂占据绝大多数,分别占总数的35%和39%[11]。而TUR单方产品占比则高达63%,这几年单方产品数占比稳定在63%左右,这说明单方产品更易获得欧盟市场的认可。绝大多数单方產品中植物药已经建立CHM或已出版专论,只有个别产品未建立专论或是发表PS。专论的建立与植物药的注册是相互促进的,已建立CHM的植物药产品可以在简化注册时减免申请材料,其安全性和有效性也更容易被欧盟认同,而注册产品数量的增加,也会促使其所含成分专论的建立。
4 摆脱困境的措施
4.1 欧盟植物药专论 CHM由欧盟药品监管当局组织制定,有着类似药品原料备案目录的作用,是官方就植物药安全及有效问题做出的科学评价,并促进欧盟植物药领域的技术协调统一。CHM被制定后,整个欧盟会接受其安全性和有效性。虽然它的内容不多,包含较少种类的植物药,但是提供了植物药的临床应用、药理性质、特殊用途等官方解释,且专论每年也在不断增补中,有利于植物药的发展。
但国内对CHM认识不足,忽略了其在欧盟植物药注册过程中发挥的重要作用,这也一定程度上造成了现在我国中成药在欧盟注册数量寥寥无几的现状。CHM虽然不是欧盟地区内的法律文件,但其具备一定的指导意义,任何不遵守CHM的行为均需要做出合理充分的解释[25]。目前,在欧盟成功上市的传统植物药药品中,完全或部分基于CHM获得上市批准的产品数目占到50%以上,因此CHM的重要性不言而喻[16]。
因此,我国中药企业在欧盟注册中药产品时,要考虑CHM涉及到的中药品种,如人参、姜黄等,同时也要避开那些发表PS的的中药品种,如当归等,如申报产品中涉及PS中的中药品种,需注意其不予建立专论的原因,并针对原因做好相应材料的准备,以证明其安全性和有效性[11]。
4.2 促进官方国际合作 我国政府部门、行业协会等组织也应积极和欧盟相关药品监管机构合作与沟通,并选取一些疗效显著、历史悠久、基础研究完善、认可度高、国际知名度高、安全有效的中药,并通过对欧盟市场传统用药习惯的研究,协助HPMC建立一批中药的CHM,推动中药在欧盟注册。近年来我国的政府机构、行业协会等组织为此做出了很多努力。2011年10月,《欧盟传统植物药注册程序指令》专题培训会成功举办;2013年6月,国家中医药管理局副局长访问波兰[17]。
4.3 积极宣传中医药文化 由于中西方文化的差异,中医理论很难被西方所理解,且双方对植物药制剂的认识还不同,欧盟的植物药制剂一般都是植物制成的,除特殊情况外一般不含维生素和矿物质[24],而我国的中成药的原料可以是植物,也可以是动物或矿物。而且,中药不同于化药,不能直接用西药的检测方式来评价中药,中药中的“君臣佐使”等思想在西方是完全没有概念的理论,所以中药标准和西药标准不能也不可能是相同的。中药国际化、现代化的关键是将中药的作用机制和物质成分阐述清楚,而这些工作离不开化学、生物学、临床医学等各方面工作者的通力合作。中药才能逐步满足药物安全、有效、稳定、可控的要求[23]。其次我们要向世界宣传中医药,让更多的人来了解中医药文化,从而接受中医药。可喜可贺的是,波兰已经成立了中医药行业组织:波兰针灸协会和波兰中医协会,2015年9月19日中医法案实施细则在匈牙利生效,匈牙利成为第一个对中医立法的欧盟成员国,2015年12月,北京同仁堂中医门店在捷克开业,中医药的文化随着“一带一路”在欧盟的中东欧国家传播[11,26]。
4.4 中医药与时俱进 传统中医药中也存在很多问题,它的很多用词都很模糊,而且中医讲究因人而异,无法像西医一样进行量化,且化学成分和制备工艺都较为复杂,难以进行质量控制,所以很难在药效、用法用量等方面做到标准化,国际化。
其次,中医药的发展需要现代化和国际化,有关政府部门可以将可以公开的重要中医药文件翻译成多国版本(法文、英文、西班牙文版等),让世界更加方便地了解和知道我国的中药文化和管理制度,证明我国的产品是安全有效可控的。要充分利用互联网和数据库信息,立足全球,建立一个系统、全面、标准、多语言的中医药知识平台,这将为中药产品进入国际市场发挥巨大作用[2]。
4.5 中医药标准有待提高 市场上的中成药大多达不到《国家药品临床试验研究管理规范》(GCP)的要求,这让国外市场难以认可中国的中成药。因此,多种先进质控手段并用,如信息化、多元指纹图谱、现代先进制造技术等,明确各中药中的药效成分,分析验证各成分的药理作用,变未知为已知,完善GMP管理体系,采用国际先进标准,打造现代中药先进制造平台。中小型中药企业因资金、设备、技术等原因,产品质量不稳定,若要满足欧盟要求,进入欧盟市场,则必须要走规模化道路,才能越过门槛,走向世界。
4.6 积极参与国际药品规则的建立 欧洲是重要的传统植物药市场,在植物药注册领域有着很大影响。在1990年,美国、日本及欧共体三的药品监管部门和行业协会共同成立了国际人用药品注册技术协调会(ICH),这为世界药品的注册监管提供了参考标准。我国在17年加入ICH,这在很大程度上促进了我国的药品注册监管能力的提升和体制的完善。
4.7 抓紧机遇 2016年6月23日,英国全民公投脱欧,对欧洲的药品市场产生巨大冲击,EMA总部也从伦敦迁往其他地方,药品审批减缓,而这对于研发和注册周期长的药品行业来说,无疑是一种挑战,但挑战总是与机遇并存,EMA总部迁往了荷兰的阿姆斯特丹,而荷兰是一个对中药比较认可的国家,在荷兰与当地企业合作无疑会对中药在欧盟注册更加有利[11]。
4.8 政策法规 各项指令、规划的发布也促进中药国际化的进程。《“十三五”中医药科技创新专项规划》中指出,加快推进中药大品种在美国、欧盟等国际主流医药市场的注册,提升中药的国际知名度。其中,实现在欧盟成员国或EMA成功注册20~30个中成药品种[27]。其次,《中药材保护和发展规划(2015—2020年)》[28]《中医药健康服务发展规划(2015—2020年)》[29]《中医药发展战略规划纲要(2016—2030年)》[30]《中国的中医药》白皮书[31]《完善中医药政策战略体系建设规划(2015—2020年)》[32]《中医药“一带一路”发展规划(2016—2020年)》[26]等文件发布;2017年7月1日,《中华人民共和国中医药法》[33]正式施行,为我国中药产品走出去奠定了基础。
5 小结与讨论
中药是我国的瑰宝,虽然现在欧美等西方主流医药市场对中药的态度不是很乐观,欧盟市场也很难看见我国传统中药制剂,但是,国际中药产业不能轻言放弃,积极向全世界宣传我国的中医药文化,文化和市场是相辅相成的,文化在一定程度上可以影响市场的风向。中药的现代化探索还需不断进行,运用现代科学理论和方法来建立安全有效稳定的标准。我国也需要学习欧盟在管理植物药的先进经验,取长补短,充分发掘和利用我国中药的特点和优势,争取早日完成中药国际化。
参考文献
[1]董志林.中医药在海外的现状及发展趋势[J].中药研究与信息,2005,7(11):4-6.
[2]陈致慜.确保中药材不受污染发展中医药大健康产业[J].中国人大,2016(7):46.
[3]晨绯.地奥心血康:靠科技实力进军欧盟[N].科技日报,2012-12-19(004).
[4]张恬恬,丰志培.欧美生物医药产业发展趋势、特点及其启示[J].中国卫生管理研究,2016,1(1):118-129.
[5]丁錦希,杨军歌.欧盟中药注册准入制度障碍研究-基于我国中药出口欧盟现状的分析[J].国际商务(对外经济贸易大学学报),2010,24(2):90-96,封3.
[6]张建武,邱琼.突破中药欧盟注册障碍的关键因素分析[J].中国中药杂志,2014,39(15):2972-2977.
[7]李得运,于志斌.2017年中药材进出口贸易分析[J].中国现代中药,2018,20(3):345-348,354.
[8]王雪松,莫颖宁.我国中草药出口欧盟市场现状及对策分析[J].中医药导报,2018,24(15):15-17,21.
[9]倪昊翔,孙源源.2004/24/EC指令下中药出口欧盟面临的注册困境及对策[J].中国中药杂志,2013,38(9):1447-1450.
[10]汪建芬,邢迪,张中朋,等.我国中药产品出口贸易形势及政策法规影响的分析[J].中国现代中药,2018,20(8):915-919,927.
[11]汪建芬.中成药欧盟注册分析及品种选择研究[D].北京:北京中医药大学,2018.
[12]中华人民共和国商务部.出口药品注册技术指南[EB/OL].[2019-05-29].http://www.mofcom.gov.cn/article/ckzn/yaopinzhuce.shtml.
[13]杨颜芳,张贵君,王晶娟.植物药欧盟及美国上市可行性途径及法规分析[C].中国商品学会.第四届中国中药商品学术大会暨中药鉴定学科教学改革与教材建设研讨会论文集.中国商品学会:中国商品学会,2015:189-194.
[14]朱友平.欧盟植物药注册法规和质量技术要求和中药国际化新药开发[J].中国中药杂志,2017,42(11):2187-2192.
[15]李丹.美国、欧盟及我国药品注册管理制度研究比较[D].杭州:浙江大学,2013:1-64.
[16]瞿礼萍,施晴,曾慧敏,等.深度解析草药专论对中药欧盟注册的价值与重要性[J].中草药,2017,48(9):1916-1920.
[17]汪建芬,张中朋,王雨彤,等.欧盟草药专论现况及对中药在欧盟注册的影响[J].中国现代中药,2017,19(5):610-614.
[18]国家药典委员会.中华人民共和国药典(一部)[S].北京:中国医药科技出版社,2015:86-87.
[19]姜振俊,张红梅,于志斌,等.中国中药材出口面对的国际市场标准[J].中国现代中药,2018,20(2):217-223,238.
[20]柳燕,于志斌.2018年中药类商品进出口形势分析[J].中国现代中药,2019,21(4):419-423.
[21]柳燕.中药贸易暖风拂面[N].医药经济报,2018-03-12(007).
[22]张志义.中药受阻于《欧盟传统植物药注册程序指令》后的思考[J].亚太传统医药,2011,7(9):1-2.
[23]陶晶,操玮,陆巍.中药注册管理的历史沿革及现状分析[J].中成药,2014,36(7):1509-1512.
[24]汪建芬,张中朋,许铭,等.欧盟成员国传统植物药品注册情况进展[J].中国现代中药,2016,18(12):1661-1665.
[25]European Medicines Agency.Community Herbal Monographs[S/OL].[2014-12-13].http://www.ema.europa.eu/ema/index.jsp?curl=pages/regulation/document_listing/document_listing_000212.jsp&mid=WC0b01ac058003380a.
[26]本刊讯.国家中医药管理局、国家发展和改革委员会发布《中医药“一带一路”发展规划(2016—2020年)》[J].中医杂志,2017,58(4):296.
[27]中华人民共和国国家中医药管理局.“十三五”中医药科技创新专项规划[N].中国中医药报,2017-06-12(003).
[28]中华人民共和国国务院办公厅.中药材保护和发展规划(2015—2020年)[N].中国中医药报,2015-04-29(003).
[29]中医药健康服务发展规划(2015—2020年)[J].中医临床研究,2015,7(12):前插2-前插4.
[30]中华人民共和国国务院.中医药发展战略规划纲要[N].中国中医药报,2016-02-29(003).
[31]中华人民共和国国务院新闻办公室.中国的中医药[N].上海中医药报,2017-01-27(002).
[32]栗征.国家中医药局印发《完善中医药政策体系建设规划(2015—2020年)》[J].中医临床研究,2015,7(33):后插2.
[33]中华人民共和国全国人民代表大会常务委员会.中华人民共和国中医药法[N].人民日报,2017-05-04(016).
(2019-05-29收稿 责任编辑:杨觉雄)
