中药糖肾方单体成分莫诺苷药理作用的研究进展
2020-10-12高骏伟许可吴宸广王立范李平
高骏伟 许可 吴宸广 王立范 李平

摘要 通过查阅近些年的国内外文献对中药糖肾方单体成分莫诺苷的药理作用及分子机制进行归纳、梳理、分析及总结。从分子机制角度阐述莫诺苷具有促进细胞生长、减轻炎性反应、抑制细胞内钙超载、抑制氧化应激、抗凋亡、抗凝等作用,以便为今后临床及实验研究提供更多科学依据。
关键词 糖肾方;莫诺苷;环烯醚萜类成分;药理作用;研究进展
Abstract The pharmacological effects and molecular mechanisms of the monomer component of the traditional Chinese medicine Tangshen Formula were summarized, combed, analyzed and summarized by consulting domestic and foreign literature in recent years. From the perspective of molecular mechanism, it is expounded that morroniside has the effects of promoting cell growth, reducing inflammatory response, inhibiting intracellular calcium overload, inhibiting oxidative stress, anti-apoptosis, anticoagulation, etc., so as to provide more scientific basis for future clinical and experimental research.
Keywords Tangshen formula; Morroniside; Iridoid terpenoids; Pharmacological effect; Study progress
中圖分类号:R285.6;R256.5;R255.4文献标识码:Adoi:10.3969/j.issn.1673-7202.2020.17.003
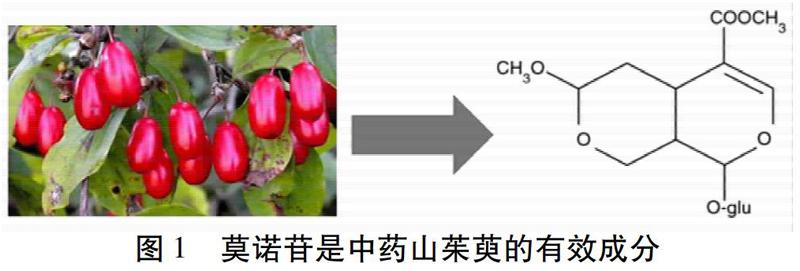
中药糖肾方(Tangshen Formula,TSF)颗粒是李平教授团队在传承国内名家的经验基础上,结合多年自身临床实践和现代研究成果研创的中药复方。该方由黄芪、生地黄、山茱萸、三七、鬼箭羽、熟大黄和枳壳七味药组成。该方功效为益气养阴,活血通络,体现了“肝肾同治”的科学内涵,在防治糖尿病肾病中发挥着多渠道、多通道、多靶点的独特优势。以往的研究已证实,TSF可减少糖尿病肾脏疾病(Diabetic Kidney Disease,DKD)患者尿蛋白,改善肾小球滤过率[1]。在动物实验中,TSF通过减轻炎性反应,抗纤维化以及改善脂质代谢紊乱来改善糖尿病所致的肾损伤[2-4],以及通过诱导AMPK/SIRT1途径介导的细胞自噬来改善肝脏脂肪变性[5]。然而,尽管中药复方疗效显著,但因其成分复杂及作用机制不明确,难以被国际学术界认可,所以研究化学结构明确的中药单体越来越受到重视。在我们前期的研究中发现,采用液相色谱-质谱联用技术(LC-MS)已证实莫诺苷为TSF灌胃小鼠血清中的单体化合物[6]。其中莫诺苷(C17H26O11)作为糖肾方中的一种环烯醚萜类化合物,主要来源于中草药山茱萸。见图1。近些年,国内外的研究表明莫诺苷具有减小大脑的梗死体积[7],促进神经细胞增殖和分化[8],促进血管再生[9],抑制血小板聚集[10],降低血液黏度[11],抗凝[12],保护心肌细胞[13],保护肾脏细胞[14]等作用。本文从分子机制角度就促进血管新生、促进细胞生长、减轻炎性反应、抑制细胞内钙超载、抑制氧化应激、抑制细胞凋亡、抗凝等方面作进一步系统总结,以期为莫诺苷的深入研究提供参考。
1 莫诺苷的药理作用
1.1 促进血管新生 血管新生是指通过血管内皮细胞的激活、增殖、迁移,在已有血管的基础上血管分裂、分支形成的血管和血管网[15]。新生的血管是神经祖细胞迁移至梗死周边的依附支架,其有利于缺血后脑损伤的神经功能恢复和组织的营养供应[16]。研究表明,莫诺苷可通过激活ephrinB2/VEGFR2和VEGF/VEGFR2信号通路,提高促进血管新生因子的蛋白表达水平,如血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、血管生成素-1(Angiopoietin-1,Ang-1)、成纤维生长因子-2(Fibroblast Growth Factor-2,FGF-2),进而促进脑组织、心肌缺血损伤后血管内皮细胞的分裂、增殖和迁移[7,9,13]。而且莫诺苷可明显上调血管内皮细胞特异性酪氨酸激酶受体-2(Endothelium-specific Receptor Tyrosine Kinase-2,Tie-2)的表达水平,对于缺血后受损区域周边血管的新生和重塑发挥着重要的作用[17]。
此外,通过对大脑中动脉闭塞(MACO)大鼠模型研究发现,莫诺苷可显著提高CD34蛋白表达水平,促进脑组织、心肌缺血损伤后血管新生[18]。内皮祖细胞(Endothelial Progenitor Cells,EPC)主要来源于骨髓单核细胞中的CD34+细胞,在外周血中含量非常少,但在组织缺血损伤后,EPC会从骨髓迁移至外周,归巢于损伤区,最终分化为成熟的内皮细胞,参与血管新生和修复[19],故CD34+作为EPC的主要表面标志物,是血管新生的重要观察指标。
1.2 促进细胞增殖和分化 Wnt信号通路是一条调控细胞的增殖、分化、凋亡和自我更新的信号通路,主要包括4条通路:β-连环蛋白(β-catenin)、T细胞因子/淋巴细胞-增强子-结合因子通路、细胞极性通路和Wnt-Ca2+通路。其中结肠腺瘤性息肉病基因(Adenomatous Polyposis Coli,APC)蛋白作为Wnt信号通路的负向调节因子,可促使β-catenin的降解,抑制Wnt通路的激活来达到调节细胞的增殖分化的作用。通过对大脑中动脉闭塞(MACO)大鼠模型研究发现,莫诺苷可抑制APC蛋白的表达,促进Wnt信号通路上游的重要配体Wnt7a的表达、激活Wnt/β-catenin通路,促进神经细胞的增殖和分化[8]。近期研究也表明,莫诺苷可激活多种Wnt信号通路下游分子,如β-catenin和淋巴增强因子1(Lymphoid Enhancer Factor 1,LEF1),诱导细胞因子TGF-β、IL-4分泌量增加,促进T细胞的活化和分化以及通过Wnt/β-catenin信号通路促进外根鞘细胞的增殖和迁移,调节毛囊的生长和发育[20-21]。
1.3 抑制血小板聚集 血小板聚集在血栓形成的过程中起着非常重要的作用。激活血小板聚集反应的途径非常复杂,目前至少有二磷酸腺苷(Adenosine Diphosphate,ADP)、血栓素A2(Thromboxane A2,TXA2)和血小板活化因子(Platelet Activation Factor,PAF)等3种途径。而细胞内游离的Ca2+为血小板的聚集和释放提供必要的物质基础,可通过多种途径来激活血小板,比如其活化磷脂酶A2作用于磷脂,从而产生活化血小板的主要递质血栓素(Thromboxane,TX)。而TXA2半衰期短,难以检测,TXB2作为TXA2的稳定代谢产物,常用作判断其浓度的指标。通过对ADP诱导的兔血小板聚集模型研究发现,莫诺苷能显著地减少TXB2的含量,从而抑制血小板的聚集,表明其有显著抗血栓的作用[10]。此外,环氧酶(Cyclooxygenase,COX)作为阿司匹林抗血小板聚集的作用靶点,莫诺苷能减少COX的含量从而抑制血小板的聚集[22]。
1.4 降低血液黏度 血液黏度是反映血液流动性质的重要指标,其升高会使血流速度下降,导致血液中凝血因子以及各种血细胞沉积在血管内,是血栓性疾病的重要原因之一。艾厚喜等[11]研究发现莫诺苷能有效地降低局灶性脑缺血损伤大鼠的红细胞比容(Hema-tocrit Percentage,Hct),降低血液黏度,其效果与阿司匹林类似。Hct是红细胞占全血容积的比值,它作为影响血黏度的重要因素,与血栓性疾病的发生密切相关,血液黏度会随着Hct的增加而升高。
1.5 抗凝 袁廷伟等[12]研究发现莫诺苷能有效地降低纤维蛋白原(Fibrinogen,Fib)含量,延长凝血酶原时间(Prothrombin Time,PT)、活化部分凝血活酶时间(Activated Partial Thromboplastintime,APTT)和凝血酶时间(Thrombin Time,TT),从而达到抗凝血的作用。以上4项是评判凝血功能以及指导临床用药的重要指标,其中APTT和PT主要反映内源性和外源性凝血系统状况;而TT主要反映Fib转为纤维蛋白的时间。当血小板被激活,血浆Fib的连接形成了血小板聚集体,最终形成血栓。
1.6 调节脂质代谢 固醇调节元件结合蛋白(Sterol Regulatory Element Binding Proteins,SREBPs)是调控脂肪酸合成、胆固醇合成的重要转录因子。在糖尿病患者中,高血糖可上调SREBP-1和SREBP-2的表达,导致肾脏中脂肪酸和胆固醇的合成增加。Park等[23]研究表明莫诺苷可通过下调db/db小鼠肾脏中SREBP-1和SREBP-2的表达来降低三酰甘油和胆固醇的含量,从而改善肾脏异常的脂质代谢。
1.7 其他 胰高血糖素样肽-1(Glucagon-like Peptide-1,GLP-1)受体是一种B类G蛋白偶联受体,主要分布于人类的胰岛、肺、心血管系统和中枢神经系统等组织中,脊髓中的GLP-1受体为控制慢性疼痛的潜在靶点,其特异性表达于脊髓背角的小胶质细胞,而且GLP-1受体激动剂可诱导小胶质细胞释放β-内啡肽以减轻神经性疼痛[24]。有研究表明,莫诺苷是GLP-1受体的邻位激动剂,在神经病理性疼痛模型中通过激活脊髓GLP-1受体产生抗超敏反应,达到止痛的作用[25]。
蛋白磷酸酶2A(Protein Phosphatase 2A,PP2A)是脑内主要的蛋白磷酸酶,在多种信号转导通路中发挥重要作用,包括细胞周期调控、细胞生长发育、细胞骨架动力学和细胞运动。有研究表明,莫诺苷能有效地提高PP2A活性,减弱Tau(Tubulin Associated Unit)蛋白的过度磷酸化,从而改善冈田酸诱导的神经细胞损伤[26]。具体而言,PP2A可介导Tau蛋白的去磷酸化,当PP2A活性降低时,Tau蛋白被过度磷酸化,导致微管的解体,神经细胞结构和功能的损害[27]。过度磷酸化的Tau蛋白在大脑中的积累是阿尔茨海默病(Alzheimer Disease,AD)的重要标志,而莫诺苷能抑制Tau蛋白的过度磷酸化,所以该项研究为莫诺苷作为AD的潜在治疗方案提供了参考。
2 莫诺苷可能的分子作用机制
2.1 减轻炎性反应 炎性反应是指具有血管系统的机体组织当受到损伤因素刺激时所产生的以防御反应为主的基本病理过程。莫诺苷可能通过以下途径来减轻炎性反应:1)在脑缺血再灌注损伤后,莫诺苷可通过提高金属蛋白酶组织抑制因子1(Tissue Inhibitor of Metalloproteinases 1,TIMP1)的表達,抑制基质金属蛋白酶(Matrix Metalloproteinases,MMPs)中MMP-2和MMP-9表达来达到保护及修复脑组织的作用[28-29]。具体而言,脑卒中后缺血区域的血氧供应不足,导致炎性反应、自由基增加,再灌注后血脑屏障通透性增加,大量神经细胞、胶质细胞死亡,微血管受损,最后导致缺血部位的组织坏死。MMPs是一类促进细胞外基质降解的蛋白酶,其中,MMP-2和MMP-9是MMPs家族中的重要成员,在生理及病理条件下,MMP-2和MMP-9被过度激活,加重炎性反应,促进血脑屏障基底膜的降解,引起血脑屏障的通透性增加,造成脑组织损伤[30]。TIMP通过与MMPs的结合来抑制MMPs的活性,从而阻止血脑屏障的破坏[31]。2)急性心肌梗死后炎性细胞因子IL-6、IL-1β和TNF-α水平会明显升高,且与病情的严重程度呈正相关,通过对结扎冠状动脉诱导的急性心肌梗死大鼠模型研究表明,莫诺苷能有效地抑制急性心肌梗死后IL-6、IL-1β和TNF-α的表达,从而发挥了减轻炎性反应、保护心肌细胞的作用[32]。3)核因子κB(Nuclear Factor Kappa B,NF-κB)是由Rel蛋白家族成员RelA(p65)、RelB、c-Rel、NF-κB1(p50)与NF-κB2(p52)组成的二聚体,它是一种能将信息从胞质传至胞核的重要转录因子,参与调控机体免疫、炎性反应及细胞凋亡等相关基因的转录。脑出血后NF-κB被激活,并诱导产生炎性反应因子如IL-1、TNF-α,最终导致脑组织损伤的加重[33]。袁志俊等[34]研究发现莫诺苷可通过促进小泛素相关修饰蛋白(Small Ubiquitin-related Modifier,SUMO)2/3竞争性结合NF-κB的抑制蛋白α(the Alpha Inhibitor of NF-κB,IκB-α)以抑制IκB-α的降解和NF-κB的激活,下调炎性反应因子IL-1和TNF-α的表达,从而明显减轻脑出血后血肿周围的炎性反应以及改善神经功能。此外,活化的IκB激酶(Inhibitor of Nuclear Factor Kappa B Kinase,IKK)能将IκB-α磷酸化并使其降解,从而激活NF-κB并启动炎性因子的转录,引发炎性反应。通过对MNNG联合不规律饮食诱导的慢性萎缩性胃炎大鼠模型研究发现,莫诺苷可抑制p65和p-IKKα/β的表达水平,显著上调IκB-α的表达水平,从而达到减轻炎性反应的作用[35]。近期研究表明莫诺苷可通过阻断STAT3/NF-κB通路,抑制炎性细胞因子的分泌,进而减轻结肠炎的炎性反应[36]。
2.2 抑制细胞内钙超载 线粒体作为钙库在生理状态下缓冲细胞内钙离子的水平,而维持细胞内钙稳态对于机体组织正常的生理功能发挥着关键的作用。王文等[37]研究证实莫诺苷可明显抑制H2O2引发的Ca2+内流,改善SH-SY5Y神经细胞形态和功能,推断莫诺苷可能直接作用于Ca2+通道,或者阻断与Ca2+通道的信号传导来发挥作用。在脑缺血时,神经元及神经胶质细胞的去极化抑制谷氨酸的重摄取,导致细胞外谷氨酸的蓄积,引发天冬氨酸受体过度兴奋,并介导其偶联的Ca2+通道开放以致Ca2+大量内流,而Ca2+浓度的异常增高引起线粒体通透性转换孔的开放,致使Na+、Cl-和水进入细胞,造成细胞的肿胀和ATP能量合成的终止,最终导致神经细胞的凋亡以及微血管、血脑屏障的破坏[37-38]。
2.3 抑制氧化应激 氧化应激是指机体受到有害刺激时体内活性氧、活性氮等高活性分子的产生过多,导致氧化程度超出细胞对氧化物清除的能力,氧化系统和抗氧化系统失去平衡,引起组织的损伤。莫诺苷可能通过以下4个方面来抑制氧化应激反应,实现对组织损伤的保护作用:1)研究表明莫诺苷通过抑制活性氧(Reactive Oxygen Species,ROS)和丙二醛(Malondialdehyde,MDA)的产生,同时抑制促凋亡基因Bax和刺激抗凋亡基因Bcl-2的表达,从而保护细胞免受氧化损伤[39-40]。ROS是一类含氧活性分子的总称,包括超氧阴离子自由基、过氧化氢、单线态氧、羟自由基、脂过氧化自由基等,其对于细胞信号转导以及维持细胞稳定发挥着非常重要的作用。在脑缺血时,磷脂酶A2被激活水解膜磷脂并释放游离脂肪酸,而线粒体内分泌型磷脂酶A2还破坏了线粒体呼吸链,使ROS生成增加,进而产生脂质过氧化物,并降解为有活性的醛类产物如MDA,其可间接反映组织中氧自由基的水平及细胞损伤的程度。2)研究表明莫诺苷通过抑制db/db小鼠肝脏中细胞色素C(Cytochrome C,CytC)的蛋白表达来改善氧化应激诱导的线粒体功能障碍,发挥其保护肝脏的作用[41]。在某些外界因素刺激下产生大量自由基,并激活线粒体膜通透性孔道开放,使大量CytC释放到胞质中,从而激活如Caspase-3等细胞凋亡相关酶[42]。3)通过对缺氧缺血性脑损伤大鼠模型研究发现,莫诺苷能显著上调心肌组织中Nrf2通路相关蛋白表达如血红素氧合酶-1(Heme Oxygenase-1,HO-1)和醌氧化还原酶1(NADPH Quinone Oxidoreductase-1,NQO1),提高谷胱甘肽(Glutathione,GSH)和超氧化物歧化酶(Superoxidase Dismutase,SOD)活性,减轻氧化应激的损伤,从而发挥抗氧化的作用[43]。细胞内的抗氧化系统主要包括:以SOD为代表的抗氧化酶系统和以GSH为代表的非酶抗氧化系统,两者共同发挥清除氧自由基的作用。Keap1/Nrf2/ARE信号通路是体内最重要的内源性抗氧化应激信号通路[44]。其中核因子E2相关因子2(Nuclear Factor Erythroid-2-related Factor 2,Nrf2)是细胞氧化应激反应中的关键因子,在正常状态下Nrf2与抑制因子Keapl结合存在于胞质内,当机体受到刺激时,Keapl的构象发生变化,释放并激活Nrf2信号通路,上调细胞保护因子HO-1、NQO1、GSH和SOD。4)通过对糖基化终末产物(Advanced Glycosylation end Products,AGEs)诱导的大鼠肾小球系膜细胞损伤模型研究发现,莫诺苷可通过AGEs-RAGE信号通路,抑制RAGE、p38MAPK和NF-κB蛋白的表达,从而减轻氧化应激的损伤,以达到对糖尿病肾损伤的保护作用[14]。在糖尿病肾病发展过程中,长期高血糖可促使体内还原糖与蛋白质发生非酶糖基化反应,从而形成AGEs。AGEs会与肾脏细胞表面受体RAGE结合,引起ROS生成增加,产生氧自由基,從而使膜蛋白功能受损、细胞钙离子内流,致使胞内钙离子浓度增高,最后诱发氧化应激反应,损伤细胞的功能和结构。前期研究发现,在糖尿病或终末期肾衰竭患者中,AGEs大多沉积在肾脏血管、组织结构中,如内皮细胞、系膜细胞、足细胞以及肾小管上皮细胞,并且AGEs通过氧化应激反应和多种细胞因子的过量产生等机制参与糖尿病肾病的进展[45]。
2.4 抑制细胞凋亡 细胞凋亡是指细胞在生长发育过程中受到某些因素的刺激,由细胞内基因及其产物所调控的细胞自主有序的死亡。而细胞凋亡过度是组织缺血再灌注损伤的主要原因[46],所以抑制细胞凋亡对于损伤的器官组织的功能恢复具有十分重要的意义。
莫诺苷可能会通过以下途径来抑制细胞凋亡:1)研究显示莫诺苷能使脑组织、胃组织、心肌细胞的抗凋亡基因Bcl-2表达增高和促凋亡基因Bax表达降低,Bcl-2/Bax比率提高,抑制组织中caspase-3的活化,表现出明显的抗凋亡能力[29,35,47-48]。Bcl-2家族成员包含抗凋亡成员如Bcl-2和促凋亡成员如Bax,两者与细胞凋亡关系密切。在脑缺血早期阶段,自由基的损伤和反复细胞膜的去极化所致的能量耗竭,导致级联式“瀑布反应”,引发血脑屏障破坏及神经细胞的凋亡。半胱氨酸蛋白酶家族(Caspase)与细胞凋亡机制有着密切的联系,而Caspase-3作为Caspase级联反应下游最重要的凋亡执行蛋白酶[49],在正常情况下一般是以酶原形式存在,只有在受到缺血、钙超载等因素的刺激后才会形成活化的Caspase-3。活化的Caspase-3会引起细胞皱缩、DNA裂解、染色质浓缩和凋亡小体形成等细胞形态的变化,故其可以反映组织细胞损伤的程度。2)杨炳友等[50]研究发现莫诺苷可通过抑制有丝分裂原活化蛋白激酶(Mitogen-activated Protein Kinase,MAPK)通路和NF-κB通路,抑制c-Jun氨基末端激酶(c-Jun N-terminal Kinase,JNK)蛋白磷酸化以致凋亡分子Caspase-3和Caspase-9表达下调,抑制细胞外信号调节激酶(Extracellular Signal-regulated Kinase,ERK)和p38蛋白磷酸化以致炎性因子IL-6、IL-Iβ显著减少,进而抑制TNF-α诱导的成骨细胞凋亡。MAPK信号通路是参与调控炎性反应和细胞凋亡的分子通路,其主要包括JNK、ERK和p38蛋白通路,磷酸化的JNK蛋白进入细胞内的线粒体从而启动细胞凋亡分子,磷酸化的ERK和p38蛋白可介导多种炎性反应因子的表达从而引起炎性反应。3)Cheng等[51]研究发现莫诺苷能显著提高软骨细胞Ⅱ型胶原和蛋白聚糖表达水平,表明莫诺苷对基质合成有促进作用,可以通过激活AKT/S6和ERK/p70S6K/S6通路来保护骨性关节炎(Osteoarthritis,OA)软骨细胞免受凋亡和基质耗竭的影响。蛋白激酶B(Protein Kinase B,AKT)以及ERK在关节软骨细胞的代谢过程中起着重要作用,可以调节细胞增殖、细胞凋亡和血管生成等多种细胞过程[51-52]。4)通过对MCAO再灌注大鼠模型研究发现,莫诺苷可抑制脑缺血所致的细胞周期蛋白D1(Cyclin D1)和周期蛋白依赖性激酶6(Cyclin-dependent Kinase 6,CDK6)的过量表达,抑制神经细胞进入异常细胞周期,从而发挥神经保护的作用[53]。细胞周期相关蛋白的异常激活与神经细胞的凋亡有着密切的联系,是脑缺血后神经细胞死亡的重要调控因素[53]。在正常细胞分裂时,细胞周期相关蛋白可促进细胞分裂增殖,但在病理因素刺激下,细胞周期相关蛋白被异常激活致使分化末期的细胞再次进入细胞周期,最后导致细胞死亡,在此过程中,参与细胞周期调控的蛋白有细胞周期蛋白、CDK和周期蛋白依赖性激酶抑制因子等。5)体外实验表明莫诺苷可通过激活Cyclin D1/CDK/P21信号通路,降低Cyclin D1、Bcl-2和提高P21、Bax的表达,以促进人恶性黑色素瘤细胞的凋亡,进而起到抗肿瘤的作用[54]。细胞周期的异常会导致细胞无限增殖,它是肿瘤细胞的显著特征之一,而细胞周期蛋白的异常表达会使肿瘤细胞具有侵袭、转移、耐药和抗凋亡的能力[55]。Cyclin D1是调节细胞周期G1/S期的主要周期蛋白[56],P21作为CKI家族成员,其可抑制Cyclin D1的活性,阻止细胞增殖,对细胞生长起着负向调节作用。
2.5 调控细胞自噬 自噬是广泛存在于真核细胞的自我保护机制,在接收到如氧化应激、感染、饥饿等自噬信号之后,细胞通过膜包裹需降解的产物形成自噬体,并与溶酶体融合形成自噬溶酶体,降解所包裹的产物,进而促进细胞新陈代谢和细胞器更新。而自噬在软骨细胞增殖分化过程中发挥着积极的作用。研究表明,莫诺苷可能通过PI3K/AKT/mTOR信号途径抑制人OA软骨细胞的自噬活性,进而起到对软骨细胞的保护作用,为治疗膝骨性关节炎提供了线索[57]。
3 结语
近期众多研究表明通过对莫诺苷药理作用及分子机制的研究,发现莫诺苷具有促进血管新生、促进细胞生长、减轻炎性反应、抑制细胞内钙超载、抑制氧化应激、抗凋亡、抗凝等作用。见表1。从传统中医药角度剖析,山茱萸作为莫诺苷主要的来源之一,性酸、涩,微温,入肝、肾经,功效为补益肝肾,收敛固脱,主治头晕目眩,耳鸣,腰膝酸痛,遗精遗尿,崩漏带下,虚汗不止。结合前期研究成果,我们推断莫诺苷适合作为保护神经、心肌、肾脏及软骨等细胞的药物,因此,进一步深入探索莫诺苷的分子作用机制及信号转导通路,可为临床治疗及实验研究提供参考。
参考文献
[1]Jin,Huang WJ,Meng X,et al.Chinese herbal medicine Tangshen Formula treatment for type 2 diabetic kidney disease in the early stage:study protocol for a randomized controlled trial[J].Trials,2019,20(1):756.
[2]Liu P,Peng L,Zhang H,et al.Tangshen Formula Attenuates Diabetic Nephropathy by Promoting ABCA1-Mediated Renal Cholesterol Efflux in db/db Mice[J].Front Physiol,2018,9:343.
[3]Du YG,Zhang KN,Gao ZL,et al.Tangshen formula improves inflammation in renal tissue of diabetic nephropathy through SIRT1/NF-κB pathway[J].Exp Ther Med,2018,15(2):2156-2164.
[4]刘鹏,陈姣伊,刘言振,等.糖肾方对db/db小鼠肾脏纤维化的保护作用[J].世界中医药,2018,13(6):1347-1353.
[5]Wang Y,Zhao H,Li X,et al.Tangshen Formula Alleviates Hepatic Steatosis by Inducing Autophagy Through the AMPK/SIRT1 Pathway[J].Front Physiol,2019,10:494.
[6]Wang Y,Zhao H,Li X,et al.Formononetin alleviates hepatic steatosis by facilitating TFEB-mediated lysosome biogenesis and lipophagy[J].J Nutr Biochem,2019,73:108214.
[7]Liu T,Xiang B,Guo D,et al.Morroniside promotes angiogenesis and further improves microvascular circulation after focal cerebral ischemia/reperfusion[J].Brain Res Bull,2016,127:111-118.
[8]薛金龙,孙芳玲,刘婷婷,等.莫诺苷对局灶性脑缺血再灌注大鼠Wnt7a和APC表达的影响[J].中国比较医学杂志,2014,24(9):9-13.
[9]Liu T,Sun F,Cui J,et al.Morroniside enhances angiogenesis and improves cardiac function following acute myocardial infarction in rats[J].Eur J Pharmacol,2020,872:172954.
[10]左玮,王晓锋,艾厚喜,等.莫诺苷对二磷酸腺苷诱导兔血小板聚集后血栓素B2的影响[J].中国康复理论与实践,2012,18(4):329-330.
[11]艾厚喜,孙芳玲,王晓峰,等.莫诺苷对局灶性脑缺血再灌注大鼠模型红细胞压积的影响[J].中国康复理论与实践,2014,20(3):230-232.
[12]袁廷伟,孙芳玲,王晓峰,等.莫诺苷对局灶性脑缺血再灌注大鼠凝血四项的影响[J].中国康复理论与实践,2013,19(2):104-106.
[13]王天博,崔加敏,劉婷婷,等.莫诺苷对急性心肌梗死大鼠梗死心肌周边组织中Ang-1及FGF-2表达的影响[J].心脏杂志,2019,31(3):266-269.
[14]Lv G,Lv X,Tao Y,et al.Effect of morroniside on glomerular mesangial cells through AGE-RAGE pathway[J].Hum Cell,2016,29(4):148-154.
[15]Shi FP,Wang XH,Zhang HX,et al.MiR-103 regulates the angiogenesis of ischemic stroke rats by targeting vascular endothelial growth factor(VEGF)[J].Iran J Basic Med Sci,2018,21(3):318-324.
[16]Fei X,Zhang X,Wang Q,et al.Xijiao Dihuang Decoction Alleviates Ischemic Brain Injury in MCAO Rats by Regulating Inflammation,Neurogenesis,and Angiogenesis[J].Evid Based Complement Alternat Med,2018,2018:5945128.
[17]Sun FL,Wang W,Cheng H,et al.Morroniside improves microvascular functional integrity of the neurovascular unit after cerebral ischemia[J].PLoS One,2014,9(6):e101194.
[18]刘敏,许栋明,孙芳玲,等.术后24h给予莫诺苷对局灶性脑缺血再灌注大鼠保护作用的研究[J].中国比较医学杂志,2019,29(2):19-24.
[19]馮源,韩志琪,周诺.内皮祖细胞促进血管发生及新骨生成辅助治疗骨缺损[J].中国组织工程研究,2020,24(25):4046-4053.
[20]吴仪,仇欣,张燕,等.莫诺苷对小鼠T细胞体外活化与分化的影响[J].江苏大学学报:医学版,2019,29(4):310-315.
[21]Zhou L,Wang H,Jing J,et al.Morroniside regulates hair growth and cycle transition via activation of the Wnt/β-catenin signaling pathway[J].Sci Rep,2018,8(1):13785.
[22]孙盼莉,魏守蓉,王晓锋,等.莫诺苷对二磷酸腺苷诱导兔血小板聚集后环氧酶的影响[J].中国康复理论与实践,2012,18(4):331-332.
[23]Park CH,Noh JS,Tanaka T,et al.Effects of morroniside isolated from Corni Fructus on renal lipids and inflammation in type 2 diabetic mice[J].J Pharm Pharmacol,2010,62(3):374-380.
[24]孙雨晴,王云.疼痛中枢敏化的新机制——肠促胰岛素信号的作用[J].国际麻醉学与复苏杂志,2018,39(9):892-895,904.
[25]Xu M,Wu HY,Liu H,et al.Morroniside,a secoiridoid glycoside from Cornus officinalis,attenuates neuropathic pain by activation of spinal glucagon-like peptide-1 receptors[J].Br J Pharmacol,2017,174(7):580-590.
[26]Yang CC,Kuai XX,Gao WB,et al.Morroniside-Induced PP2A Activation Antagonizes Tau Hyperphosphorylation in a Cellular Model of Neurodegeneration[J].J Alzheimers Dis,2016,51(1):33-44.
[27]吴虹辰,胡俊.Tau蛋白及其异常磷酸化在肌萎缩侧索硬化症中的研究进展[J].局解手术学杂志,2019,28(2):156-159.
[28]向本旭,孙芳玲,刘婷婷,等.莫诺苷对缺血再灌注大鼠皮层TIMP表达的影响[J].中国比较医学杂志,2016,26(1):1-6.
[29]Zeng G,Ding W,Li Y,et al.Morroniside protects against cerebral ischemia/reperfusion injury by inhibiting neuron apoptosis and MMP2/9 expression[J].Exp Ther Med,2018,16(3):2229-2234.
[30]Zeng C,Wang D,Chen C,et al.Zafirlukast protects blood-brain barrier integrity from ischemic brain injury[J].Chem Biol Interact,2020,316:108915.
[31]Hao FL,Han XF,Wang XL,et al.The neurovascular protective effect of alogliptin in murine MCAO model and brain endothelial cells[J].Biomed Pharmacother,2019,109:181-187.
[32]Yu B,Zhang G,An Y,et al.Morroniside on anti-inflammation activities in rats following acute myocardial infarction[J].Korean J Physiol Pharmacol,2018,22(1):17-21.
[33]唐亚楠,李萍.脑出血与核因子κB相关性的研究进展[J].中华老年心脑血管病杂志,2020,22(6):671-672.
[34]袁志俊,何晓英,袁平,等.莫诺苷通过抑制炎性反应改善脑出血模型大鼠的神经功能[J].中国组织工程研究,2018,22(8):1217-1222.
[35]Zhang J,Wang H.Morroniside protects against chronic atrophic gastritis in rat via inhibiting inflammation and apoptosis[J].Am J Transl Res,2019,11(9):6016-6023.
[36]Yuan J,Cheng W,Zhang G,et al.Protective effects of iridoid glycosides on acute colitis via inhibition of the inflammatory response mediated by the STAT3/NF-кB pathway[J].Int Immunopharmacol,2020,81:106240.
[37]Wang W,Sun F,An Y,et al.Morroniside protects human neuroblastoma SH-SY5Y cells against hydrogen peroxide-induced cytotoxicity[J].Eur J Pharmacol,2009,613(1-3):19-23.
[38]郎豐山,黄云霞,薛云,等.脑缺血再灌注损伤病理生理机制研究进展[J].食品与药品,2018,20(4):312-316.
[39]徐德国,常加松,黄艳,等.莫诺苷对过氧化氢诱导PC12细胞损伤的保护作用[J].解放军药学学报,2018,34(2):116-119.
[40]Zhang JX,Wang R,Xi J,et al.Morroniside protects SK-N-SH human neuroblastoma cells against H2O2-induced damage[J].Int J Mol Med,2017,39(3):603-612.
[41]Park CH,Noh JS,Kim JH,et al.Evaluation of morroniside,iridoid glycoside from Corni Fructus,on diabetes-induced alterations such as oxidative stress,inflammation,and apoptosis in the liver of type 2 diabetic db/db mice[J].Biol Pharm Bull,2011,34(10):1559-1565.
[42]Zheng JH,Xie L,Li N,et al.PD98059 protects the brain against mitochondrial-mediated apoptosis and autophagy in a cardiac arrest rat model[J].Life Sci,2019,232:116618.
[43]周景昱,张亮,雷晓玲,等.莫诺苷对缺氧缺血性脑损伤新生大鼠心肌损伤和氧化应激的保护作用[J].解剖学研究,2019,41(4):256-262.
[44]Hassanein E,Sayed AM,Hussein OE,et al.Coumarins as Modulators of the Keap1/Nrf2/ARE Signaling Pathway[J].Oxid Med Cell Longev,2020,2020:1675957.
[45]Bettiga A,Fiorio F,Di Marco F,et al.The Modern Western Diet Rich in Advanced Glycation End-Products(AGEs):An Overview of Its Impact on Obesity and Early Progression of Renal Pathology[J].Nutrients,2019,11(8):1748.
[46]许静,霍康,宋银雪,等.rhBNP通过抑制细胞凋亡减轻大鼠心肌缺血再灌注损伤[J].基因组学与应用生物学,2020,39(3):1420-1425.
[47]白玉杰,唐世琪,武留信,等.莫诺苷对大鼠心肌缺血再灌注损伤的保护作用及可能机制[J].中华全科医学,2017,15(9):1466-1468.
[48]Pi WX,Feng XP,Ye LH,et al.Combination of Morroniside and Diosgenin Prevents High Glucose-Induced Cardiomyocytes Apoptosis[J].Molecules,2017,22(1):163.
[49]杨涛,费振海,钟兴明.Caspase家族与细胞凋亡的研究进展[J].浙江医学,2018,40(18):2083-2087,2091.
[50]杨炳友,刘艳,林晓影,等.莫诺苷对TNF-α诱导MC3T3-E1细胞炎性反应的保护作用及机制研究[J].中草药,2018,49(16):3776-3780.
[51]Cheng L,Zeng G,Liu Z,et al.Protein kinase B and extracellular signal-regulated kinase contribute to the chondroprotective effect of morroniside on osteoarthritis chondrocytes[J].J Cell Mol Med,2015,19(8):1877-1886.
[52]Qi H,Liu DP,Xiao DW,et al.Exosomes derived from mesenchymal stem cells inhibit mitochondrial dysfunction-induced apoptosis of chondrocytes via p38,ERK,and Akt pathways[J].In Vitro Cell Dev Biol Anim,2019,55(3):203-210.
[53]刘婷婷,许栋明,孙芳玲,等.莫诺苷对脑缺血再灌注大鼠海马细胞周期蛋白表达的影响[J].实验动物科学,2018,35(6):66-69.
[54]李娜,李绍民,张宁,等.莫诺苷对人恶性黑色素瘤细胞增殖及凋亡的调控机制[J].生物技术通讯,2017,28(2):128-132.
[55]Liu K,Zheng M,Lu R,et al.The role of CDC25C in cell cycle regulation and clinical cancer therapy:a systematic review[J].Cancer Cell Int,2020,20:213.
[56]Huo D,Jiang S,Qin Z,et al.Omethoate induces pharyngeal cancer cell proliferation and G1/S cell cycle progression by activation of Akt/GSK-3β/cyclin D1 signaling pathway[J].Toxicology,2019,427:152298.
[57]Xiao Z,Wang J,Chen S,et al.Autophagy promotion enhances the protective effect of Morroniside on human OA chondrocyte[J].Biosci Biotechnol Biochem,2020,84(5):989-996.
(2020-08-01收稿 责任编辑:王明)
