健脾法联合肠内营养对溃疡性结肠炎大鼠肠道菌群的影响
2020-10-12潘丹峰苍玉珍沈峰林寒潇
潘丹峰 苍玉珍 沈峰 林寒潇


【关键词】健脾法;肠内营养;溃疡性结肠炎;肠道菌群
溃疡性结肠炎(UC)是结肠黏膜的一种特发性炎症性疾病,通常由直肠以连续的方式向近端延伸至部分或整个结肠,主要临床表现有腹痛、腹泻和便血等[1]。UC患者中营养不良和特定的营养素缺乏很常见,因此在治疗UC过程中药物和营养的结合可以进一步缓解疾病[2]。大量的临床研究发现,给予UC患者肠内营养(EN)治疗不仅能够改善患者的营养状况,而且还可以通过减少炎性因子的释放和影响胃肠道菌群构成等途径减轻UC的炎症反应[3]。但有研究发现部分患者在应用EN治疗之后耐受性欠佳,部分出现腹胀、腹泻等不良反应[2]。单纯的EN处理可能对于UC的治疗存在一定的局限性,因此有必要对EN进行适当的调整、改良。
中医治疗中“脾胃为后天之本、气血生化之源”的理论,与现代EN治疗原则是类似的,有研究发现部分健脾中医药方可以通过调节肠道菌群来缓解UC的症状,因此可以在传统中药方中探索能改善EN治疗UC的方法[4-5]。健脾方是以四君子汤为基础的经典传统中草药配方,其药物组成为党参、白术、云苓、甘草,被广泛用于改善胃肠道疾病[6]。在本研究中,我们探索健脾法联合EN对葡聚糖硫酸钠(DSS)诱导的UC大鼠的肠黏膜保护作用,并通过对大鼠粪便的肠道菌群进行测序分析,探讨其对肠道菌群的影响。
材料与方法
一、健脾方的成分与制备
健脾方的四种草药均为本院中药房提供。对各成分进行准确称重之后,先在蒸馏水中浸泡30min,然后使用加热回流法提取2次(第1次1h,第2次45min)。在减压和恒定体积下将提取物蒸发至相当于1g/ml的粗药,滤过,放凉后待用,见表1。
二、实验动物与造模
60只SD大鼠,4周龄,体质量120~150g。实验过程中,大鼠在清洁级动物房内饲养,予大鼠标准饮食,自由饮用灭菌用水。采用DSS法构建大鼠UC模型,配置5%(w/v)的DSS溶液供给大鼠自由饮用,7d后诱发急性肠炎。
三、动物的分组与给药
UC模型建立完成后,将60只大鼠按体质量随机分为空白组、模型组、EN组、健脾组、EN联合健脾(EN+健脾)组,每组12只,雌雄各半。除空白组外,其余各组均采用DSS法复制UC模型。空白组自由饮食、饮水;模型组的大鼠予少渣饮食,自由饮水,2组均每天通过灌胃法予生理盐水25ml/kg(分3次)。健脾組的大鼠在少渣饮食基础上给予健脾方,健脾方成人的每日剂量约为3.3g/kg,大鼠与人体间的等效剂量的换算系数为6.17,故设置大鼠的健脾方剂量为每日0.54g/kg,分3次灌胃[7]。EN组使用全安素配方粉(美国雅培制药公司)配制成4.18kJ/ml的混悬液,即用23.25g营养粉加灭菌注射用水配成100ml营养液(每100ml含蛋白质3.7g、碳水化物13.3g、脂肪3.3g,能量418kJ),喂养剂量参考之前的动物研究,设置大鼠每日用量为160ml/kg,分3次灌胃[8]。EN+健脾组将健脾方加入营养液中,通过灌胃法分3次给予。各组均连续喂养14d。本实验符合动物实验相关伦理规范。
四、疾病活动指数(DAI)评分
DAI常用于评估大鼠UC的严重程度。在实验期间观察和记录大鼠在整个实验过程中的一般状况,并根据粪便性状、便血和体质量降低程度评分:①粪便性状(0分,正常;1分,松散;2分,黏液便;3分,稀烂便);②便血(0分,潜血试验阴性;2分,阳性;4分,肉眼可见);③体质量减轻的百分比(0分,无体质量减轻;1分,1%~5%;2分,5%<百分比<10%;3分,10%~15%;4分,>15%)。DAI评分为上述3个参数之和[5]。
五、结肠长度测量及病理学检查
结肠长度是反映结肠直肠炎症严重程度的一个重要指标。处死大鼠后快速摘取盲肠及整段结肠,使用尺子测量、记录结肠的长度。并将远端结肠及回盲部组织切成小块,制作成病理切片之后,送病理科,由专业技术人员按照Cooper的方法对结肠炎症浸润和杯状细胞缺失情况进行组织学损伤(HI)评分[9]。
六、粪便样本的采集及菌群16S测序
在处死大鼠的时候,立即采集各组大鼠盲肠末端的粪便样品放于EP管中,避免外界污染,将粪便样品置于-80℃冰箱中保存。首先使用DNeasyPowerSoil试剂盒(QIAGEN)提取各组大鼠粪便的总基因组DNA,并用NanoDrop分光光度计检测DNA浓度和质量。由北京基诺来普生物科技有限公司提供肠道菌群的引物,使用Illuminamiseq平台对合格的样品进行测序。将相似度>97%的序列归类为同一操作分类单元(OUT),使用QIIME软件(v1.80)执行α多样性分析,计算Shannon指数和Chao1指数,统计门水平和科水平OUT聚类情况,进行相对丰度的分析。
七、统计学处理
所有数据均采用SPSS17.0进行分析。使用Shapiro-Wilk法对数据进行正态性检验,正态分布数据以表示,组间比较采用单因素方差分析,各组与模型组和EN组之间的两两比较采用LSD-t检验;非正态分布数据以中位数(下四分位数,上四分位数)表示,组间比较采用Kruskal-Wallis秩和检验,各组之间的两两比较采用Bonferroni法(α'=0.05/10)。所有检验均为双侧检验,α=0.05。
结果
一、对UC大鼠体质量和DAI的影响
连续7d在饮用水中添加5%DSS,诱发大鼠产生UC。在建模过程中,大鼠出现严重腹泻、粪便隐血、体质量下降等与人UC类似的症状。在第21日,各实验组大鼠体质量变化率差异有统计学意义(F=17.741,P<0.001)。与空白组(120.1%±11.2%)相比,DSS处理组(74.4%±9.6%)体质量下降(P<0.001)。但是与模型组相比,EN组(92.0%±7.6%,P=0.010)和EN+健脾组(105.3%±11.5%,P=0.003)的大鼠体质量下降程度较小;同时与EN组相比,EN+健脾组中的大鼠体质量下降程度降低(P=0.033),见图1。
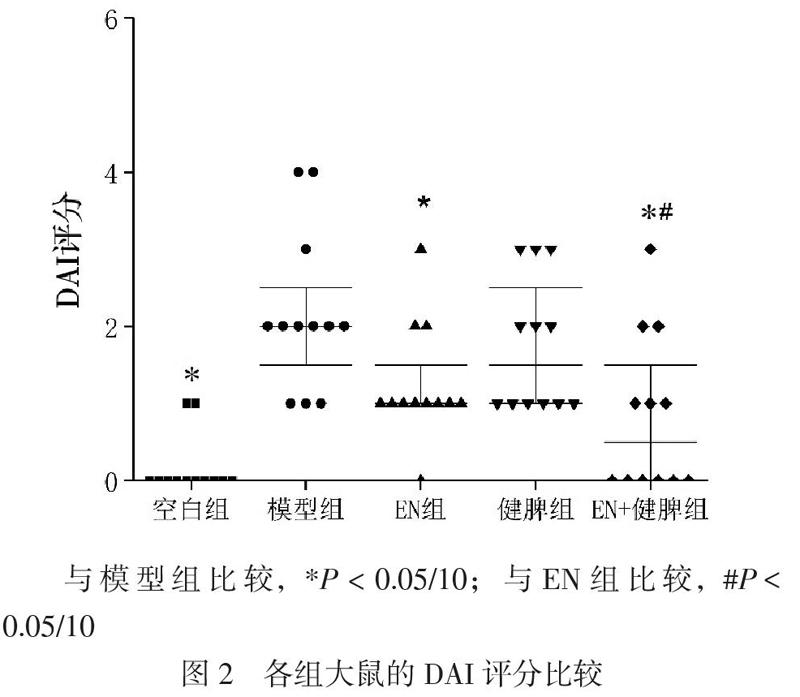
秩和检验发现,各组的DAI评分差异存在统计学意义(H=20.204,P<0.001)。与空白对照相比,DSS处理的大鼠DAI评分高[2.0(1.8,2.8)分,P=0.006]。EN组[1.2(1.0,1.8)分,P<0.05/10]和EN+健脾组[0.5(0,1.2)分,P<0.05/10]的DAI评分低于模型组,而健脾组的DAI评分[1.5(1.0,2.5)分]和模型组比较差异无统计学意义(P=0.522)。另外,EN+健脾组大鼠的DAI评分低于EN组(P<0.05/10),见图2。
二、对结肠长度及HI评分的影响
实验结束时,各组大鼠结肠长度比较差异有统计学意义(F=20.206,P<0.001)。与空白组的(9.69±1.41)cm相比,模型组的大鼠结肠长度为(5.93±1.17)cm,2组比较差异有统计学意义(P<0.001)。EN[(7.71±1.10)cm,P=0.022]和EN+健脾组(8.47±1.33cm,P<0.001)大鼠的结肠均长于模型组。健脾组大鼠结肠长度[(6.08±1.12)cm]与模型组比较差异无统计学意义(P=0.754)。另外EN+健脾组大鼠的结肠长度也长于EN组,差异亦有统计学意义(P=0.002),见图3。
各组的HI评分存在统计学差异(F=8.338,P<0.001)。模型组大鼠的结肠组织发生了黏膜病变、坏死以及单核细胞和中性粒细胞等炎性细胞浸润,HI评分高于空白组(P<0.001)。EN处理表现出明显的保护作用,组织炎症程度较轻(P=0.022),而健脾组未发现对炎症有保护作用(P=0.870)。EN+健脾组大鼠的HI评分低于EN組,差异有统计学意义(P<0.012),见图4。
三、对大鼠肠道菌群多样性的影响
各实验组大鼠肠道菌群多样性存在统计学差异(Shannon指数:H=15.661,P=0.004;Chao1指数:H=13.514,P=0.009),DSS处理后大鼠的肠道菌群的α多样性降低(Shannon指数:P<0.05/10;Chao1指数:P<0.05/10),健脾组未能改善菌群的多样性(Shannon指数:P=0.527;Chao1指数:P=0.668),而采取EN(Shannon指数:P<0.05/10;Chao1指数:P<0.05/10)以及EN+健脾(Shannon指数:P<0.05/10;Chao1指数:P<0.05/10)的联合处理能改善微生物的多样性。其中EN+健脾组大鼠肠胃菌群的α多样性高于EN组(Shannon指数:P<0.05/10;Chao1指数:P<0.05/10),见图5。
四、对大鼠肠道菌群构成比的影响
各组之间肠道菌群构成存在统计学差异(H=16.61,P<0.001)。在门水平上,与空白组相比,模型组中潜在肠道病原体(变形菌门和拟杆菌门)的相对丰度增加(P<0.05/10),而潜在有益菌(厚壁菌门)下降(P<0.05/10);在科水平上,UC大鼠的双歧杆菌和乳杆菌科的相对丰度均下降(P<0.05/10),而肠杆菌科增加(P<0.05/10);这些结果提示UC大鼠的肠道正常菌群结构被破坏。值得注意的是,与模型组相比,EN(P<0.05/10)和EN+健脾(P<0.05/10)处理均能抑制肠杆菌和拟杆菌科菌群的生长,降低其相对丰度,促进乳杆菌和双歧杆菌科菌群的生长,提高其相对丰度;此外,与EN组相比,EN+健脾组能够进一步增加有益细菌相对丰度及降低有害菌的相对丰度(P<0.05/10),见图6。
讨论
据报道,UC在人群中的发病率为35/10万~100/10万[10]。此外,一项全球性流行病学研究报告称,近年来亚洲的UC发病率增长较快[11]。长期反复的UC严重影响患者的生活质量和劳动能力,但UC的病因和发病机制仍不清楚,目前认为可能与遗传易感性、肠道菌群及免疫因素有关[1]。
DSS诱导大鼠急性UC的临床症状或病理变化与人类UC非常相似,同时DSS饮用水建模方法简单,可重现高,故本研究中应用这一经典的UC建模方法[12]。EN支持是UC治疗的一个重要手段,它在改善机体的营养状况的同时,有维护肠黏膜屏障、促进肠黏膜上皮修复的作用,从而减少肠道细菌和内毒素的易位[3]。但EN实施效果个体差异较大,部分UC患者使用后出现胃肠不耐受的症状如腹胀腹泻等,使EN不能有效发挥作用,UC的症状得不到明显改善。近年来有不少研究探索中医和西医的联合治疗,并已证明多个中医药方有助于改善UC的症状,如实验研究发现半夏泻心汤与黄芩汤具有抗炎和抗氧化的效果,能缓解DSS诱导的结肠炎[13-14]。本研究探索联合应用健脾方和EN对UC的效果。实验结果表明,单纯EN能缓解UC的症状,与以前的研究一致[15]。另外,健脾方和EN的联合干预可进一步缓解UC大鼠的临床症状和减少病理损害,表明健脾方联合EN用于UC比单独使用EN更有效,其机制可能是健脾中药增强了EN的黏膜修复功能。
人体的肠道菌群数量庞大、种类繁多,包括益生菌、共生菌和致病菌群三大类,它们构成了一个复杂的微生态系统,正常情况下的肠道各类细菌处于一种动态平衡,有助于维持宿主的“健康状态”。很多因素包括疾病、饮食结构、药物等都可能对肠道菌群的构成和功能产生不同的影响。一旦肠道菌群平衡受到破坏,就可引起黏膜层的过度消耗和肠黏膜上皮细胞凋亡加速,导致肠黏膜屏障的受损[4]。另外,当致病菌数量增加会引发强烈的肠道免疫反应,导致肠道多种炎症因子分泌增加,后者又进一步加重肠道菌群的紊乱并对肠道黏膜造成更大的损害,并最终诱导或促进UC的形成和消化吸收功能障碍[16]。近年来越来越多的研究关注UC和肠道菌群之间的关系,肠道菌群平衡已被认为是UC发病的关键因素之一[5]。临床研究发现UC患者存在着肠道菌群失调,是影响本病的重要内环境因素。其中UC患者的肠道菌群通常表现出病原菌数量不断增加,而益生菌减少,UC患者的血清中对微生物抗原的抗体水平高于健康对照[17]。
在本研究中,通过16SrRNA基因测序,我们进一步研究了健脾方和EN处理对UC大鼠肠道菌群结构的影响。结果发现UC模型组肠道菌群的结构显著改变,表现为与对照组相比,拟杆菌和变形杆菌的丰度增加,而厚壁菌的丰度降低,并且细菌α多样性降低。结果与之前的研究基本一致[4,18-19]。EN以及EN和健脾的联合处理都能显著改善UC大鼠肠道菌群,使其菌群构成及细菌丰度趋于正常。值得一提的是,健脾方联合EN给药与单独EN相比,能够增加肠道菌群的多样性,降低潜在致病菌群的相对丰度,表明两者的联合处理更有利于维护正常菌群,对致病菌有更强的抑制作用。另外在肠道菌群中,乳杆菌和双歧杆菌被证实是对人体有益的细菌,有研究证明它们能上调肠上皮紧密连接蛋白的表达对肠黏膜具有保护作用,并可改善结肠炎的临床症状[20-21]。本研究结果显示,乳杆菌和双歧杆菌的相对丰度在UC大鼠中降低,与一些文献的结果一致[21]。EN联合健脾的干预较单独EN能进一步提高UC大鼠肠道中乳杆菌和双歧杆菌的丰度,表明其对UC大鼠的肠道菌群结构有更积极的调节作用。即健脾和EN的联合作用可能是通过抑制UC大鼠中肠道有益细菌的减少和病原细菌的生长,来维持肠道菌群的稳定性,进而为缓解UC大鼠的症状提供有力条件。
综上所述,健脾法联合EN可能通过调节UC大鼠肠道菌群的稳态和多样性,增加益生菌数量,降低潜在致病菌数量,从而缓解大鼠肠道炎症。
